锑离子添加剂对低共熔溶剂(DES)电解液液流电池的性能改善研究
2021-06-30纪燕男孙培茁马强张玮琦苏华能徐谦
纪燕男,孙培茁,马强,张玮琦,苏华能,徐谦
(1南通理工学院电气与能源工程学院,江苏南通226002;2江苏大学能源研究院,江苏镇江212013)
引 言
随着近年来全球能源短缺和环境污染问题日益严重,人们对于新能源的需求日益增长。但新能源(例如风能、太阳能)普遍存在能量供应间歇性、不稳定性、供求之间有时空差异等问题,需要通过有效、可靠的储能技术来解决[1]。在各种储能技术中,氧化还原液流电池(redox flow batteries,RFBs)是一种前景可观的大规模储能技术[2-3]。不同于传统电池,溶解的活性物储存在液罐中,流经电池堆,发生氧化还原反应。液流电池可以针对功率和容量进行独立设计,并根据需要灵活配置[4]。自1974年Thaller[5]提出氧化还原液流电池以来,人们对其进行了广泛的研究。通常,用于液流电池的电解质可分为水系和非水系电解质。目前,水系液流电池得到了广泛的研究[6-7],而非水系电解质由于其更宽的电化学窗口(1.5~5 V)[8-9],受到越来越多的关注。然而,由于有机溶剂的固有特性,如挥发性和毒性,电池系统可能会出现潜在的安全隐患[10]。因此,研究人员提出了离子液体(ILs)来解决这一问题。
离子液体具有较宽的电化学窗口,高热稳定性和低挥发性的优势[11-12]。近年来,研究人员通过将有机卤化物与氢键供体结合,获得了一种稳定的离子液体,命名为“低共熔溶剂”(deep eutectic solvent,DES)[13-14]。DES比普通离子液体价格低廉,对反应环境的要求也更低。因此,最近涌现出一系列关于DES应用于RFB的研究[15-16]。Lloyd等[17]在乙酰胆碱低共熔溶剂(一种氯化胆碱和乙二醇的混合物)中展示了一种全铜混合液流电池,结果表明铜离子RFB在DES电解液中的放电效率可以达到94%。Xu等[18-19]研究了用于低共熔溶剂液流电池的Fe(Ⅱ)/Fe(Ⅲ)和V(Ⅲ)/V(Ⅱ)氧化还原电对的物理和电化学性质。然而,研究发现V(Ⅲ)/V(Ⅱ)的氧化还原反应动力相对缓慢,这将影响电池的性能[20]。为了解决这一问题,在电解液中引入添加剂是改善氧化还原动力学的一种切实可行的方法[21-22]。
由于锑(Sb)具有成本低、催化活性高及稳定性好等优点,在化学催化领域得到了广泛的应用[23-24]。2015年,Shen等[25]将三氯化锑应用于全钒液流电池(VRFB)中。研究表明,添加三氯化锑可以提高V(Ⅲ)/V(Ⅱ)的电化学活性和氧化还原动力学。受锑离子在VRFBs中作为添加剂的启发,本文通过黏度和电导率测试、循环伏安法(CV)、电化学阻抗谱法(EIS)和充放电测试,研究了Sb3+离子对DES电解液电化学性能的影响。用扫描电镜(SEM)表征石墨毡充放电实验后的形态。与VRFBs相比,在非水系DES电解液液流电池中使用Sb3+离子作为添加剂,在降低电解液黏度、改善氧化还原离子对的电化学活性和反应动力学方面具有更显著的效果,为提高非水系液流电池的性能提供了一种有效的途径。
1 实验
1.1 电解液的制备
将氯化胆碱(国药试剂67-48-1,98.0%)和乙二醇(国药试剂107-21-1,99%)按照1∶2的摩尔比例进行混合制备DES,通过恒温干加热器,在120℃下持续搅拌10 min直至形成无色透明的溶液,将其称之为ethaline,并在室温下进行冷却。配制好的ethaline要及时保存在密封的玻璃罐中,以防止空气中的氧气和水蒸气等物质对电解液造成污染。在ethaline中 分 别 加 入0.1 mol·L-1的FeCl2(99.5%,Macklin,无水)和0.1 mol·L-1的VCl3(99%,Ourchem)以制备正负极电解液。将SbCl3(99.5%,国药控制化学试剂有限公司)分别以5、10、15、20、25 mmol·L-1的浓度加入到VCl3电解液中。图1为配制好的含不同浓度SbCl3的VCl3电解液,从图1中可以看出,当SbCl3的浓度达到25 mmol·L-1时,密封罐的底部出现了白色的晶状沉淀,即溶液达到了过饱和状态。因此在实验中仅研究了含0~20 mmol·L-1的SbCl3的电解液。

图1 含有不同浓度SbCl3的VCl3电解液Fig.1 Electrolytes with different concentrations of SbCl3
1.2 黏度及电导率测试
采用DV-2+PRO数字式黏度计和电导率仪(DDS-307A型)分别测试含有不同浓度SbCl3添加剂的电解液的黏度和电导率。在室温[(25±1)℃]下测量,通过热电偶测温仪实时检测溶液的温度,每个Sb3+浓度下测量3次,并取平均值进行记录。
1.3 拉曼光谱
使用光谱分辨率小于2 cm-1的激光拉曼光谱仪(LRS,美国ThermoFisher)对电解液进行拉曼光谱的测试。将含0.1 mol·L-1VCl3的ethaline作为初始溶液(记作pristine),与加入15 mmol·L-1Sb3+的电解液进行对比。
1.4 电化学测量
实验使用辰华CHI600电化学工作站进行电解质的循环伏安及电化学阻抗的测量。测量过程中使用的是传统的三电极体系,将直径为5 mm的石墨电极作为工作电极,铂电极作为对电极,饱和甘汞电极(SCE)作为参比电极。在每次测试开始之前,石墨电极用1200粒度的SiC纸进行抛光,然后用去离子水洗涤,并且用超声波进行清洗,超声时间不宜过长,以防对电极造成损坏。
这些测量均在室温[(25±1)℃]下进行,测量的电解液中含有的氧化还原活性物质的浓度均为0.1 mol·L-1。测试开始之前,用高纯氮气(N2,99.999%)对电解液进行吹扫,至少20 min,除去所有的溶解氧。在-1.2~0.2 V的电压范围内对含有不同浓度SbCl3添加剂的电解液进行循环伏安扫描,每组实验重复三次。同时,在电化学阻抗光谱实验中,施加于电池的正弦激发电压为5 mV。频率范围设置为0.01 Hz~100 kHz。电位固定在-0.48 V,以确保实验过程中在加入不同浓度的添加剂的情况下具有相似的极化。
1.5 充放电测试
充放电实验是在RFB单动态电池中进行的。在充放电实验过程中,采用两种不同的质子交换膜来分离电池的阳极和阴极,分别为G-1204均相阴离子交换膜(日本旭硝子公司)和Nafion 115膜(美国杜邦)。电极采用的是导电性好的石墨毡(GFA系列,SGL®德国),其反应的活性面积为4.0 cm2(2.0 cm×2.0 cm),并利用聚四氟乙烯(PTFE)垫片进行电池组件的密封,防止实验过程中发生漏液现象。正极电解液为含有0.1 mol·L-1FeCl2的ethaline溶液,负极初始电解液为含有0.1 mol·L-1VCl3的ethaline溶液,以5 mmol·L-1间隔加入浓度为0~20 mmol·L-1的SbCl3作为对比溶液。将电解液储存在电池外部的储液罐内,并在电池运行期间通过蠕动泵以25 ml·min-1的流量将电解液循环地泵送到相应的隔室中。利用Arbin BT2000(美国Arbin仪器公司)电池测试系统测量电池的极化曲线及充放电性能。在室温下,以±2.0 mA·cm-2的恒定电流密度对电池进行了充放电循环实验。
1.6 物理化学测量
将含有不同浓度SbCl3作为添加剂进行充放电循环实验结束的石墨毡电极进行表征。通过场发射扫描电子显微镜(FESEM,JSM-7800F)在15 kV下检查石墨毡的形貌,同时利用EDX鉴定样品上存在的颗粒。
2 结果和讨论
2.1 黏度及电导率测试
含有不同浓度Sb3+离子的电解液在室温[(25±1)℃]下的黏度和电导率值如表1所示。从表中数据可以观察到,Sb3+离子的加入对于电解液的黏度和电导率的影响不是很明显,但是存在着黏度值小幅下降及电导率小幅升高的现象,并且在Sb3+离子为15 mmol·L-1时达到最佳。离子的电导率与溶液的黏度有关。Sb3+离子加入后,在低浓度范围内,溶剂的黏度降低,离子运动的阻力减小,离子运动速率加快,因而溶剂的电导率增加。但是在电解液中离子之间存在着一定的相互作用,Sb3+离子浓度进一步增大后,离子之间的距离减小,相互作用增强,这就增加了离子运动的阻力从而使电导率降低。因此当Sb3+离子增加至20 mmol·L-1时,黏度值有所升高,电导率也有所下降。
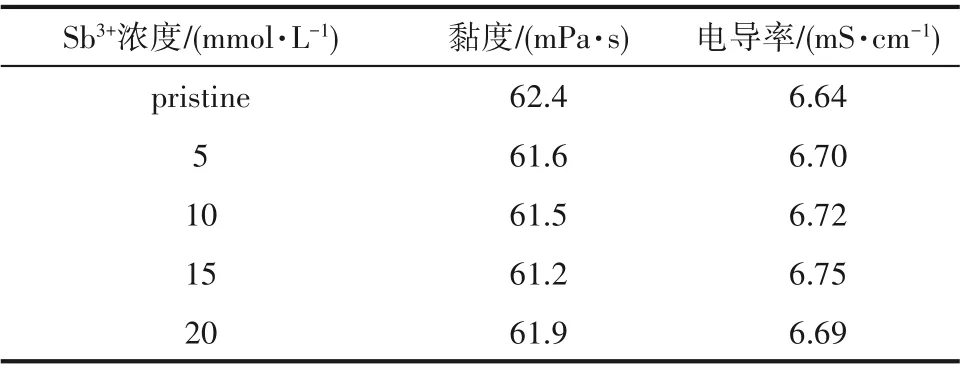
表1 含有不同浓度Sb3+离子的电解液的黏度和电导率值Table 1 Viscosity and conductivity of electrolytes with different concentrations of Sb3+ions
2.2 拉曼光谱
将没有加入添加剂的V(Ⅲ)电解液和含有15 mmol·L-1Sb3+离子的V(Ⅲ)电解液进行拉曼光谱的实验,其Raman光谱如图2所示。通过查阅氯化胆碱和乙二醇的拉曼光谱,发现图中717、869 cm-1处的特征吸收峰对应的是氯化胆碱,957 cm-1处的特征吸收峰对应的是乙二醇。从图上看,添加入Sb3+离子后电解液中没有出现新的吸收峰或是明显的峰位置偏移,因此初步判定Sb3+离子没有与钒离子发生化学反应而形成新的物质,即Sb3+离子的添加不会改变电池内部的氧化还原反应。
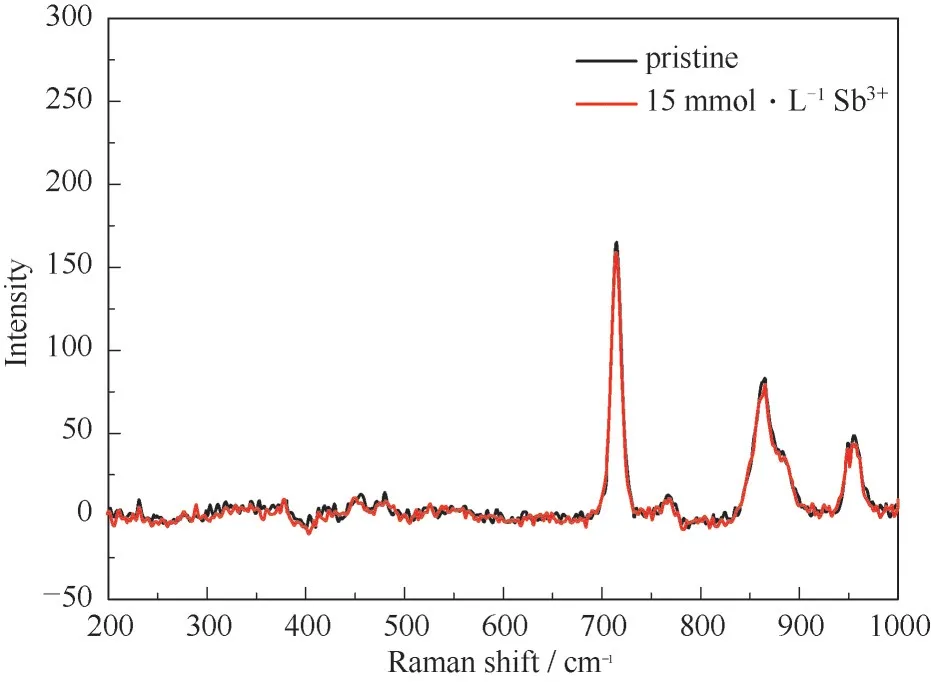
图2 0.1 mol·L-1 V(Ⅲ)电解质中加入15 mmol·L-1 Sb3+离子前、后的拉曼光谱Fig.2 The Raman spectra of 0.1 mol·L-1 V(Ⅲ)electrolyte with and without 15 mmol·L-1 Sb3+ions
2.3 电化学测量
2.3.1 循环伏安测试 首先对空白的ethaline DES进行了循环伏安的测试,扫描的电压从-2.0~0.8 V,实验所获得的CV曲线如图3所示。可见与传统的水系液流电池相比,以ethaline为电解液的电池具有更宽的电化学窗口,并且在扫描区域中没有氧化还原峰。
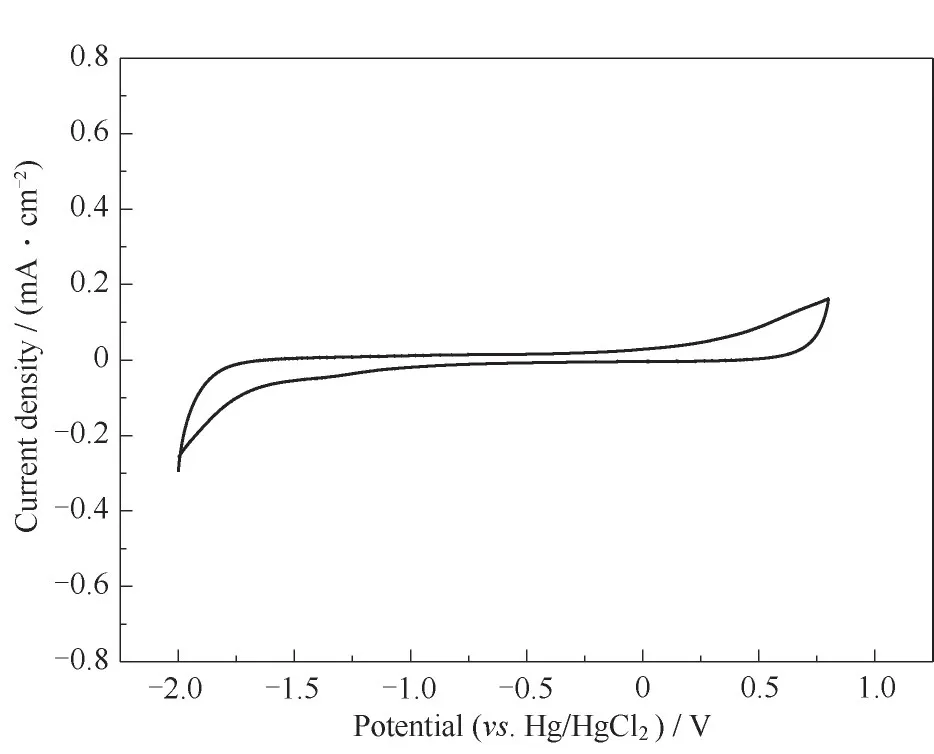
图3 ethaline电解液的CV曲线Fig.3 CV curve of ethaline electrolyte
在含0.1 mol·L-1VCl3的ethaline电解液中以5 mmol·L-1的间隔加入浓度为0~20 mmol·L-1的SbCl3,在-1.2~0.2 V的电压内以多个扫描速率进行测试,CV曲线如图4所示。图中显示出一对明显的氧化还原峰,对应于V(Ⅲ)/V(Ⅱ)这一电对。在约-0.2 V的位置上出现了一个小峰,由于纯的ethaline DES溶液中在此位置并没有出现氧化还原峰,因此判断在-0.2 V的位置的小峰可能是由于原料中的杂质引起的。除此以外,没有产生新的氧化还原峰,进一步证实了Sb3+离子加入后,没有与钒离子发生化学反应而形成新的物质,也就没有改变活性物质的氧化还原反应。为了能直观地看出Sb3+离子对电解液的影响,将其峰值电流密度列于表2。以25 mV·s-1的扫描速率为例,对于原始电解质,其氧化还原峰值电流密度分别为3.583、-3.691 mA·cm-2,当引入了Sb3+离子后,其氧化还原峰值电流密度的值都有所增加,在Sb3+离子为15 mmol·L-1时达到最大值,分别为4.589、-4.764 mA·cm-2。这就表明Sb3+离子的引入可以加快电池的氧化还原反应速率,使得溶液中离子的运动加快,进而增加离子之间的碰撞使其更容易克服活化能而发生电化学反应[25]。
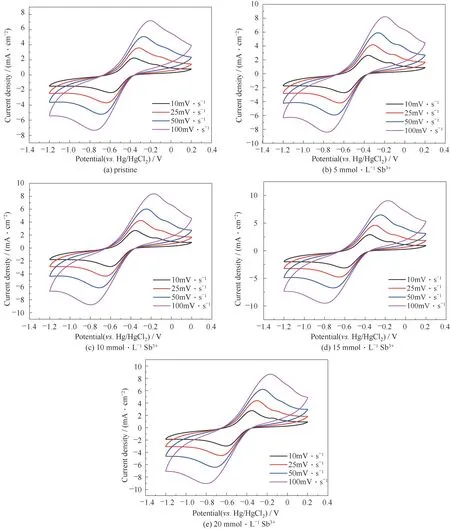
图4 含不同浓度Sb3+离子0.1 mol·L-1 V(Ⅲ)电解质在不同扫描速率下的CV曲线Fig.4 CV curves of 0.1 mol·L-1 V(Ⅲ)electrolyte with different concentrations of Sb3+ions at different scanning rates
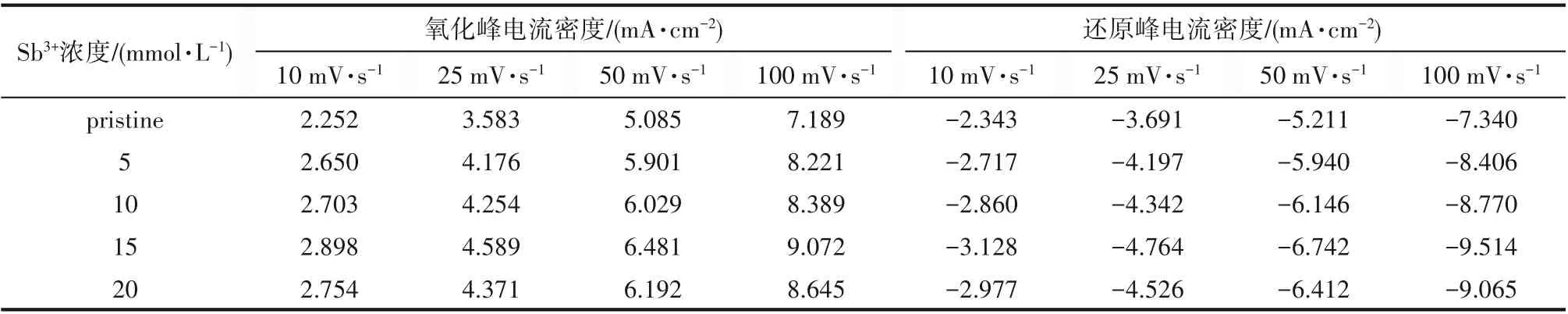
表2 不同扫描速率下的峰电流密度Table 2 Peak current density at different scanning rates
分析曲线可知,不同扫描速率下的所有峰值电位间隔大于59 mV,这表明V(Ⅲ)/V(Ⅱ)氧化还原反应是准可逆的。对于V(Ⅲ)/V(Ⅱ)氧化还原反应的准可逆性质,可以根据Randles-Sevcik方程计算V(Ⅲ)离子的扩散系数[26]。
对于可逆反应,
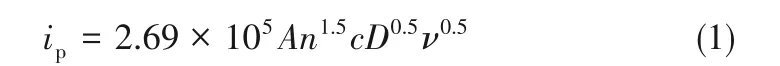
对于不可逆反应,
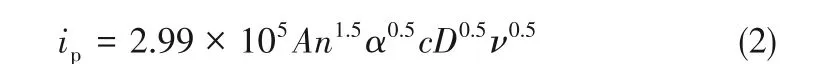
式中,ip是峰值电流,A;n是电极反应中涉及的电子数;α是电荷转移系数;A是电极面积,cm2;c是活性物质的浓度,mol·cm-3;D是扩散系数,cm2·s-1;ν是扫描速率,V·s-1。电荷转移系数α可以通过式(3)求得[18]:
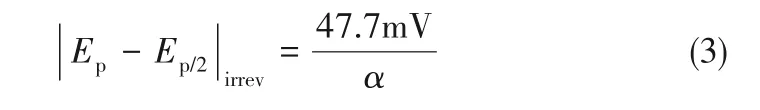
式中,Ep和Ep/2分别代表了峰电流密度的电位及半峰电流密度的电位。
图5为阳极峰值电流密度(ipa)与扫描速率的平方根(v0.5)的关系,可以直观地发现峰值电流密度随扫描速率的增加呈线性增加,这就表明电解质的氧化还原反应处于扩散控制之下。

图5 阳极峰值电流密度与扫描速率平方根之间的关系Fig.5 The relationship between anode peak current density and the square root of scanning rates
根据式(3),电荷转移系数约为0.40。通过式(1)和式(2)估算的V(Ⅲ)离子的扩散系数列于表3。从表中数据可以看出,随着Sb3+离子浓度的增加,V(Ⅲ)离子的扩散系数增大,并在15 mmol·L-1Sb3+离子浓度下达到最大值。由于V(Ⅲ)/V(Ⅱ)氧化还原反应是准可逆的,因此其扩散系数就介于可逆(Dre)和不可逆(Dirre)之间。带有15 mmol·L-1Sb3+离子的V(Ⅲ)离子的扩散系数计算为1.161×10-6~2.472×10-6cm2·s-1,远高于原始电解质(0.7009×10-6~1.362×10-6cm2·s-1)。因此,表明Sb3+可以促进电解液中质量的传递,从而促进氧化还原反应。
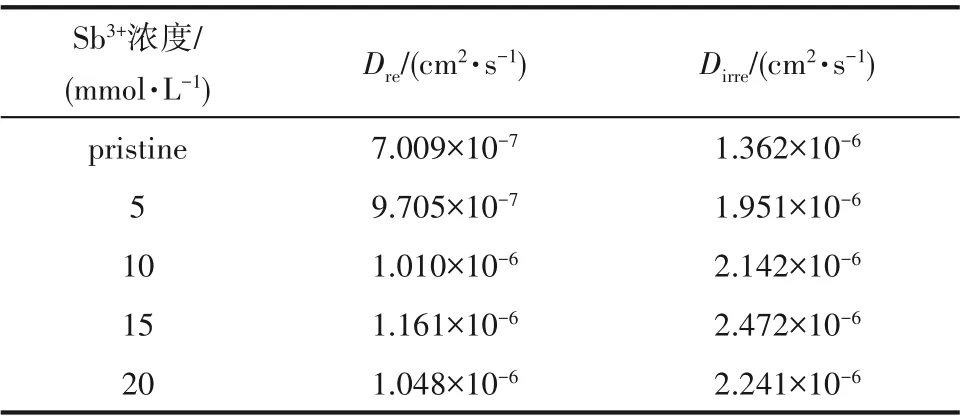
表3 具有不同浓度Sb3+离子的0.1 mol·L-1 V(Ⅲ)离子的扩散系数Table 3 Diffusion coefficients of 0.1 mol·L-1 V(Ⅲ)ions with different concentrations of Sb3+ions
2.3.2 电化学阻抗 应用电化学阻抗进一步分析了引入Sb3+离子对于V(Ⅲ)电解液电化学性能的影响。未加入添加剂及加入不同浓度Sb3+离子的V(Ⅲ)电解液的Nyquist图如图6所示。图中的每一条曲线呈现出相似的规律:高频区域中的单个凹陷半圆形和低频区域中的直线,这表明V(Ⅲ)/V(Ⅱ)的氧化还原反应是通过电化学反应和扩散步骤混合控制的。半圆部分对应于电极-电解质界面处的转移反应,而线性部分与溶液中钒物质的扩散有关[27]。在图6中显示了简化的等效电路,其中Rs反映的是电解质电阻和电极电阻(或称欧姆电阻),Rt代表电荷转移电阻(或称电化学反应电阻),CPE表示电极-电解质界面的双电层电容,Ws是反映由钒离子的扩散过程引起的扩散电容的恒定相元素。

图6 0.1 mol·L-1 V(Ⅲ)电解质在不同浓度Sb3+下的Nyquist图及相应的等效电路Fig.6 Nyquist plot of 0.1 mol·L-1 V(Ⅲ)electrolyte with different concentrationsof Sb3+ions and corresponding equivalent circuit
从图6可以看出,电解液中加入不同浓度的Sb3+离子后,溶液的欧姆电阻Rs和电化学反应电阻Rt都有所减小,并且在Sb3+离子浓度为15 mmol·L-1时达到最小值(图7)。等效电路的部分参数列在表4中,这是通过使用Z-view软件拟合而获得的。从表中的数值能够直观地看出,具有15 mmol·L-1Sb3+离子的电解液的Rs和Rt最小,分别为19.41、8.95Ω,低于原始电解液(22.03、11.57Ω)。减少的电化学反应电阻表示电解质的电荷转移过程加快,反映了较高的电化学反应速度,这应是由于Sb对电极反应的催化作用。此外,对于含有Sb3+离子的电解质,电极-电解质界面的双层电容和离子的扩散电容都高于原始电解质,这意味着引入Sb3+进入电解液可以促进钒离子的吸收和扩散。这些结果进一步证实,通过添加Sb3+离子可以提高V(Ⅲ)/V(Ⅱ)氧化还原反应,这与CV的结果一致。

表4 用等效电路拟合EIS图得到的参数Table 4 The parameters obtained from fitting the EIS plots with the equivalent circuit
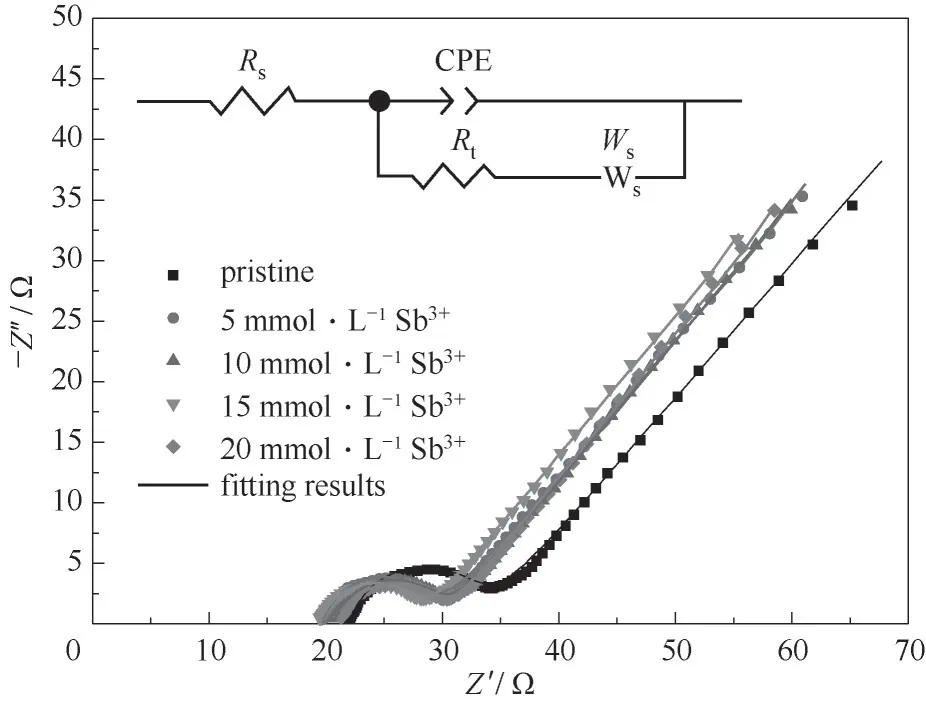
图7 不同浓度Sb3+的影响(Nyquist图)Fig.7 The influence of different concentrations of Sb3+ions(Nyquist plot)
2.4 充放电性能
在ethaline中分别加入0.1 mol·L-1的FeCl2(99.5%,Macklin,无水)和0.1 mol·L-1的VCl3(99%,Ourchem)以制备正负极电解液。在2.0 mA·cm-2的电流密度下,对使用含有不同浓度Sb3+离子电解液的电池进行2 h的恒电流充电和放电。为保证电池起始的状态一样,在开始测试之前将电池充电至相同的SOC(80%),即开路电压为1.097 V。并且所有的测试都使用同一电池,过程中仅更换电解液,而不拆装电池。
表5列出了含有不同浓度Sb3+离子的电解质的电池在运行过程中的内阻及能量效率。图8显示了在Nafion 115膜组装下含有不同浓度Sb3+离子电解质的电池充放电曲线。从图8中可以清楚地看出,没有加入添加剂的电池,其充电电压在1 V左右,加入不同浓度Sb3+离子后,其表现出的充放电性能具有相似的趋势,即与原始样品相比,使用含有Sb3+离子的电解质的电池呈现出更好的电化学性能。具体来说,随着Sb3+离子的加入,电池的充电电压降低,放电电压升高,这表明Sb3+离子的添加可以使得电池的电压损失降低,能量效率得到提升,并且在Sb3+离子浓度为15 mmol·L-1时性能最佳。

表5 在Nafion 115膜组装下含有不同浓度Sb3+离子电解质的电池的内阻及能量效率Table 5 Internal resistance and energy efficiency of batteries with different concentrations of Sb3+ions electrolyte under Nafion 115 membrane assembly

图8 在Nafion 115膜组装下含有不同浓度Sb3+离子电解质的电池充放电曲线Fig.8 The charge-discharge curves of batteries using electrolyte with different concentrations of Sb3+ions under Nafion 115 membrane assembly
为了研究Sb3+离子的添加对于电池功率密度的影响,对使用含有不同浓度Sb3+离子电解液的电池进行了极化曲线的测试。如图9所示,随着Sb3+离子浓度的增加,极限电流密度和最大功率密度都先增大后减小,并且当Sb3+离子浓度达到15 mmol·L-1时,这两者的值最大,分别为16.25 mA·cm-2和4.04 mW·cm-2,高于未加入Sb3+离子时的值(12.75 mA·cm-2和3.08 mW·cm-2)。从这些实验结果可以看出,由于Sb颗粒对V(Ⅲ)/V(Ⅱ)的氧化还原电对的强大的催化剂效应,DES液流电池的电化学性能得到了的改善。
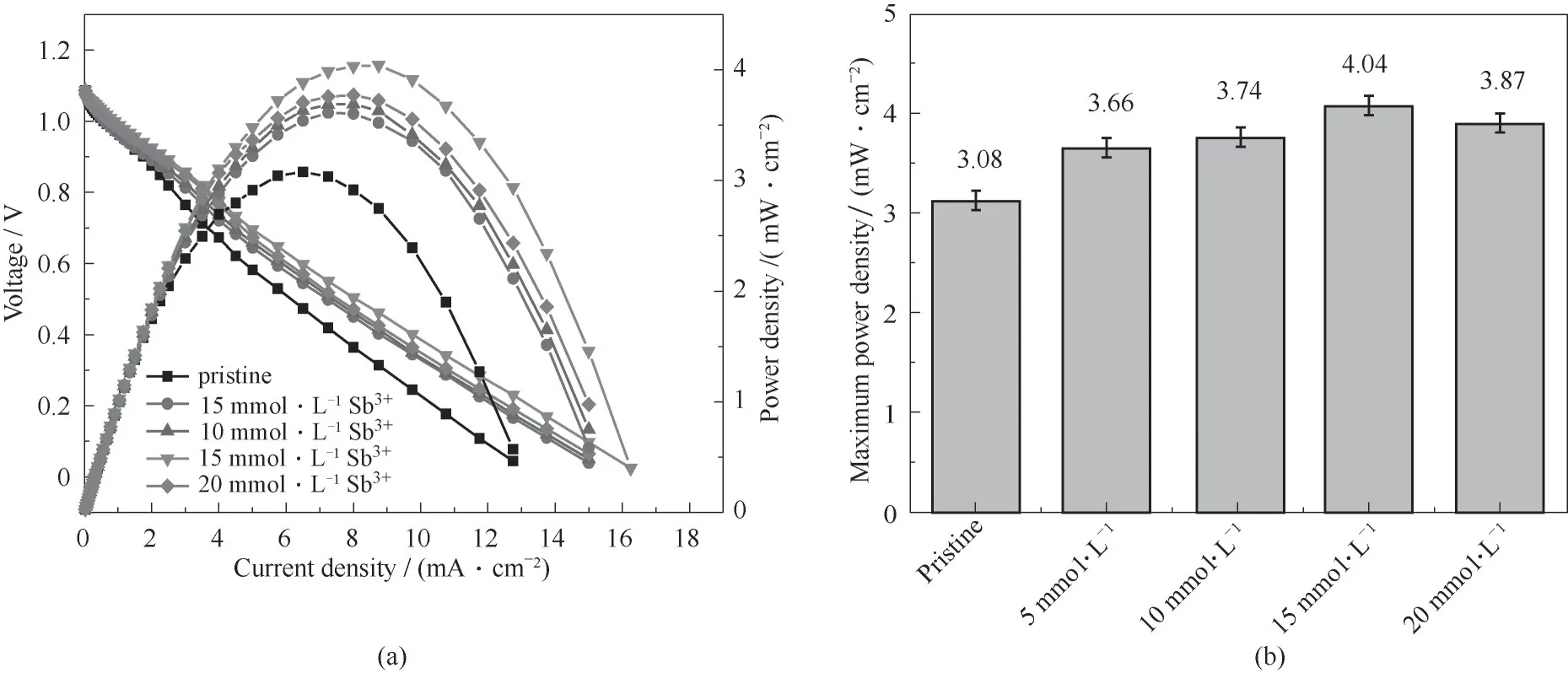
图9 在Nafion 115膜组装下含有不同浓度Sb3+离子电解质的电池的极化曲线(a)和最大功率密度(b)Fig.9 Polarization curves(a)and maximum power densities(b)of batteries with different concentrations of Sb3+ions under Nafion 115 membrane assembly
在同样的工作条件下,对电池进行了三次连续的充放电循环实验,结果见图10。从图中可以看出,随着循环次数的增加,其电压出现了小幅的下降(三次充放电循环后电池的充电电压下降了0.1 V),这就会直接影响电池的能量效率(见表6),使得该值下降。这一现象表明,Fe-V液流电池的循环稳定性不是很好,因此虽然Sb3+离子能够提高Fe-V液流电池的充放电性能,但是其循环稳定性的问题还需进行深入的研究。

图10 使用含有不同浓度Sb3+离子电解质的电池在2 mA·cm-2电流密度下的充放电曲线Fig.10 The charge-discharge curves of batteries usingelectrolyte with different concentrations of Sb3+ions at a current density of 2 mA·cm-2
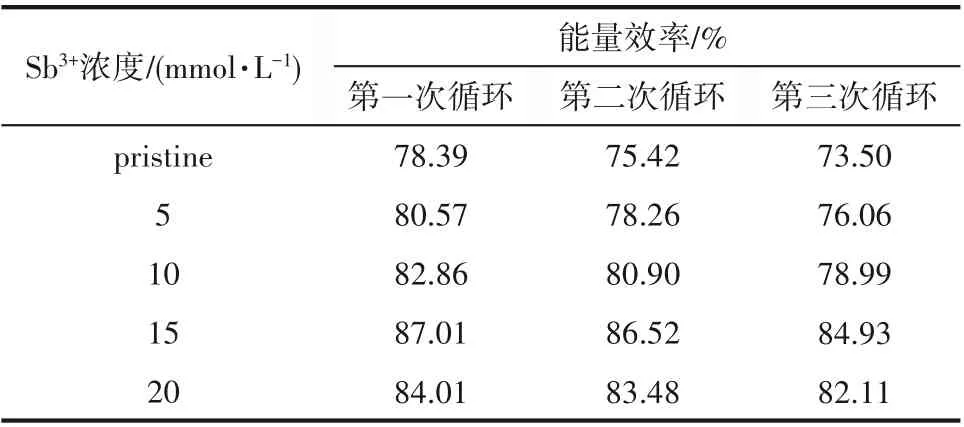
表6 含有不同浓度Sb3+离子电解质的电池在三次充放电循环中的能量效率Table 6 Energy efficiency of batteries with different concentrations of Sb3+ions electrolyte in three chargedischarge cycles
2.5 物理化学测试
为探索Sb离子改善电解质电化学性能的机理,利用场发射扫描电子显微镜,对于使用含有不同浓度Sb3+离子的电解质的电池进行充放电循环后的石墨毡进行表面形貌的表征。
从图11中可以看出,在1μm下Sb3+离子加入后,在石墨毡的表面发现了一些颗粒,并且随着Sb3+离子浓度的增加,石墨毡表面的颗粒增多,在Sb3+离子浓度为20 mmol·L-1时,颗粒聚集较为严重。从SEM图中可以发现,虽然含5~15 mmol·L-1Sb3+的电解质充放电结束后在石墨毡表面会有Sb颗粒的沉积,但是石墨毡的表面形貌并无明显的变化,这是因为Sb颗粒附着在了石墨毡表面上。而含20 mmol·L-1Sb3+的电解质充放电结束后在石墨毡表面形成了Sb颗粒的部分团聚,这是由于Sb3+离子含量增加,表面沉积的Sb颗粒随之增多,这就会导致石墨毡的部分孔隙堵塞,使得离子的传导速率减慢,进而导致电池的性能有所下降。

图11 相同放大倍率下完成充放电循环后石墨毡电极的FESEM图像Fig.11 The FESEMimages of graphite felt electrode at the same magnifications after cycling
为了分析观察到的颗粒的具体组成,用EDX进行鉴定,如图12所示,其横坐标为能量,纵坐标为元素的相对含量。通过EDX可知,当没有加入添加剂时,石墨毡表面只有C、O、V、Cl,而加入添加剂后,检测到的颗粒为Sb(对应于4.0 keV)。此外,随着Sb3+离子浓度的增加,石墨毡表面的Sb含量也逐渐增多。这就表明,电解液的电化学性能得到改善是归因于Sb离子的催化作用。
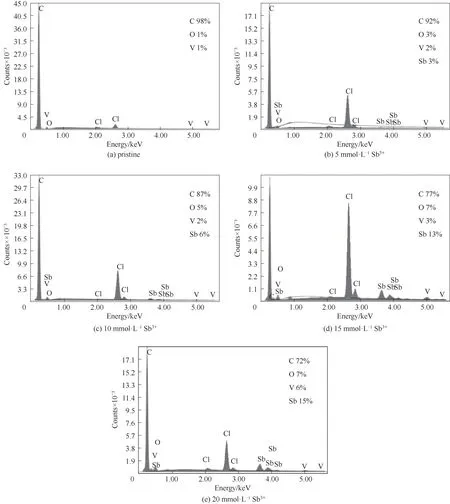
图12 石墨毡表面颗粒EDX谱图Fig.12 EDX spectrogramof particleson the surface of graphite felts
3 结 论
在本项工作中对Sb3+离子作用于DES中V(Ⅲ)/V(Ⅱ)氧化还原电对的物理特性及电化学特性进行了研究,分别测量了在室温下,电解液中加入0~20 mmol·L-1(以5 mmol·L-1为间隔)的SbCl3前后的性能变化。通过黏度和电导率的值可以看出,SbCl3的加入在一定程度上提高了溶液中离子的迁移率。循环伏安曲线显示,SbCl3的加入使得电解质的氧化还原峰值电流密度增加,在25 mV·s-1的扫描速率下,原始电解质的氧化还原峰值电流密度分别为3.583、-3.691 mA·cm-2,当SbCl3浓度达到15 mmol·L-1时,其值分别为4.589、-4.764 mA·cm-2,这表明Sb3+离子的引入可以加快V(Ⅲ)/V(Ⅱ)的氧化还原反应速率。增加的扩散系数表明Sb3+离子可以促进电解液中质量的传递,从而促进钒离子的电化学活性。对电化学阻抗谱进行分析,Sb3+离子加入后溶液的欧姆电阻和电化学反应电阻都有所减小,并且在浓度为15 mmol·L-1时达到最小值,分别为19.41、8.95Ω,表明电荷转移过程加快。以上的实验结果表明,在DES电解液中加入SbCl3,既可以提高电解质的物理特性,又可以改善V(Ⅲ)/V(Ⅱ)氧化还原电对的反应动力学,同时也对传质过程起到积极的作用。
此外,当使用含有Sb3+离子的负极电解液组装电池时,电池的充电电压降低,放电电压升高,使得电池的能量效率从78.39%提升到87.01%。电池的极限电流密度和功率密度也有显著的改善,分别从原来的12.75 mA·cm-2和3.08 mW·cm-2增加到了16.25 mA·cm-2和4.04 mW·cm-2。场发射扫描电子显微镜显示,当使用具有Sb3+离子的电解质的液流电池工作时,Sb离子会电沉积在石墨毡的表面上,对V(Ⅲ)/V(Ⅱ)氧化还原对的电化学反应有催化作用,从而提高电化学性能。由于增强的动力学和降低的活性表面积之间的平衡,确定了Sb3+离子的最佳浓度为15 mmol·L-1。这些结果表明,将非贵金属催化剂Sb3+离子作为添加剂应用于DES液流电池具有良好的前景,能以低成本获得该类电池性能较大的提升。
