白蛋白索拉非尼纳米粒的制备与体外抗肝肿瘤活性评价
2021-06-30高文慧吴锦俊简晓顺贾小婷李靖
高文慧 吴锦俊 简晓顺 贾小婷 李靖
广州医科大学附属肿瘤医院1药学部,4泌尿外科(广州510095);2广州中医药大学国际中医药转化医学研究所(广州510006);3广州医科大学肿瘤研究所(广州510095)
肝癌在我国是第4 位常见恶性肿瘤及第2 位肿瘤致死病因[1],早期手术可延长生存期。但肝癌的早期检出率低,多数患者确诊时已为晚期,需要进行全身治疗。目前,靶向药物治疗已成为肝癌治疗的主要手段之一,但该类药物种类少,疗效不佳,如何提高这些药物的抗肿瘤效果已成为研究肝癌治疗的热点和难点。
索拉非尼(sorafenib,SRF)是多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),是中晚期肝癌患者一线治疗药物,但其无进展生存期仅为167 d,预后不理想。同时,由于索拉非尼不良反应较多,严重时需停药或减量,影响其临床疗效[2-3]。纳米技术为解决上述问题提供了有效策略:纳米药物颗粒小、比表面积大、有肿瘤靶向性[4],能增强疗效、降低毒性和优化体内药物行为[5-6]。MO 等[7]制备的索拉非尼长循环脂质体具有显著的抗乳腺癌细胞活性。ZHANG 等[8]制备脂质包被的索拉非尼纳米晶,可将肿瘤组织中药物浓度提高近15 倍。MARIA 等[9]制备的索拉非尼固体脂质纳米粒同样提高了索拉非尼的抗肝肿瘤活性。因此,索拉非尼纳米制剂的研发已成为肝癌治疗的新方向。
目前报道的索拉非尼纳米制剂仍有生物相容性低、粒径偏大、抗肿瘤活性不高等问题。白蛋白是一种天然的亲水性生物材料,也是最早用于制备抗肿瘤纳米制剂的载体。它对肿瘤具有独特的亲和力:内皮细胞上的gp60 受体和肿瘤细胞外的分泌型富含半胱氨酸的酸性蛋白(SPARC)均能结合、转运白蛋白到达肿瘤部位,增加瘤内药物的蓄积量[10]。因此,采用白蛋白负载索拉非尼(human serum albumin-sorafenib nanoparticles,HSASRF-NPs)有望制备水溶性的纳米制剂,并提高索拉非尼的肝肿瘤靶向性和抗肿瘤活性,为该药的白蛋白纳米剂型在肝癌治疗中的应用提供实验依据。
1 材料与方法
1.1 仪器Malvern-3000HS 激光散射粒度分析和电位测定仪(英国Malvern 公司);H-7650 型透射电镜(日立高新技术上海国际贸易有限公司);5810R低温离心机(德国Eppendorf 公司);LC-20AT 高效液相色谱仪(岛津公司);DMI3000B/DF450C 荧光倒置显微镜(德国Leica 公司);IncuCyte ZOOM 变焦活细胞成像系统(美国ESSEN Bioscience 公司)。
1.2 药品与试剂索拉非尼(中国阿拉丁公司,批号:1528035,含量≥99.9%);人血清白蛋白(美国Sigma 公司,批号:A0307A,含量≥96%);1-乙基-3-[3-二甲基氨基丙基]碳二亚胺盐酸盐(EDC,上海麦克林生化科技有限公司,批号:C10081863,含量:98.5%);PARP(美国CST 公司,货号-抗体类型:9542P-RabbitmAb);β-tubulin(美国BD 公司,货号-抗体类型:556321-MousemAb);PVDF 膜(美国Millipore 公司);超纯水等。
1.3 细胞BEL-7402 细胞(广州医科大学肿瘤研究所赠)。
1.4 方法
1.4.1 制备HSA-SRF-NPs 和FITC-HSA-SRFNPs精密称取10.0 mg 索拉非尼,用二甲亚砜(DMSO)溶解并逐滴加入0.5%人血白蛋白溶液中,搅拌后加入EDC 交联,磷酸盐缓冲液(PBS)透析后4~8 ℃下保存。制备FITC-HSA:将FITC 溶液滴入含人血白蛋白的碳酸钠-碳酸氢钠缓冲液中,避光反应过夜,PBS 透析至外液澄清无颜色。制备FITC-HSA-SRF-NPs:调整FITC-HSA 溶液的浓度为0.5%,同前方法逐滴加入索拉非尼,并用EDC交联,制备FITC 标记的HSA-SRF-NPs。
1.4.2 HSA-SRF-NPs 的表征用激光粒度分布和电位测定仪测定粒径分布和Zeta 电位,透射电镜(transmission electron microscope,TEM)观察形态特征(3%磷钨酸染色,pH 7.0),高效液相色谱法测定载药量和包封率。
1.4.3 细胞复苏与传代37 ℃水浴融化冻存管,离心弃上清,完全培养基分散后继续培养。当瓶底细胞面积达80%~90%时弃去培养基,PBS荡洗,胰酶消化,无菌吸管吹打分散细胞,离心弃上清,用完全培养基分散,取一半重新培养。
1.4.4 FITC-HSA-SRF-NPS 在BEL-7402 细胞内的蓄积6 孔板中放置盖玻片,将BEL-7402 细胞接种于盖玻片上,培养24 h 后分别加入FITC 和FITC-HSA-SRF-NPS,培养12 h 后PBS 清洗,室温下固定,DAPI 染色。将盖玻片放在载玻片上,在荧光显微镜下观察(20×)。
1.4.5 IncuCyte ZOOM实时动态细胞成像将BEL-7402 细胞接种于96 孔板培养24 h,弃去上清,分别加入1.5、3、6 μmol/L 索拉非尼和HSA-SRF-NPS,每组3 个复孔,置于IncuCyte ZOOM 系统内,根据设定好的程序(每孔采集3 张不同视野的图像,采集间隔4 h,10×镜头)收集6 d 的数据,用系统自动分析图像中细胞的区域,计算细胞融合率。
1.4.6 细胞凋亡实验将BEL-7402 细胞接种于6孔板培养24 h,不加药或分别加入12.0 μmol/L 索拉非尼和HSA-SRF-NPs,每组3 个复孔,继续培养24 h。消化细胞,1×PBS洗涤,室温离心收集细胞,重复洗涤3 次;加入预冷的1×binding buffer 重悬细胞,分别加入5 μL 的Annexin V-FITC 和PI 染色,室温避光孵育,混匀上机,采用flowjo7.6 软件进行凋亡分析,计算细胞凋亡百分比。
1.4.7 Western blot法检测凋亡相关蛋白Cl-PARP的表达BEL-7402 细胞培养24 h,不加药或分别加入13.5 μmol/L 的索拉非尼和HSA-SRF-NPs,每组3 个复孔,继续培养24 h 后弃去培养基,裂解、收集细胞,低温离心并取上清液,-80 ℃保存。取40 μg 样品上样,60 V 恒压电泳后,恒流200 mA 转膜90 min,室温下5%脱脂奶粉封闭2 h。一抗PARP(1∶1 000)和β-tubulin(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)继续室温孵育2 h,化学发光并于暗室中显影、定影,检测目标条带。
1.5 统计学方法数据经SPSS 软件分析,计量资料以均数±标准差表示,采用独立样本t检验或单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 HSA-SRF-NPs的表征HSA-SRF-NPs的水合粒径为(75.8±2.6)nm(图1A),多分散系数(polydispersity index,PDI)为0.129;Zeta 电位为-(19.00 ±1.02)mV(图1B),绝对值较高,稳定性较好(图1)。由图1 C 的TEM 图可知,HSA-SRF-NPs 呈球形,大小在100 nm 左右。最终测得HSA-SRF-NPs 的载药量和包封率分别为(4.23 ± 0.03)%和(92.52 ±2.40)%。
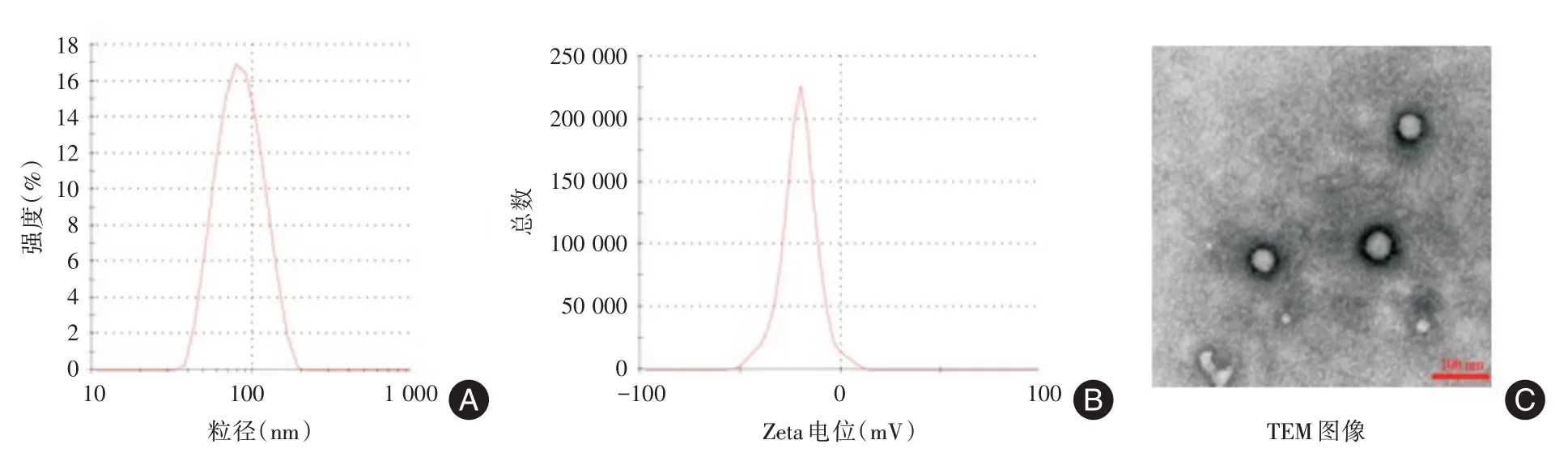
图1 HSA-SRF-NPs 的表征Fig.1 Characterization of HSA-SRF-NPs
2.2 FITC-HSA-SRF-NPS 在BEL-7402 细胞内的蓄积见图2,活细胞不会主动吞噬FITC,因此对照组和FITC 组BEL-7402 细胞中均无绿色荧光;FITC-HSA-SRF-NPS 组BEL-7402 细胞内出现绿色荧光,可能是其通过内吞作用将纳米粒转运入细胞,从而提高胞内索拉非尼的含量。

图2 荧光显微镜观察FITC 和FITC-HSA-SRF-NPS 在BEL-7402 细胞内的蓄积情况(20×)Fig.2 Observation of accumulation of FITC and FITC-HSA-SRF-NPS in BEL-7402 cells by fluorescence microscope(20×)
2.3 动态细胞增殖试验未用药物处理的BEL-7402 细胞从2 d 开始逐渐进入对数生长期,6 d 后细胞融合率接近100 %;索拉非尼处理后,各浓度组均显示出对BEL-7402 细胞的增殖抑制作用(图3A),同样的变化在HSA-SRF-NPs 组也能观察到(图3B)。实验结束后比较索拉非尼和HSA-SRFNPs 处理BEL-7402 细胞的融合率,发现HSA-SRFNPs 在各浓度组对BEL-7402 细胞的增殖抑制作用均显著强于索拉非尼(图3C)。随着药物处理时间延长,HSA-SRF-NPs 对BEL-7402 细胞形态结构的破坏比索拉非尼更加明显(图4)。

图4 各样品处理后BEL-7402 细胞的形态学变化Fig.4 Morphological changes in BEL7402 cells after treatment with each sample
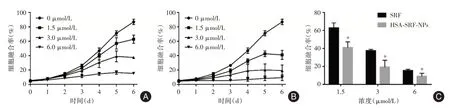
图3 IncuCyte ZOOM 动态细胞增殖试验Fig.3 The dynamic cell proliferation test by IncuCyte ZOOM
2.4 细胞凋亡实验凋亡结果见图5。对照组仅有5 %的BEL-7402 细胞发生凋亡,而索拉非尼组和HSA-SRF-NPs 组分别为14.5 %和23.2 %(包括早期凋亡和晚期凋亡细胞),三组之间凋亡细胞百分比差异有统计学意义(P<0.001)。

图5 索拉非尼和HSA-SRF-NPs 对BEL-7402 细胞的促凋亡作用及三组细胞凋亡Fig.5 Comparison of the effects of sorafenib and HSA-SRFNPs on apoptosis of BEL-7402 cells and a column chart of apoptosis percentage in three groups
2.5 Western blot法检测凋亡相关蛋白Cl-PARP的表达PARP的分子量为116 KDa,剪切后的Cl-PARP分子量为89 KDa,凋亡过程发生时,PARP被剪切成Cl-PARP,推进凋亡过程。三组PARP条带下均有Cl-PARP条带。Image J软件测量图中Cl-PARP的灰度值,并与β-tubulin 蛋白相比,计算相对蛋白表达量。经统计分析发现,Cl-PARP 在各组间的表达差异有统计学意义(P<0.05),表达量由高到低依次为:HSA-SRF-NPs组>索拉非尼组>对照组。见图6。

图6 Western blotting条带图及Cl-PARP相对表达量柱状图Fig.6 Strip image of Western blotting and histogram of relative expression of Cl-PARP
3 讨论
本研究采用化学交联法成功制备出人血白蛋白-索拉非尼纳米粒,测得HSA-SRF-NPs 的粒径为(75.8±2.6)nm,Zeta 电位为-(19.00±1.02)mV,载药量和包封率分别为(4.23 ± 0.03)%和(92.52 ±2.40)%。研究表明,粒径大小影响纳米药物的分布。当粒径在30~200 nm 时,高通透性和滞留(enhance the permeability and retention,EPR)效应增强[11],药物在肿瘤部位的蓄积量增加。SUN等[12]的研究表明,粒径为100 nm 的牛血清白蛋白-阿霉素纳米粒比250 nm 的该纳米粒更容易在乳腺癌细胞中蓄积,有研究也证实,肿瘤细胞更有可能摄取较小的纳米颗粒。因此,将粒径控制在30~100 nm 有利于提高纳米粒的肿瘤靶向性。现有研究中索拉非尼纳米粒的粒径多在200 nm 左右[8,13],包封率并不理想[14]。本研究通过改良工艺,制备出粒径在100 nm 以内、包封率高、稳定性好的索拉非尼纳米粒,能保证其良好的抗肿瘤活性。
细胞水平研究发现,HSA-SRF-NPs在BEL-7402细胞内的蓄积性、对BEL-7402 细胞的增殖抑制作用以及促凋亡能力均显著优于索拉非尼。WAN等[14]制备的拉帕替尼人血清白蛋白纳米粒克服了药物水溶性差和口服吸收受限等问题,但制备的纳米粒并未提高药物对乳腺癌细胞的细胞毒性和促凋亡能力。RETNAKUMARI 等[15]制备的转铁蛋白-人血白蛋白-索拉非尼纳米粒显示出抗慢性髓系白血病的功效,但并未评价其对肝肿瘤细胞的作用。本研究制备的HSA-SRF-NPs 对肝肿瘤细胞的毒性显著增强,证明白蛋白为载体具有明显优势,为其在肝癌治疗中的应用提供理论依据,具有潜在的临床研究价值。然而,HSA-SRF-NPs 的抗肿瘤活性仍可进一步提高:HSA-SRF-NPs 粒径小,白蛋白表面又具有很多活性基团,因此可以继续在其表面嫁接肿瘤靶向的配体,如叶酸、抗体和适体等[16]或共包载其他抗肿瘤药物,以提高纳米粒的抗肝肿瘤活性。未来还需要继续改进该纳米制剂,同时在整体动物水平评价其抗肿瘤活性,为其向临床转化打下理论基础。
