三株降解阿特拉津菌株的特性与固定载体分析
2021-06-30刘丹丹孙宛玉
刘丹丹,孙宛玉,王 鹤
(沈阳化工大学 环境与安全工程学院,辽宁 沈阳 110142)
随着农业现代化进程加速,人们对农产品的需求增大,农药成为农业生产中的必需品[1]。其中除草剂的大量使用会对环境以及人类健康产生巨大的负面影响。三嗪类化合物阿特拉津是世界范围内使用最广泛的除草剂之一[2-3],它通过抑制植物的光合作用持久防除一年生禾本科杂草和阔叶杂草,常用于甘蔗田、茶园、林地和果园等地[4-5]。阿特拉津具有半衰期长、迁移率高、吸附系数低的特点。它会随雨水浮沉和地表挥发迁移到周边环境中造成附近土壤及水体污染。长期施用阿特拉津会导致农药残留严重危害环境安全和生物的健康[6-7],因此缓解阿特拉津污染问题迫在眉睫。
目前,利用生物修复技术治理土壤污染是国内外公认的最有效方法[8]。生物修复技术与物理、化学处理方法相比,修复过程会更安全、不易产生二次污染,更适合用于大面积土壤污染的治理[9-10]。研究表明,在实际环境中微生物极易受土壤性质(PH、盐度等)和环境条件(温度、光照等)的影响,造成微生物修复土壤效果不理想[11]。但通过固定化微生物技术可以有效弥补其在自然环境中的不足[12-13],常用的固定化材料有粘土、活性炭、多孔玻璃、海藻酸钠、明胶和聚乙烯醇等[14],其中海藻酸钠凭借无毒无污染、操作简单、价格低廉、传质性能好等优点被广泛使用[15]。
本研究从长期受阿特拉津污染的土壤中筛选出3株高效降解阿特拉津的菌株。经过生态学观察、生理生化分析及16S rDNA鉴定确定菌株种属,并通过气相色谱和分光光度法揭示菌体生长和降解效果的关系。比较海藻酸钠、聚乙烯醇、明胶和生物炭4种材料包埋菌株后的物理性质及对阿特拉津的降解效果,选出最佳包埋载体。以期为生物修复阿特拉津环境污染提供理论基础。
1 材料与方法
1.1 试剂与培养基
无机盐培养液:磷酸氢二钾0.8 g,磷酸二氢钾0.2 g,硫酸镁0.1 g,氯化钠0.05 g,葡萄糖1.5 g,阿特拉津0.05 g,蒸馏水定容至500 mL,PH调至中性,121℃高压灭菌30 min[8]。
LB培养基:胰蛋白胨5.0 g,氯化钠5.0 g,酵母浸粉2.5 g,琼脂粉10 g,蒸馏水定容至500 mL,pH调至中性,121℃高压灭菌30 min[8]。以上所有试剂均为分析纯。
阿特拉津(纯度约99.9%,购自Sigma公司),丙酮,二氯甲烷(均为色谱级)。
阿特拉津标准液:称量0.1 g阿特拉津溶解在1 000 mL丙酮中,制备100 mol·L-1阿特拉津标准溶液。
菌悬液制备:将3株菌在液体培养基中培养24 h,8 000 r·min-1离心5 min,弃去上清液,无菌水冲洗菌体,生理盐水重悬,30 ℃下150 r·min-1继续培养6 h,用无菌水调节菌悬液D600为1.0备用。
1.2 供试菌株分离、纯化和培养
从长期施用阿特拉津的污染土壤中筛选出3株菌株,在含阿特拉津50 mol·L-1的无机盐液体培养基中培养,通过不断增加培养液中阿特拉津浓度提升菌株降解能力,直至阿特拉津浓度为100 mol·L-1,对驯化后菌株分离纯化。菌株现存放于沈阳化工大学环境工程实验室。
1.3 降解菌株形态学与生理生化鉴定
降解菌株于LB培养基培养,观察LB培养基及扫描电镜中菌株的形态,菌株扫描电镜前处理方法参照尤嘉懿[16]。生理生化特征鉴定实验方法参照《伯杰氏细菌鉴定手册》[17]。
1.4 降解菌株16S rDNA鉴定与系统发育树构建
细菌总DNA提取采用CTAB法[18]。16S rDNA鉴定采用Takara试剂盒,反应体系为50 μL,包括引物(5′-GAGCGGATAACAATTTCACACAGG-3′,5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)1 μL,DNA模板1 μL,PCR混合液25 μL,双蒸水23 μL。PCR反应条件为94 ℃,预变性5 min,30个循环(94 ℃变性1 min,58℃退火1 min,72 ℃延伸1.5 min),72 ℃延伸5 min,4 ℃稳定4 min。产物用OMEGA D2500-02(购自索莱宝科技公司)试剂盒回收,送至金唯智生物科技有限公司测序。测序所得序列经Blast比对后,选出相似菌株序列,用MEGE7.0软件进行系统发育分析,采用邻接法(Neighbor-Joining)构建系统发育树[19]。
1.5 阿特拉津降解率测定
分别取10 mL菌悬液(1×108CFU·mL-1),加入100 mol·L-1阿特拉津培养液中,避光培养5、8、11、14、17、20 d后,通过气相色谱测定阿特拉津的降解率[20]。
1.5.1 样品前处理
取不同时间的菌株培养液100 mL,抽滤后,加入氯化钠5.0 g,二氯甲烷15 mL,萃取20 min,取下层有机相,旋转蒸发仪45 ℃浓缩后,丙酮定容至1 mL[21],用气相色谱测定。
未添加菌株的阿特拉津无机盐培养液为空白对照组,处理方法同上。
1.5.2 气相色谱检测条件
气相色谱仪:天美气相色谱仪GC7900,氢火焰离子化检测器(FID)。色谱柱:天美TM-5石英毛细管柱(30 m×0.25 mm×0.25 μm,内涂5%苯基甲基聚硅氧烷,膜厚0.25 μm),1 μL微量进样器。
进样口温度为240 ℃,采用分流进样,分流比10∶1。柱箱升温程序:初始温度40 ℃,保持30 min;以30 ℃·min-1升至190 ℃,保持5 min;以30 ℃·min-1升至250 ℃,保持5 min。以N2为载气,流量1.0 mL·min-1。检测器温度300 ℃,进样体积1.0 μL[21]。
1.5.3 阿特拉津降解率计算
菌株降解率的计算参照葛世杰等[22]计算公式如下:
(1)
式(1)中:X为阿特拉津降解率(%);CX为阿特拉津的最终浓度(mol·L-1);CCK为阿特拉津的原始浓度(mol·L-1)。
1.6 菌体生长情况测定
采用分光光度法[23]测定5、8、11、14、17、20 d培养液在600 nm波长下的D值(D600),了解菌体的生长状态。
1.7 固定化菌株制备
海藻酸钠包埋:取10 mL菌悬液与10 mL浓度为5%海藻酸钠溶液混匀,用注射器将混合液缓慢滴入100 mL浓度为4%的氯化钙溶液中,室温交联4 h,取出小球,用无菌水冲洗3次,4℃冷藏备用[24]。
聚乙烯醇包埋:取10 mL菌悬液与10 mL浓度为10%聚乙烯醇溶液混匀,用注射器将混合液缓慢滴入100 mL浓度为5%的硼酸溶液中,室温交联4 h,取出小球,处理同上[25]。
明胶包埋:将10 mL菌悬液与10 mL浓度为10%明胶溶液混匀,倒入培养皿中凝固后,加入10 mL 0.5%戊二醛溶液,室温交联4 h切成小块,处理同上[26]。
生物炭固定:称取1 g生物炭,倒入10 mL菌悬液摇匀,室温交联4 h,处理同上。
1.8 包埋菌株物理性能和降解效果测定
分别从不同的固定方式中选取大小均匀的固定化菌体备用。
机械强度测定:将100粒固定化菌体放入含有200 mL蒸馏水的锥形瓶中,以200 r·min-1震荡24 h,统计未破损颗粒占总颗粒的比例。
传质性能测定:将100粒固定化菌体浸没于红墨水中2 h,将其置于无菌水中24 h,观察其染色、褪色情况,判断传质性能的优劣[27]。
成形性测定:观察固定24 h的菌株成球难易、黏连情况和拖尾现象[24]。
阿特拉津降解率:选取等量大小均匀的固定化菌体投入到100 mol·L-1含阿特拉津的液体培养基中,同时以未固定的游离菌株为对照。培养14 d通过气相色谱测定其降解率,处理方法同1.5节。
2 结果与分析
2.1 降解菌株形态学及生理生化鉴定
对平板及扫描电镜中菌株形态进行观察,8号为圆形淡黄色短杆菌,表面光滑且不透明,菌落边缘规则;9号为圆形乳白色短杆菌,表面粗糙且不透明,菌落边缘不规则;10号为圆形淡黄色长杆菌、表面光滑且不透明,菌落边缘不规则有透明圈。菌株在LB培养基及扫描电镜下形态见图1和图2。

图中A~C分别为8、9、10号菌株,图片为菌株×20 000倍下的电镜图片。A-C reprent No. 8-10 respectively. The picture shows the strain ×20 000.图2 三菌株扫描电镜下形态(×20 000)Fig.2 Morphology of 3 strains under scanning electron microscope (×20 000)
经生理生化分析可知,3种菌株均为革兰氏阳性菌株,且对葡萄糖、蔗糖和乳糖作用一致,除9号菌株在柠檬酸盐利用实验中呈阳性外,其余实验结果3菌株均相同,具体结果见表1。
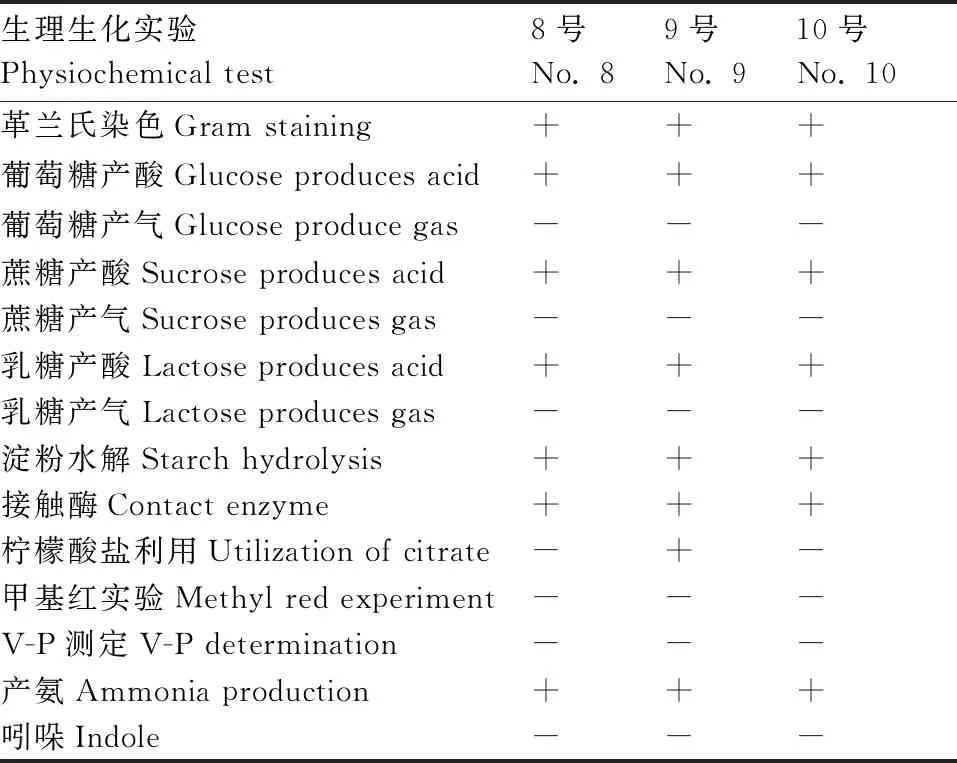
表1 三株降解菌生理生化鉴定结果
通过观察分析,发现3株降解菌与Shinella、Herbaspirillum和Pseudomonas菌属的形态和生理生化特性一致。
2.2 降解菌株菌属鉴定
经16S rDNA鉴定可知,8、9、10号菌株16S rDNA序列长度分别为1 225、1 223和1 227 bp。通过Genbank数据库进行Blast比对,结果表明,8、9、10号降解菌株分别与Shinella菌属、Herbaspirillum菌属和Pseudomonas菌属最为相似,相似度分别达97%、97%和96%,选取相似菌株绘制进化树,可看出8、9、10号菌株分别与申氏菌属、草螺菌属和假单胞菌属聚为一枝(图3)。
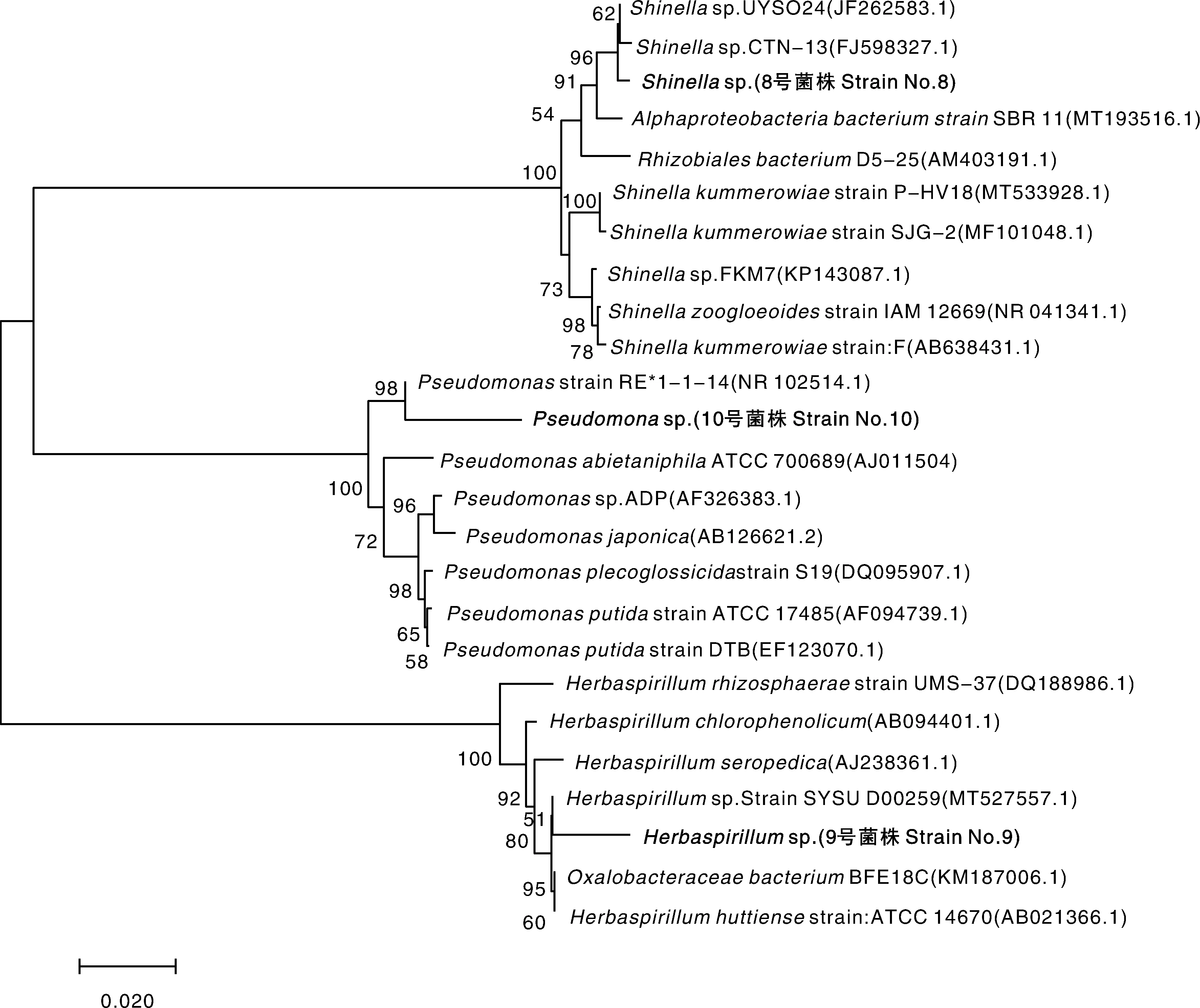
括号内为菌株的登录号。The accession number of the strain is shown in brackets.图3 三菌株16S rDNA系统发育树Fig.3 Phylogenetic tree based on 16S rDNA
2.3 菌株降解效果及生长情况
经气相色谱测定3株菌分别在2.796、2.821、2.831 min有明显的吸收峰(图6)。通过公式计算降解率,并进一步比较不同培养时间的降解效果,菌株8、9、10号均在14 d降解率最高,分别为88.1%、87.2%和89.9%。
采用分光光度法测定5 、8 、11 、14 、17 、20 d后不同培养液的D600,结果表明,在5~20 d 期间D600逐渐增加,14 d时D600均达到1.0左右。
菌株对阿特拉津的降解率与生长情况见图4和图5。
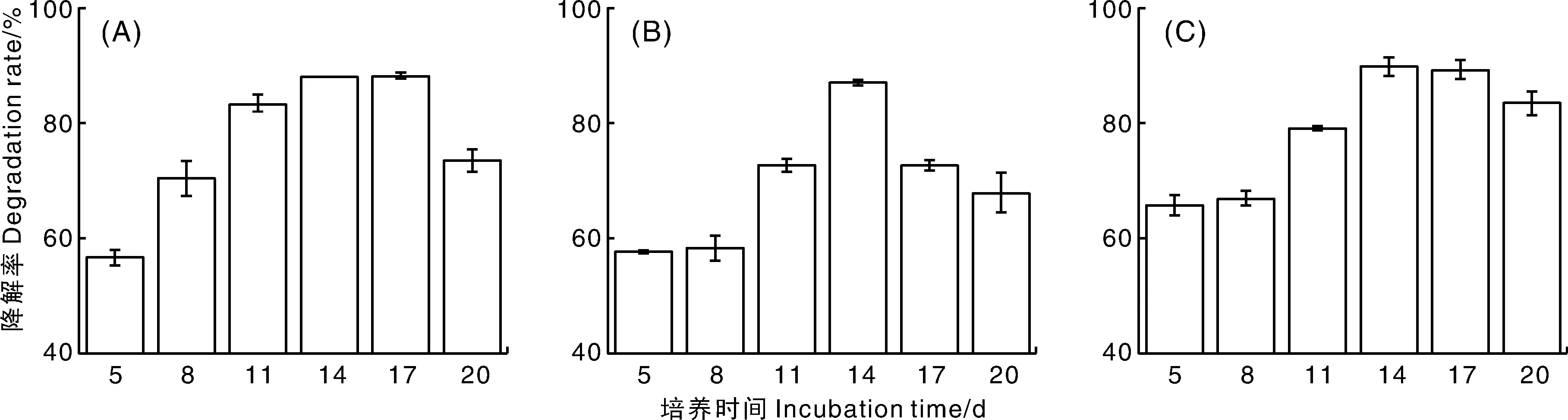
图中A~C分别为8、9、10号菌株在5~20 d对阿特拉津的降解率。In the figure,A-C are the degradation rates of atrazine by strain No. 8-10 on 5 days to 20 days,respectively.图4 三菌株对阿特拉津的降解情况Fig.4 Degradation of atrazine by 3 strains
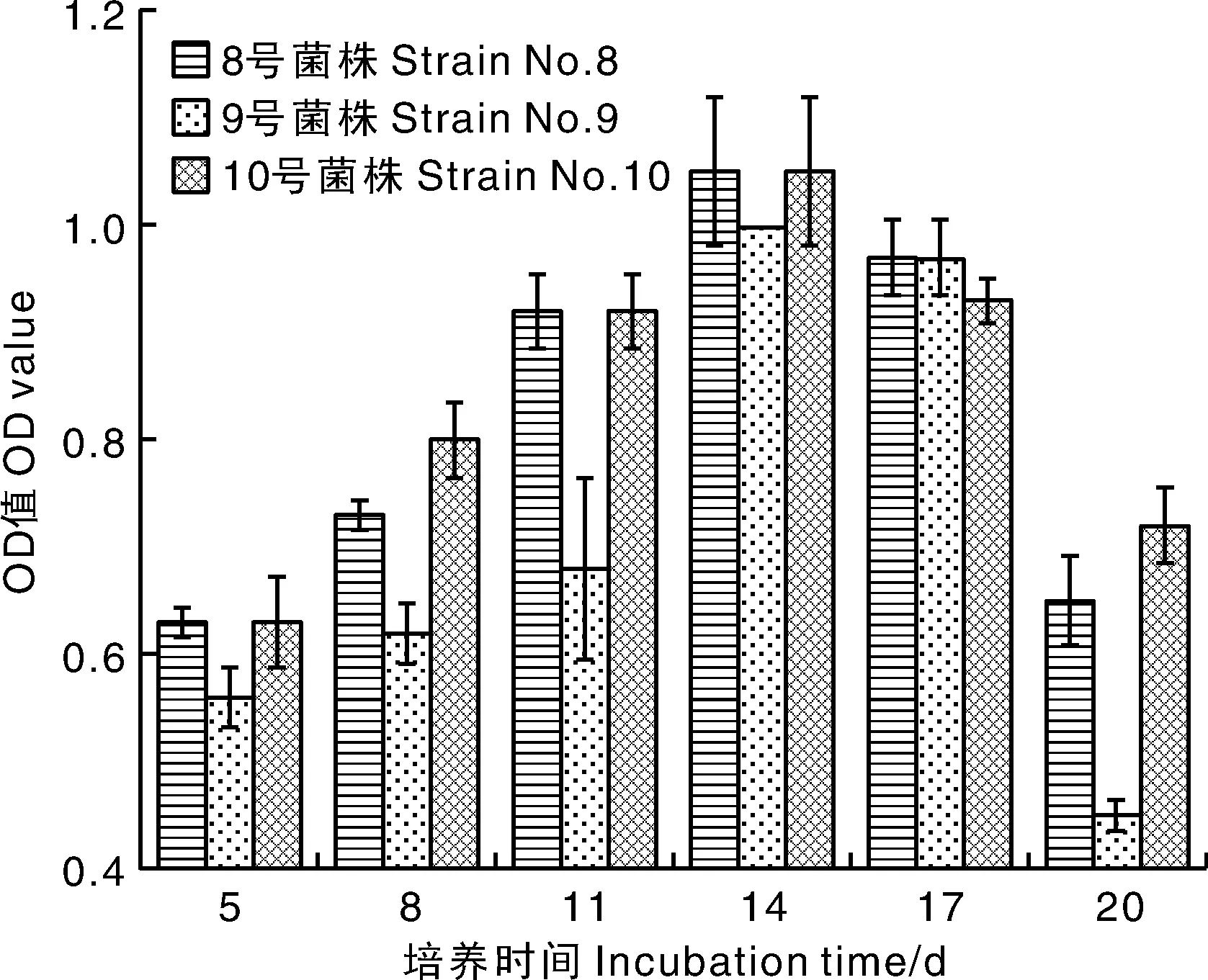
图5 三菌株在5~20 d生长情况Fig.5 The growth of the 3 strains from 5 days to 20 days
2.4 包埋菌体物理性能和降解效果
通过计算未破损颗粒占总颗粒的比例、观察包埋菌体的染色褪色、成形性情况得知不同载体包埋3株菌的物理性能见表2。经计算,8、9、10号菌株由海藻酸钠包埋的降解率分别为85.4%、82.6%和86.4%,由聚乙烯醇包埋的降解率分别为41.4%、45.4%和44.4%,由明胶包埋的降解率分别为65.4%、57.4%和66.5%,由生物炭包埋菌株的降解率分别为55.2%、56.8%和55.4%,游离菌株降解率分别为88.0%、86.1%、88.0%见图8。结果表明海藻酸钠包埋菌株成形性、机械强度较好、褪色速率快、传质能力最佳、而且对菌株降解效果影响最小。聚乙烯醇的机械强度较好但传质能力和成形性极差,对阿特拉津的降解率最低。明胶的机械强度差,生物炭的成形性、机械强度最好,但二者的传质能力一般且对阿特拉津的降解效果一般。综合比较4种包埋载体,最终选定海藻酸钠为最佳载体,4种固定后菌株形态见图7。
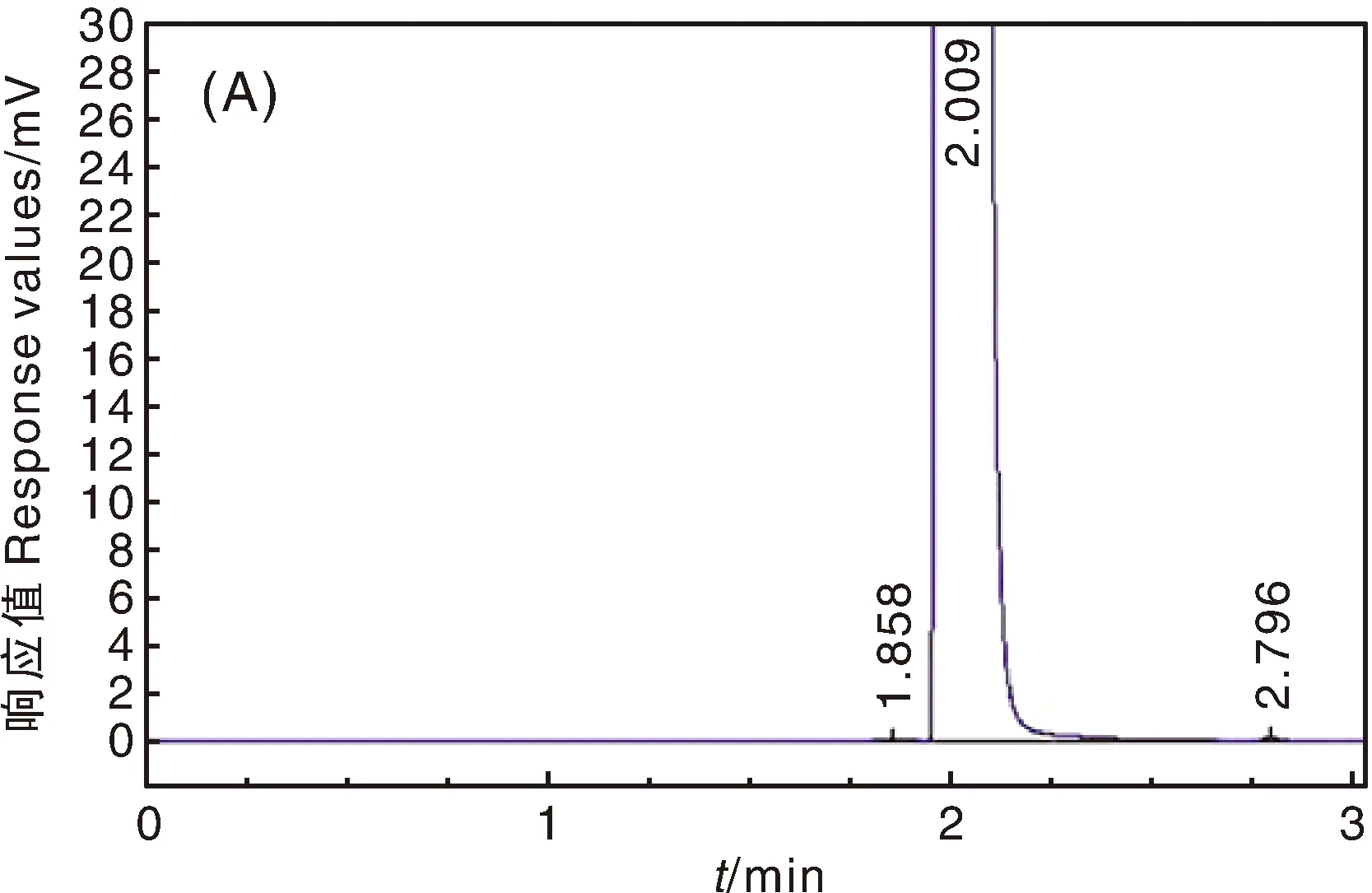
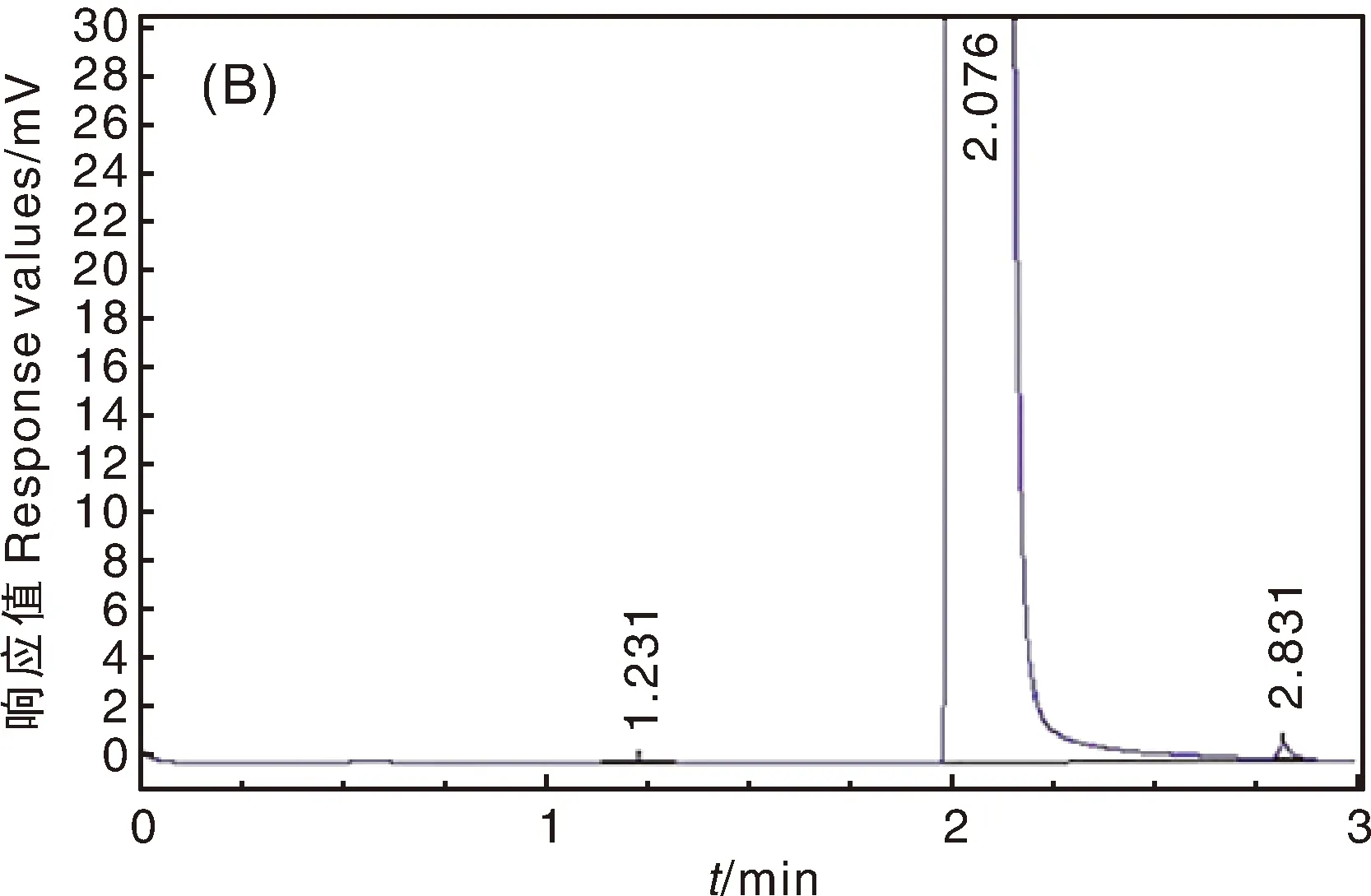
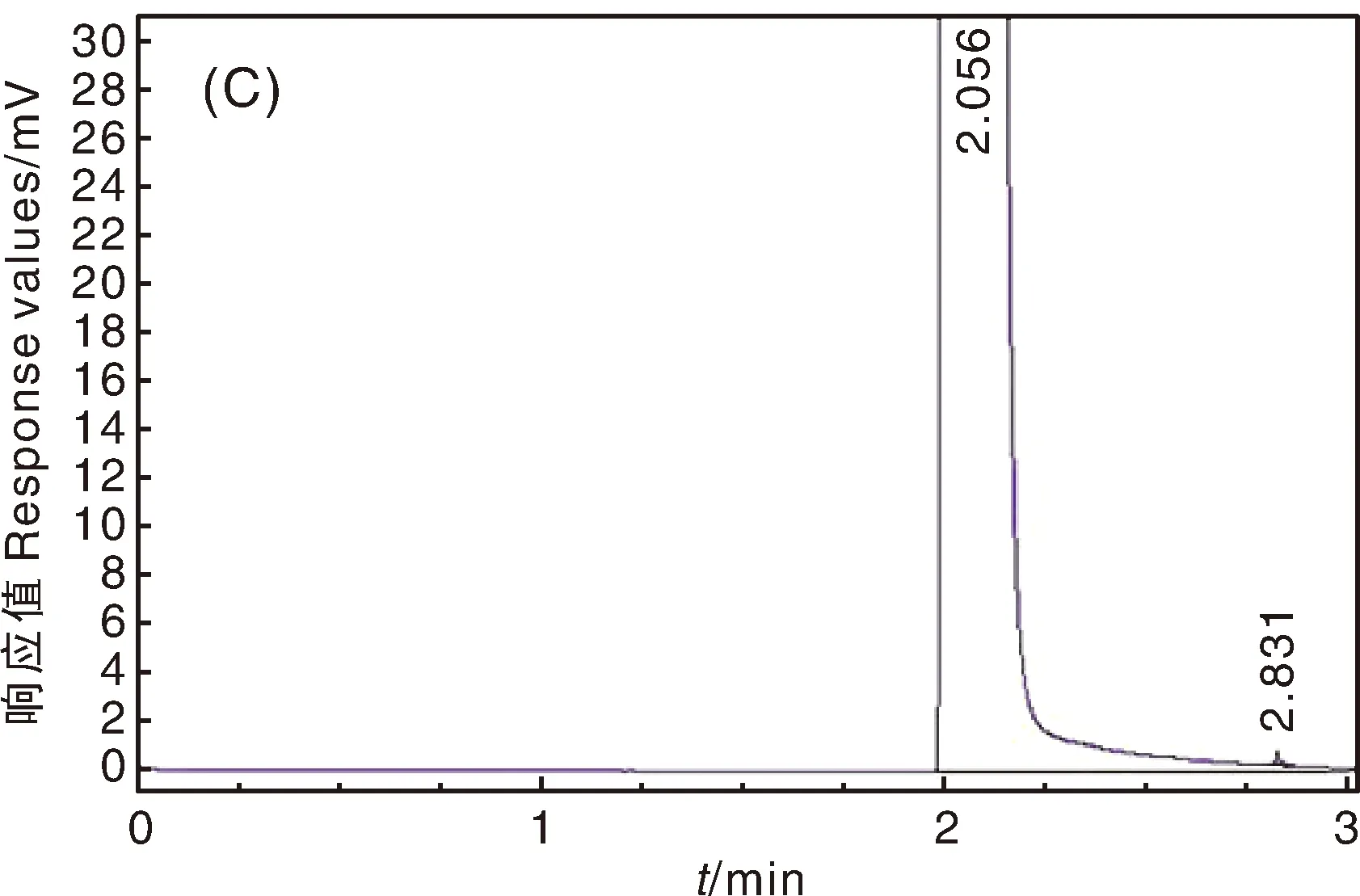
图中A~C分别为第8-10号菌株对阿特拉津降解气相色谱图。In the figure,A-C are gas chromatography of atrazine degradation by strain No. 8-10.图6 8-10号菌株对阿特拉津降解气相色谱图Fig.6 Gas chromatography of atrazine degradation by strain No. 8-10

A,海藻酸钠;B,聚乙烯醇;C,明胶;D,生物炭。A,Sodium alginate; B,Polyvinyl alcohol; C,Gelatin; D,Biochar.图7 四种固定化菌株形态Fig.7 Forms of four immobilized bacterial strain agents
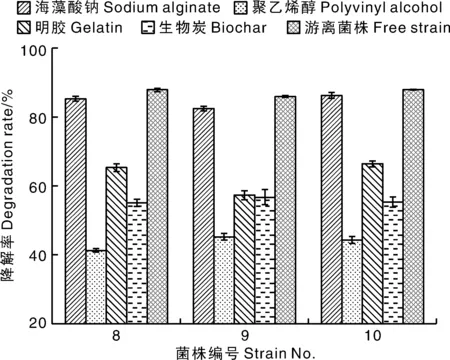
图8 四种载体固定化3菌株14 d对阿特拉津降解率Fig.8 Atrazine degradation rate of 3 strains immobilized on 4 carriers for 14 days

表2 不同载体包埋菌体后物理性能测定结果
3 结论与讨论
此前,报道过具有降解阿特拉津的功能菌属有:Micrococcusluteus、Exiguobacteriumsp、Rhodococcus和Pseudomonas等[28-30],但关于Shinella和Herbaspirillum菌属降解阿特拉津的相关研究鲜有报道。徐艳婷等[31]、刘冰冰[32]发现,Shinella菌属可以高效降解氨氮、具有絮凝铜绿微囊藻且能降解土壤中三价砷和乙草胺类除草剂;刘伟林等[33]发现,Herbaspirillum菌属有固氮的作用,可以促进植物的生长。Herbaspirillum菌属还具有良好的好氧反硝化性能,多用于废水脱氮处理[34]。本研究以寻求高效降解阿特拉津菌株和最佳包埋载体为目的,从长期受阿特拉津污染的土壤中筛选出3株菌,经过对菌株的形态观察、生理生化特性分析、16S rDNA测序比对及系统发育树的构建,确定8、9、10号菌株属Shinella、Herbaspirillum和Pseudomonas。又通过气相色谱测定3菌株降解率,经计算可知在14 d后菌株降解率最高均达到85%以上,证明了3菌株对阿特拉津起降解作用。同时依据分光光度法测定的D600推测菌株生长情况,结果表明,5~11 dD600不断增加,则是菌量在逐渐增长。14 d的菌量达到最大、菌株生长代谢最旺盛,D600达到1.0左右。结合阿特拉津降解率和菌株生长情况表明,菌株降解效果与菌量呈正相关,即随着菌量的增加,菌株的降解率也不断提高,当D600达到1.0左右时降解率最高。有关于8、9、10号菌株是否具有降解其他农药的作用还有待进一步验证。
近些年,利用包埋菌株修复阿特拉津污染的技术备受欢迎。宋昊等[35]已证实包埋法固定菌株可以提高菌株对恶劣环境的耐受能力从而达到保护菌株的目的。本实验选取了4种载体,综合比较不同的载体包埋情况。结果表明,海藻酸钠固定菌体的成球性好、破损率低、传质能力较强且对菌株降解阿特拉津的影响小。同时在实际应用中,海藻酸钠的成本低且易获取,其包埋技术操作简单、修复效果好,这与杨晓燕等[24]研究结果一致,因此我们认为海藻酸钠是最佳包埋载体材料。该研究结果可为菌株在实际环境中施用,缓解阿特拉津污染土壤问题,提供可行的解决思路。
参考文献(References):
[1] VILLAVERDE J,RUBIO-BELLIDO M,LARA-MORENO A,et al. Combined use of microbial consortia isolated from different agricultural soils and cyclodextrin as a bioremediation technique for herbicide contaminated soils[J].Chemosphere,2018,193: 118-125.
[2] 陈文. 含氮和硫的杂环化合物的合成和农药活性[J]. 农药,1987,26(6): 41-42.
CHEN W. Synthesis and pesticide activity of heterocyclic compounds containing nitrogen and sulfur[J].Agrochemicals,1987,26(6): 41-42.(in Chinese)
[3] 柏亚罗,石凌波. 三嗪类除草剂的全球市场及发展前景[J]. 现代农药,2018,17(3): 1-8,21.
BAI Y L,SHI L B. Global market and development prospect on triazine herbicides[J].ModernAgrochemicals,2018,17(3): 1-8,21.(in Chinese with English abstract)
[4] KNAUERT S,ESCHER B,SINGER H,et al. Mixture toxicity of three photosystem II inhibitors (atrazine,isoproturon,and diuron) toward photosynthesis of freshwater phytoplankton studied in outdoor mesocosms[J].EnvironmentalScience&Technology,2008,42(17): 6424-6430.
[5] SOLOMON R D J,KUMAR A,SATHEEJA SANTHI V. Atrazine biodegradation efficiency,metabolite detection,and trzD gene expression by enrichment bacterial cultures from agricultural soil[J].JournalofZhejiangUniversitySCIENCEB,2013,14(12): 1162-1172.
[6] 李阳阳,张金波,沙君雪,等. 阿特拉津降解菌LY-2的分离鉴定及其对污染土壤的修复[J]. 农业生物技术学报,2018,26(6): 987-994.
LI Y Y,ZHANG J B,SHA J X,et al. Isolation and identification of atrazine-degrading bacterial strain LY-2 and its bioremediation to contaminated soil[J].JournalofAgriculturalBiotechnology,2018,26(6): 987-994.(in Chinese with English abstract)
[7] 高远,杨帆,秦景. 阿特拉津环境危害及污染防治对策[J]. 水利技术监督,2014,22(2): 11-13.
GAO Y,YANG F,QIN J. Environmental hazards of atrazine and countermeasures for pollution control.[J].TechnicalSupervision in Water Resources,2014,22(2): 11-13.(in Chinese)
[8] 刘丹丹,孙宛玉,刘畅,等. 菌株Enterobactersp.降解除草剂阿特拉津产物测定及降解基因克隆[J]. 河南农业科学,2019,48(10): 70-76.
LIU D D,SUN W Y,LIU C,et al. Determination of herbicide atrazine degradation products by strainEnterobactersp degradation gene cloning[J].JournalofHenanAgriculturalSciences,2019,48(10): 70-76.(in Chinese with English abstract)
[9] WANG H,LIU Y,LI J,et al. Biodegradation of atrazine byArthrobactersp. C3,isolated from the herbicide-contaminated corn field[J].InternationalJournalofEnvironmentalScienceandTechnology,2016,13(1): 257-262.
[10] 唐伟,张远,王书平,等. 微生物菌剂在水体修复中的应用进展[J]. 环境工程技术学报,2019,9(2): 151-158.
TANG W,ZHANG Y,WANG S P,et al. Application progress of microbial agents in water remediation[J].JournalofEnvironmentalEngineeringTechnology,2019,9(2): 151-158.(in Chinese with English abstract)
[11] 王小兵,骆永明,刘五星,等. 花生青枯病内生拮抗细菌的鉴定、抗菌活性及其田间防效[J]. 中国生物防治学报,2011,27(1): 88-92.
WANG X B,LUO Y M,LIU W X,et al. Identification,antimicrobial activity and field control efficacy of an endophytic bacteria strain against peanut bacterial wilt[J].ChineseJournalofBiologicalControl,2011,27(1): 88-92.(in Chinese with English abstract)
[12] 代小丽,王硕,李佳斌,等. 石油污染土壤原位生物修复强化技术研究进展[J]. 环境工程技术学报,2020,10(3): 456-466.
DAI X L,WANG S,LI J B,et al. Research progress oninsitubioremediation enhancement technology of oil contaminated soil[J].JournalofEnvironmentalEngineeringTechnology,2020,10(3): 456-466.(in Chinese with English abstract)
[13] 许洪章,彭猛,张光明,等. 固定化光合细菌技术及其运用的研究进展[J]. 环境科学与技术,2016,39(7): 105-113.
XU H Z,PENG M,ZHANG G M,et al. Research progress of technology and application of immobilized photosynthetic bacteria[J].EnvironmentalScience&Technology,2016,39(7): 105-113.(in Chinese with English abstract)
[14] 李海玲,陈丽华,肖朝虎,等. 微生物固定化载体材料的研究进展[J]. 现代化工,2020,40(8): 58-61.
LI H L,CHEN L H,XIAO C H,et al. Research progress in microorganisms immobilized carrier materials[J].ModernChemicalIndustry,2020,40(8): 58-61.(in Chinese with English abstract)
[15] 李超敏,韩梅,张良,等. 细胞固定化技术: 海藻酸钠包埋法的研究进展[J]. 安徽农业科学,2006,34(7): 1281-1282.
LI C M,HAN M,ZHANG L,et al. Development of the sodium-aliginate immobilized cell technology[J].JournalofAnhuiAgriculturalSciences,2006,34(7): 1281-1282.(in Chinese with English abstract)
[16] 尤嘉懿. 菌丝球固定化体系构建及其对水中阿特拉津降解效能研究[D]. 哈尔滨: 哈尔滨工业大学,2019.
YOU J Y. Study on constrction of mycelium pellets immobilization system and the defradation efficiency of atrazine in water[D]. Harbin: Harbin Institute of Technology,2019. (in Chinese with English abstract)
[17] HOT G J,KRIEG R N,SNEATH H A P,et al. Bergey’s manual of determinative B-acteriology [M]. Baltimore: Williams & Wilkins,1994.
[18] 臧凯丽,王泳,赵林森,等. 球磨-CTAB法提取嗜酸乳杆菌基因组DNA条件优化[J]. 生物技术,2018,28(3): 236-241.
ZANG K L,WANG Y,ZHAO L S,et al. Conditions research on beadbeater-CTAB extractionofLactobacillusacidophilusgenome DNA[J].Biotechnology,2018,28(3): 236-241.(in Chinese with English abstract)
[19] 张丽娜,荣昌鹤,何远,等. 常用系统发育树构建算法和软件鸟瞰[J]. 动物学研究,2013,34(6): 640-650.
ZHANG L N,RONG C H,HE Y,et al. A bird’s eye view of the algorithms and software packages for reconstructing phylogenetic trees[J].ZoologicalResearch,2013,34(6): 640-650.(in Chinese with English abstract)
[20] 程曼曼. 固相萃取-气相色谱-质谱法测定地表水中的莠去津、灭草松和呋喃丹[J]. 化学分析计量,2019,28(3): 100-103.
CHENG M M. Determination of atrazine,methachlor and furadan in surface water by solid phase extraction-gas chromatography-mass spectrometry[J].ChemicalAnalysisandMeterage,2019,28(3): 100-103.(in Chinese with English abstract)
[21] 中华人民共和国环境保护部. 水质 阿特拉津的测定 气相色谱法:HJ 754—2015[S]. 北京: 中国环境科学出版社,2015.
[22] 葛世杰. 固定化阿特拉津降解酶制备及其土壤修复效果研究[D]. 哈尔滨: 东北农业大学,2013.
GE S J. Study on immobilized atrazine degradation enzyme properties and soil remediation effect[D]. Harbin: Northeast Agricultural University,2013. (in Chinese with English abstract)
[23] 马培培,苏梦茹,李鑫鑫,等. 大肠埃希菌细菌计数分光光度计法的建立及应用[J]. 动物医学进展,2020,41(5): 29-33.
MA P P,SU M R,LI X X,et al. Establishment and application ofEscherichiacolicounting method based on spectrophotometer[J].ProgressinVeterinaryMedicine,2020,41(5): 29-33.(in Chinese with English abstract)
[24] 杨晓燕. 固定化阿特拉津降解菌-藻体系的构建及去除水体中阿特拉津的研究[D]. 北京: 中国农业科学院,2018.
YANG X Y. Construction of immobilized atrazine-degrading bacteria-algae system and study on removal of atrazine in water[D].Beijing: Chinese Academy of Agricultural Sciences,2018. (in Chinese with English abstract)
[25] 辛承友. 细菌HB-5及其固定化在土壤污染修复和莠去津生产废水处理中的应用[D]. 泰安: 山东农业大学,2004.
XIN C Y. Application of bacterial HB-5 and its immobilization in soil remediation andwastewater of atrazine[D].Tai’ian: Shandong Agricultural University,2004. (in Chinese with English abstract)
[26] 孙丽慧,沈爱萍,何宝龙,等. 海藻酸钠-聚乙烯醇-活性炭共固定化重组大肠杆菌细胞[J]. 中国食品学报,2015,15(2): 21-27.
SUN L H,SHEN A P,HE B L,et al. Co-immobilized recombinantEscherichiacolicells with sodium alginate-PVA-activated carbon[J].JournalofChineseInstituteofFoodScienceandTechnology,2015,15(2): 21-27.(in Chinese with English abstract)
[27] ZHANG Y,LI C Y,DIAO Z,et al. Immobilized atrazine degrading bacteria by different material[C]//2010 4th International Conference on Bioinformatics and Biomedical Engineering. June 18-20,2010,Chengdu,China. IEEE,2010: 1-4.
[28] 温雪松,李颖,李婧,等. 降解除草剂阿特拉津的藤黄微球菌AD3菌株的分离、鉴定和降解特性研究[J]. 环境科学学报,2005,25(8): 1066-1070.
WEN X S,LI Y,LI J,et al. Isolation and identification of atrazine-degrading Micrococcus luteus AD3 and studies on its degradation characteristics[J].ActaScientiaeCircumstantiae,2005,25(8): 1066-1070.(in Chinese with English abstract)
[29] CRAWFORD J J,SIMS G K,MULVANEY R L,et al. Biodegradation of atrazine under denitrifying conditions[J].AppliedMicrobiologyandBiotechnology,1998,49(5): 618-623.
[30] 赵昕悦,马放,杨基先,等. 阿特拉津降解菌Pseudomonassp.ZXY-1的分离鉴定及降解动力学[J]. 哈尔滨工业大学学报,2018,50(2): 82-88.
ZHAO X Y,MA F,YANG J X,et al. Isolation of an atrazine-degrading bacterium (Pseudomonassp. ZXY-1) and its biodegradation and kinetic studies[J].JournalofHarbinInstituteofTechnology,2018,50(2): 82-88.(in Chinese with English abstract)
[31] 许艳婷,李祎,赵国威,等. 絮凝菌株Shinella sp.xn-1对铜绿微囊藻的絮凝效果[J]. 微生物学通报,2017,44(8): 1808-1816.
XU Y T,LI Y,ZHAO G W,et al. Flocculation effect ofShinellasp. xn-1 onMicrocystisaeruginosa[J].MicrobiologyChina,2017,44(8): 1808-1816.(in Chinese with English abstract)
[32] 刘冰冰. 土壤中三价砷氧化菌的分离、鉴定与氧化特性研究[D]. 南京: 南京农业大学,2014.
LIU B B. Isolation and identification and identification of trivalent arsenic-oxidizing bacteria in soil [D]. Nanjing: Nanjing Agricultural University,2014. (in Chinese with English abstract)
[33] 刘伟林,占桂婷,王婷,等. 草螺菌Herbaspirillumsp.WT00F的生理生化性质和促生作用研究[J]. 湖北大学学报(自然科学版),2017,39(3): 291-298,304.
LIU W L,ZHAN G T,WANG T,et al. Physiochemical properties and growth-promoting effects ofHerbaspirillumsp. WT00F[J].JournalofHubeiUniversity(NaturalScience),2017,39(3): 291-298,304.(in Chinese with English abstract)
[34] 汪苹,项慕飞,翟茜. 从不同反应器筛选、鉴别好氧反硝化菌[J]. 环境科学研究,2007,20(4): 120-124.
WANG P,XIANG M F,ZHAI Q. Selection and identification of aerobic denitrifiers from different reactors[J].ResearchofEnvironmentalSciences,2007,20(4): 120-124.(in Chinese with English abstract)
[35] 宋昊,何泽超. 降酚菌株的固定化细胞处理含酚废水的性能研究[J]. 环境污染治理技术与设备,2005 (9): 37-40.
SONG H,HE Z C. Study on immobilized cells of degrading-phenol strain[J].TechniquesandEquipmentforEnvironmentalPollutionControl,2005 (9): 37-40.(in Chinese with English abstract)
