lncRNA CBR3-AS1靶向调控miR-5195-3p促进胃癌细胞增殖、迁移及侵袭
2021-06-30刘洪涛李医明
刘 亮,刘洪涛,李医明
北部战区总院普通肝胆外科,辽宁 沈阳 110016
胃癌是临床常见的一种恶性肿瘤,近年来,胃癌发病率逐年上升,其主要类型为腺癌,胃癌细胞转移是导致患者死亡率增加的重要原因[1-3]。目前胃癌细胞侵袭及转移的分子机制尚未完全阐明,lncRNA在胃癌组织或细胞中表达异常而调控细胞增殖、迁移等生物学过程从而参与胃癌发生及发展过程[4]。lncRNA CBR3-AS1在胆管癌中表达上调,其表达量与患者临床病理特征密切相关[5]。通过生物信息学分析显示miR-5195-3p可能是CBR3-AS1的靶基因,miR-5195-3p在骨肉瘤细胞中表达下调,上调其表达可抑制细胞增殖及诱导细胞凋亡[6]。但CBR3-AS1是否通过调控miR-5195-3p的表达从而参与胃癌发生及发展过程尚未知。因此,本研究主要探讨CBR3-AS1对胃癌细胞增殖、迁移及侵袭的影响,探究其对miR-5195-3p的靶向调控作用,旨在为进一步揭示胃癌细胞迁移及侵袭的分子机制奠定实验基础。
1 材料与方法
1.1 材料与试剂正常胃上皮细胞GES-1与胃癌细胞系HGC-27、NCI-N87、AGS(美国ATCC细胞库)。杜氏改良培养基(DMEM)、胎牛血清、胰蛋白酶(美国Gibco公司);Lipofectamine 2000(美国Invitrogen公司);Trizol试剂(北京全式金生物技术有限公司);反转录与qRT-PCR试剂盒(北京天根生化科技有限公司);CBR3-AS1小分子干扰RNA(si-CBR3-AS1)、乱序无意义阴性序列(si-NC)、miR-5195-3p寡核苷酸模拟物(miR-5195-3p mimics)及阴性对照mimic NC序列(miR-NC)、miR-5195-3p特异性寡核苷酸抑制剂(anti-miR-5195-3p)及其阴性对照(anti-miR-NC)(上海吉玛制药技术有限公司);MTT、细胞凋亡试剂盒(美国Sigma公司);Transwell小室(美国Corning公司);Matrigel基质胶(美国BD公司);兔抗人E-cadherin、N-cadherin抗体(美国Santa Cruz公司);HRP标记的山羊抗兔二抗(美国Abcam公司)。
1.2 方法
1.2.1 实验分组:GES-1、HGC-27、NCI-N87、AGS细胞常规培养于DMEM完全培养基,选取对数生长期胃癌细胞AGS(1×108个/ml)接种于96孔板(100 μl/孔),参照Lipofectamine 2000转染试剂说明书分别将si-NC、si-CBR3-AS1、si-CBR3-AS1与anti-miR-NC、si-CBR3-AS1与anti-miR-5195-3p转染至AGS细胞,分别记作si-NC组、si-CBR3-AS1组、si-CBR3-AS1+anti-miR-NC组、si-CBR3-AS1+anti-miR-5195-3p组,转染6 h后将培养基更换为含有血清的培养基,转染48 h后收集细胞。
1.2.2 qRT-PCR检测细胞中CBR3-AS1、miR-5195-3p的表达水平:收集GES-1、HGC-27、NCI-N87、AGS细胞及转染后的AGS细胞,采用Trizol法提取细胞中的总RNA。应用Nanodrop 2000c超微量分光光度计检测RNA浓度。将总RNA合成cDNA。CBR3-AS1正向引物:5′-CAGTGGGGAACTCTGACTCG-3′,反向引物:5′-GTGCCTGGTGCTCTCTTACC-3′;miR-5195-3p正向引物:5′-CAGAGAACAACATGGGAGCG-3′,反向引物:5′-ACTACGATCGATCTGACTGCA-3′;U6正向引物:5′-GCTTCGGCAGCACATATACT-3′,反向引物5′-GTGCAGGGTCCGAGGTATTC-3′;GAPDH正向引物:5′-AACGGATTTGGTCGTATTG-3′,反向引物:5′-GGAAGATGGTGATGGGATT-3′,引物由上海生工生物工程股份有限公司设计合成。qRT-PCR反应体系:cDNA 2 μl,Real-Time Master Mix 10 μl,正反向引物各1 μl,RNase-Free ddH2O补足体系至20 μl;反应条件:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。CBR3-AS1以GAPDH为内参,miR-5195-3p以U6为内参,采用2-ΔΔCt法计算CBR3-AS1、miR-5195-3p的表达水平。
1.2.3 MTT检测细胞增殖:收集各组对数生长期AGS细胞接种于96孔板(5×104个/孔),每孔加入20 μl MTT溶液(质量浓度为5 mg/ml),继续培养4 h,弃上清,加入150 μl DMSO,室温振荡孵育5 min,应用酶标仪检测各孔吸光度值(OD值),细胞活力(%)=(实验组OD值/对照组OD值)×100%。
1.2.4 Transwell小室实验检测细胞迁移和侵袭:细胞迁移实验:收集各组AGS细胞(5×104个/ml)接种于Transwell小室的上室(200 μl/孔),Transwell小室的下室加入600 μl含质量浓度为100 g/L胎牛血清的培养液,继续培养24 h,PBS洗涤,依次分别进行多聚甲醛固定(20 min)与结晶紫染液染色(10 min),PBS洗涤后观察迁移细胞数。细胞侵袭实验:稀释Matrigel基质胶(预冷培养基),将Matrigel基质胶稀释液分别加入Transwell小室的上室(40 μl/孔),室温孵育5 h,后续实验步骤同细胞迁移实验,观察侵袭细胞数。
1.2.5 双荧光素酶报告基因检测CBR3-AS1的靶基因:starBase预测显示CBR3-AS1与miR-5195-3p存在结合位点,分别构建野生型载体WT-CBR3-AS1、突变型载体MUT-CBR3-AS1,将miR-NC、miR-5195-3p mimics分别与WT-CBR3-AS1、MUT-CBR3-AS1共转染至AGS细胞,转染24 h后收集细胞,检测各组荧光素酶活性。
1.2.6 蛋白免疫印迹法(Western blotting)检测E-cadherin、N-cadherin蛋白表达:收集各组AGS细胞,加入400 μl RIPA裂解液提取细胞总蛋白。参照BCA检测试剂盒测定蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将分离的蛋白凝胶转移至PVDF膜,质量浓度为50 g/L的脱脂奶粉封闭2 h,分别加入E-cadherin(1∶1 000)、N-cadherin(1∶1 000)与内参GAPDH(1∶1 000)一抗稀释液,次日进行TBST洗涤,加入二抗稀释液(1∶2 000),室温孵育1 h,TBST洗涤,显影,应用Image J软件分析各条带灰度值。
2 结果
2.1 胃癌细胞中CBR3-AS1、miR-5195-3p的表达量比较与GES-1比较,胃癌细胞系HGC-27、NCI-N87、AGS中CBR3-AS1的表达水平显著升高(P<0.05),miR-5195-3p的表达水平显著降低(P<0.05),其中CBR3-AS1在胃癌细胞AGS中的表达水平相对较高,因而选用胃癌细胞AGS进行后续实验(见表1)。
表1 胃癌细胞中CBR3-AS1、miR-5195-3p的表达量比较Tab 1 Comparison of expression levels of CBR3-AS1 and miR-5195-3p in gastric cancer cells
2.2 干扰CBR3-AS1表达对胃癌细胞AGS增殖、迁移及侵袭的影响与si-NC组比较,si-CBR3-AS1组细胞活力显著降低(P<0.05),迁移细胞数和侵袭细胞数显著减少(P<0.05),E-cadherin蛋白水平显著升高(P<0.05),N-cadherin蛋白水平显著降低(P<0.05),差异均有统计学意义(见图1、表2)。
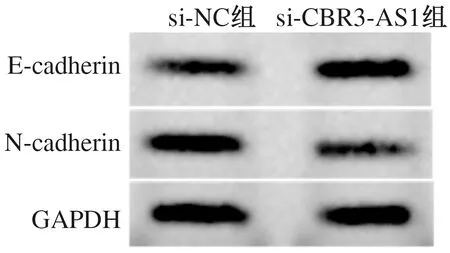
图1 Western blotting检测E-cadherin、N-cadherin蛋白表达Fig 1 Western blotting was used to detect the expression of E-cadherin and N-cadherin protein
表2 干扰CBR3-AS1表达对胃癌细胞AGS增殖、迁移及侵袭的影响Tab 2 Effects of interference with CBR3-AS1 expression on the proliferation,migration and invasion of gastric
2.3 CBR3-AS1靶向调控miR-5195-3pstarBase预测显示CBR3-AS1与miR-5195-3p存在结合位点(见图2)。双荧光素酶报告实验结果显示,共转染野生型载体WT-CBR3-AS1的细胞实验中,与miR-NC组比较,miR-5195-3p组荧光素酶活性显著降低(P<0.05);共转染突变型载体MUT-CBR3-AS1的细胞实验中,miR-5195-3p组荧光素酶活性与miR-NC组比较,差异无统计学意义(P>0.05)(见表3)。与si-NC组比较,si-CBR3-AS1组miR-5195-3p的表达水平显著升高(P<0.05)(见表4)。
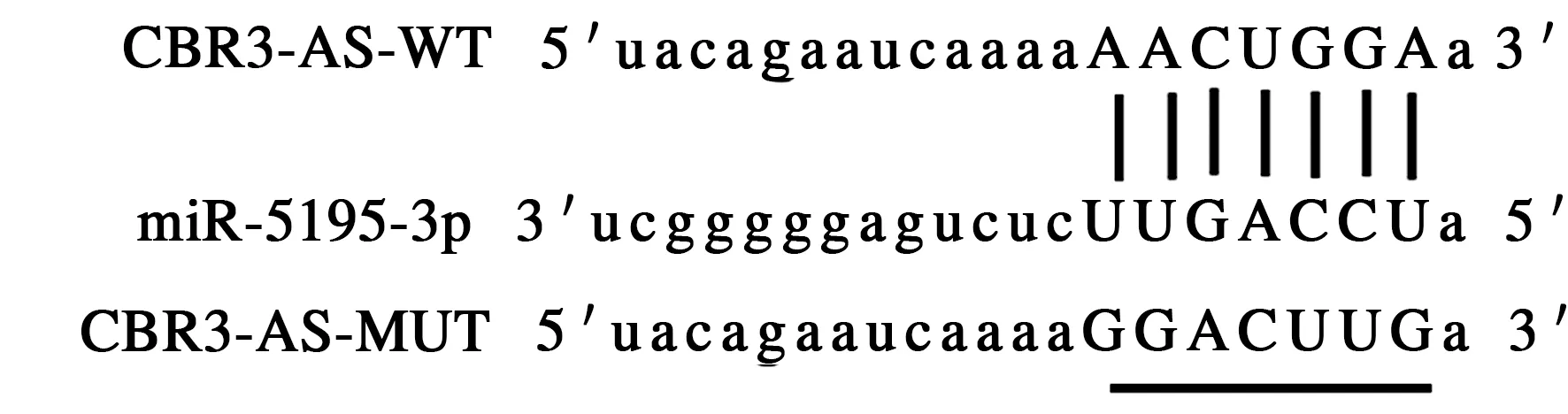
图2 CBR3-AS1的序列中含有与miR-5195-3p互补的核苷酸序列Fig 2 The sequence of CBR3-AS1 contained a nucleotide sequence complementary to miR-5195-3p

表3 双荧光素酶报告实验Tab 3 Double luciferase report experiment
表4 CBR3-AS1靶向调控miR-5195-3p的表达Tab 4 CBR3-AS1 targeted and regulated the expression of
2.4 干扰miR-5195-3p表达可降低干扰CBR3-AS1表达对胃癌细胞AGS增殖、迁移及侵袭的抑制作用与si-CBR3-AS1+anti-miR-NC组比较,si-CBR3-AS1+anti-miR-5195-3p组细胞活力显著升高(P<0.05),迁移细胞数和侵袭细胞数显著增多(P<0.05),E-cadherin蛋白水平显著降低(P<0.05),N-cadherin蛋白水平显著升高(P<0.05),差异均有统计学意义(见图3、表5)。

图3 Western blotting检测E-cadherin、N-cadherin蛋白表达Fig 3 Western blotting was used to detect the expression of E-cadherin and N-cadherin protein

表5 干扰miR-5195-3p表达可降低干扰CBR3-AS1表达对胃癌细胞AGS增殖、迁移及侵袭的抑制作用Tab 5 Interference with miR-5195-3p expression could reduce the inhibitory effect of interference with CBR3-AS1 expression on the proliferation,migration and invasion of gastric cancer cell AGS
3 讨论
胃癌发生及转移过程涉及多基因、多信号通路异常等,lncRNA表达异常可参与肿瘤发生及发展过程,还可调控细胞增殖、凋亡等多种生物信息学过程,其表达量异常还与胃癌患者临床病理学参数密切相关[7-11]。但仍有部分lncRNA在胃癌发生及发展过程中的作用机制尚未阐明,因而本研究积极探寻新型lncRNA并探究其可能调控机制,为胃癌的靶向治疗提供潜在靶点。
CBR3-AS1在骨肉瘤组织或细胞中表达上调,并可促进骨肉瘤发生及发展[12]。本研究结果显示,胃癌细胞系中CBR3-AS1的表达水平升高,提示CBR3-AS1在胃癌发生过程中可能发挥重要调控作用。研究表明上皮-间质转化(EMT)与肿瘤细胞迁移及侵袭密切相关,上皮细胞标志物E-cadherin表达上调可抑制EMT从而抑制肿瘤转移,间充质细胞标志物N-cadherin表达上调可促进EMT从而增强肿瘤转移能力[13]。本研究结果显示,干扰CBR3-AS1的表达后细胞活力显著降低,迁移细胞数和侵袭细胞数显著减少,E-cadherin表达升高,N-cadherin表达降低,提示干扰CBR3-AS1的表达可抑制胃癌细胞增殖,还可能通过调控EMT途径从而抑制胃癌细胞迁移及侵袭。
miR-5195-3p通过下调EIF4A2增强三阴性乳腺癌对紫杉醇的化学敏感性[14]。miR-5195-3p表达下调可促进卵巢癌细胞转移及肿瘤发生[15]。miR-5195-3p可抑制人非小细胞肺癌细胞增殖、迁移及侵袭[16]。miR-5195-3p通过直接靶向癌基因KLF5抑制人膀胱癌细胞的增殖及侵袭[17]。本研究结果显示,胃癌细胞中miR-5195-3p的表达水平显著降低,进一步分析显示,CBR3-AS1可靶向结合miR-5195-3p,还可负向调控miR-5195-3p的表达,由此推测CBR3-AS1可能通过调控miR-5195-3p的表达从而影响胃癌细胞增殖、迁移及侵袭。本研究将si-CBR3-AS1与anti-miR-5195-3p共转染至胃癌细胞,结果显示,细胞增殖、迁移与侵袭能力增强,并可抑制E-cadherin表达及促进N-cadherin表达,说明干扰miR-5195-3p表达可降低干扰CBR3-AS1表达对胃癌细胞增殖、迁移及侵袭的抑制作用。提示干扰CBR3-AS1表达可能通过上调miR-5195-3p的表达从而抑制胃癌细胞增殖、迁移及侵袭。
综上所述,干扰CBR3-AS1表达可减弱胃癌细胞增殖、迁移及侵袭能力,其作用机制可能通过靶向调控miR-5195-3p的表达而发挥作用,可为进一步揭示胃癌发生及转移的分子机制奠定实验基础,还可能作为胃癌靶向治疗的潜在靶点。但关于miR-5195-3p下游靶基因及其可能作用机制仍需进一步探究。
