甘薯烤制过程中美拉德反应主要成分及香味成分含量的动态变化
2021-06-30郑美玲张文洁朱远洋冯衍闯徐如彦张峻松
郑美玲,张文洁,朱远洋,冯衍闯,徐如彦,张峻松
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450001;2.江苏中烟工业有限责任公司技术中心,江苏 南京 210008)
甘薯别称红薯、番薯、地瓜,是世界上重要的粮食作物,我国是世界第一大甘薯生产国[1]。甘薯具有极高的营养价值,明朝李时珍的《本草纲目》记载:“番薯具有补虚乏、益气力、健脾胃、强肾阳之功效”。现代研究表明,甘薯含有丰富的糖类、蛋白质、维生素等,具有刺激肠道蠕动、增强免疫力、抗衰老等多种保健功能[2]。
甘薯经烤制后,香甜可口、十分诱人,常作为街头小吃,是理想的休闲食品。国内外研究表明,烤甘薯散发的特殊烤甜香韵源于烤制过程中甘薯内部碳水化合物的降解,其中美拉德反应极为重要[3-6]。美拉德反应广泛存在于食品加工过程中,通常是还原糖与氨基化合物(氨基酸、蛋白质等)间的缩合反应,该反应会产生醛、酮、含氧杂环类化合物等一系列挥发性香味成分[7-8]。目前,国内学者利用这一形成机制成功研制了烤甘薯香料并验证了其加香效果[4,9-10]。然而,对于甘薯烤制过程中美拉德反应主要成分及挥发性香味物质的动态变化鲜见报道。鉴于此,本文重点关注甘薯烤制过程中淀粉、糖类、氨基酸等主要成分的含量变化、淀粉酶活性变化及挥发性香味成分含量的变化,旨在揭示其动态变化规律,以期进一步阐明烤甘薯香气的形成机制。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
龙薯9号,购于河南郑州;3,5-二硝基水杨酸,国药集团化学试剂有限公司;氢氧化钠、酒石酸钾钠、亚硫酸钠、醋酸铅、硫酸钠,天津市大茂化学试剂厂;结晶酚,北京华越洋生物有限公司;蒸馏水,杭州娃哈哈集团有限公司;盐酸,洛阳昊华化学试剂有限公司;无水乙醇(AR),天津市富宇精细化工有限公司;乙酸苯乙酯、三乙胺、异硫氰酸苯酯(≥98%),百灵威科技有限公司;甲醇(≥99.8%),迪马科技有限公司;浓硫酸,洛阳昊华化学试剂有限公司;可溶性淀粉、葡萄糖、果糖、蔗糖、麦芽糖,天津市科密欧化学试剂有限公司;甲基红、21种氨基酸标准品,上海阿拉丁生化科技股份有限公司。
1.1.2 仪器与设备
7890B/5977A气相色谱-质谱(GC/MS)联用仪,美国Agilent公司;1260型高效液相色谱仪(配备自动进样器,DAD,ELSD),美国Agilent公司;EL204电子天平(感量:0.000 1 g),Mettler-Toledo仪器(上海)有限公司;BGZ-140电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;SB-1300水浴锅,上海爱郎仪器有限公司;SHB-3循环水多用真空泵,郑州杜甫仪器厂;HZQ-F160全温振荡仪,太仓市实验设备厂;FJ200-SH型数显高速分散均质机,上海标本模型厂;TG16-WS高速离心机,湖南沪廉离心机有限公司;D-37520离心机,德国赛默飞科技有限公司。
1.2 方法
1.2.1 样品制备
取12个大小中等(质量约为400 g)、完好无损的甘薯,洗净沥干后放入烤箱,200℃下分别烤制0、15、30、45、60、75、90、105、120 min,将烤后甘薯用数显高速分散均质机打浆、混合均匀,待分析。
1.2.2 淀粉含量的测定
准确称取5 g甘薯样品于50 mL离心管中,加入10 mL乙醚后3 000 r/min离心10 min以除去脂肪,重复5次,弃去上清液。再加入30 mL 85%乙醇溶液3 000 r/min离心10 min以除去可溶性糖,重复5次,弃去上清液。参照GB 5009.9—2016[11]的酸水解法对残渣进行处理,制备待测液。
吸取2.0 mL待测液于25 mL试管中,先加入1.5 mL DNS试剂,摇匀,沸水浴中煮沸5 min,流水冷却后定容至25 mL。以不含待测液的溶液为参照,用紫外分光光度计在540 nm波长下测吸光度,平行测定3次[12]。
1.2.3 淀粉酶活性的测定
准确称取1.0 g甘薯样品,放入50 mL离心管中,加入12 mL蒸馏水,于3 000 r/min下离心20 min,将上清液转移到50 mL容量瓶中,同法进行第二次处理,定容,即为甘薯淀粉酶活性待测液。
吸取0.2 mL待测液于25 mL试管中,加入1 mL在40℃水浴的1%淀粉溶液,摇匀,40℃下水浴15min,加入2 mL DNS试剂,摇匀,沸水浴中煮沸5 min,流水冷却后定容至25 mL。以不含待测液的溶液为参照,用紫外分光光度计在540 nm波长下测吸光度,平行测定3次[13]。
1.2.4 可溶性总糖、还原糖含量的测定
准确称取1.0 g甘薯样品,放入100 mL烧杯中,先加入少量蒸馏水调成糊状,然后加入25 mL蒸馏水,搅匀,置于50℃水浴锅中浸提20 min。将溶液过滤至100 mL容量瓶中,对残渣同法进行二次处理,定容,即为甘薯可溶性总糖、还原糖待测液。
参照姚黎霞[12]的方法对可溶性总糖、还原糖含量进行测定。
1.2.5 葡萄糖、果糖、蔗糖、麦芽糖含量的测定
对照品溶液的制备:准确称取葡萄糖、果糖、蔗糖、麦芽糖各0.05 g于50 mL容量瓶中,加入纯水溶解,定容至刻度线,得到浓度约为1.0 mg/mL的混合对照储备液。将混合对照储备液逐级稀释成500、250、100、25、10、2.5、1μg/mL的标准溶液。
样品溶液的制备:将“1.2.4”中待测液用纯水稀释10倍后,过0.22μm水相膜后,进行HPLC分析。
色谱条件:色谱柱为Prevail Carb ES(250 mm×4.6 mm,5μm);流动相为水(A)—乙腈(B),洗脱梯度:0~20 min,20%~25%A;20~36 min,25%~45%A;26~33 min,45%A;33~37 min,45%~20%A;37~40 min,20%A;流速:0.8 mL/min;进样量:5μL。
1.2.6 氨基酸含量的测定
对照品溶液的制备:准确称取21种氨基酸各0.025 g于50 mL容量瓶中,加入纯水溶解,定容至刻度线,得到浓度约为0.5 mg/mL的混合对照储备液。将混合对照储备液逐级稀释成250、200、150、50、25、10、0.5μg/mL的标准溶液。
样品溶液的制备:称取5.0 g甘薯样品,置于50 mL离心管中,加水25 mL,涡旋振荡15 min后,置于高速离心机10 000 r/min离心20 min,将上清液转移至25 mL容量瓶中,加水定容至刻度线,备用。
衍生试剂的制备、溶液的衍生及色谱条件均参照李江含等[14]的方法进行。以浓度(x)为横坐标,峰面积(y)为纵坐标,拟合回归方程,见表1。

表1 氨基酸标准品的出峰时间及标准曲线方程Table 1 Retention time of amino acid standards and standard curve equation
1.2.7 挥发性香味成分的测定
准确称取10.0 g甘薯样品,加入30 mL甲醇溶剂(内标为乙酸苯乙酯),180r/min摇床振荡提取20min,高速离心机4 000 r/min离心10 min,取适量上清液,过0.45μm有机膜,进行GC-MS分析。
色谱条件:色谱柱HP-5MS(30 m×250μm×0.25μm);进样口温度280℃;分流比5∶1;载气He,流速1.0 mL/min;升温程序为50℃(保持2 min),然后以4℃/min的速率升温至180℃(保持5 min),最后以10℃/min速率升温至280℃(保持2 min)。
质谱条件:电子轰击离子源(EI)源电子能量70eV;质量扫描范围30~550 amu;离子源温度230℃;四极杆温度150℃,传输线温度280℃,溶剂延迟7 min。
利用NIST11谱库检索,以匹配度高于80%者予以定性,采用内标法进行半定量。
1.2.8 数据处理
上述试验均设置3组平行,数据采用Excel进行分析。
2 结果与分析
2.1 淀粉含量的变化
由图1可以看出,经过烤制后,甘薯中淀粉含量先减少后趋于平稳,淀粉总损失率达49.47%。本研究结论表明,甘薯在烤制45 min时淀粉酶完全失活,甘薯在烤制45 min内淀粉损失量达总损失量的57.69%,这个时间段内淀粉含量的下降应该是淀粉酶的水解作用所致的。烤制45 min后,淀粉不再受到淀粉酶的作用,但相关研究表明该品种甘薯淀粉在加热温度为68.75℃即可发生糊化,45 min后甘薯中淀粉含量的继续下降可能与此有关[15]。陆国权等[16]和李臣[17]的研究表明,不同品种的甘薯经烤制熟化后淀粉含量均呈现降低趋势。

图1 不同烤制时间淀粉含量变化曲线Fig.1 Change curve of starch contents after different baking time
2.2 淀粉酶活性的变化
甘薯中含有大量淀粉酶,其中β-淀粉酶占绝大部分,只有极少量的α-淀粉酶,前者作用于淀粉最终产物是麦芽糖,副产物少,最适温度为73~75℃,后者作用于淀粉可产生低聚糖、少量麦芽糖和葡萄糖等,最适温度是70~75℃。两者相比,α-淀粉酶对甘薯糖化影响作用不大[18-20]。烤制初期烤箱快速升温,达到70℃仅需要6 min,达到淀粉酶完全失去活性的温度(90℃)[20]需要10 min,但由于甘薯体积较大,热量从甘薯外层向内部传递需要较长的时间。因此烤制初期是一部分淀粉酶达到了最适温度,活性增强,具体表现为淀粉在15~30 min内减少速率最快(图2)。而甘薯外层由于温度过高,淀粉酶开始失活,整薯淀粉酶活性呈现下降趋势。甘薯烤制至30 min时,高温已传递至甘薯中心位置,淀粉酶几乎完全失去活性。

图2 不同烤制时间淀粉酶活性变化曲线Fig.2 Variation curveof amylaseactivitiesafter different baking time
2.3 可溶性总糖、还原糖含量的变化
由图3可以看出,甘薯中的还原糖含量由烤前的3.48%增加到11.10%后又略有下降,可溶性总糖含量由6.19%增加到19.48%后略有下降。烤制30 min内,甘薯中还原糖含量增加速率较快,是由于这个时间段内淀粉在淀粉酶的作用下产生大量还原糖,淀粉水解的速率大于美拉德反应的消耗速率。淀粉酶完全失活后,还原糖与可溶性总糖含量依然在增加,可能是淀粉水解产生的还原糖与原有双糖在高温作用下生成单糖,后期两者含量降低是由于淀粉酶完全失活后还原糖作为美拉德反应底物不断被消耗。
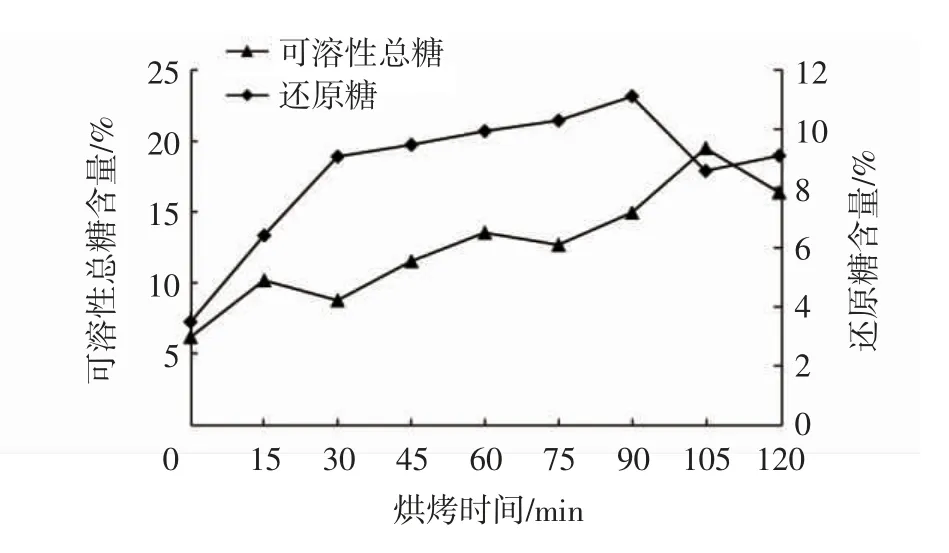
图3 不同烤制时间还原糖含量变化曲线Fig.3 Variation curve of reducing sugar contents after different baking time
2.4 葡萄糖、果糖、蔗糖、麦芽糖含量的变化
由图4可以看出,麦芽糖从最初的0.27%迅速增加到10.76%,到后期又有所下降。前期在β-淀粉酶的作用下,淀粉水解为麦芽糖,后期含量下降是β-淀粉酶失活后,甘薯内部因高温发生美拉德或焦糖化反应消耗了部分麦芽糖所致。而果糖、葡萄糖和蔗糖含量在烤制过程中几乎没有变化。Takahata等[20]研究也表明在低温时仅发现微量麦芽糖,麦芽糖含量在50℃以上快速增加,在80~85℃时达到最大值,而果糖、葡萄糖和蔗糖含量几乎不受烤制温度的影响。
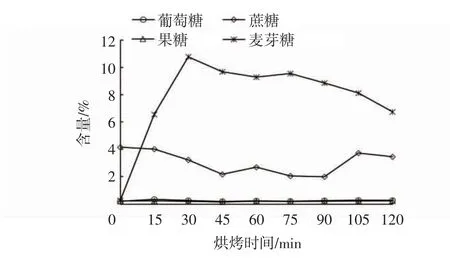
图4 不同烤制时间葡萄糖、果糖、蔗糖、麦芽糖含量变化曲线Fig.4 Variation curves of glucose,fructose,sucroseand maltose contentsafter different bakingtime
2.5 氨基酸含量的变化
在甘薯中实际检测出的氨基酸有18种,未检测到羟基脯氨酸、甘氨酸和胱氨酸。未烤制甘薯中氨基酸总含量为11103.35μg/g,其中主要有亮氨酸(342.17μg/g)、半胱氨酸(993μg/g)、精氨酸(330.71μg/g)、谷氨酸(469.41μg/g)、苯丙氨酸(341.08μg/g)、丝氨酸(4 356.39μg/g)、苏氨酸(351.77μg/g)、天冬氨酸(1 221.68μg/g)、酪氨酸(367.15μg/g)、脯氨酸(992.74μg/g),占总游离氨基酸含量的87.96%。由图5可以看出,氨基酸总含量随烤制温度的升高而降低,这是由于甘薯内部温度升高氨基酸与糖易发生美拉德反应消耗了部分氨基酸,烤制120 min后,甘薯内游离氨基酸共减少了54.69%。由图6可以看出,烤制过程中含量变化较大的几种氨基酸有半胱氨酸、异亮氨酸、谷氨酸、天冬氨酸、丝氨酸。除半胱氨酸、异亮氨酸、谷氨酸、苯丙氨酸、缬氨酸、苏氨酸、天冬氨酸及丙氨酸呈先增加后减少的趋势外,其余氨基酸均呈减少或几乎不变的趋势。李臣[17]研究表明,不同品种甘薯在烤制结束后可溶性蛋白含量均降低,这意味着随着时间的延长,甘薯中蛋白质因加热处理逐渐降解,本应使氨基酸含量增加,但同时这些氨基酸又与还原糖发生美拉德反应,降解产生和反应消耗速率的不同可能是导致不同氨基酸含量变化趋势不同的原因。丝氨酸及天冬氨酸在烤制过程中损失总和为5 134.91μg/g,占游离氨基酸损失总量的84.56%,这可能意味着丝氨酸及天冬氨酸对烤甘薯香气的形成有着重要作用。

图5 不同烤制时间氨基酸总含量变化曲线Fig.5 Variation curve of total amino acid contents after different baking time

图6 不同烤制时间氨基酸含量变化曲线Fig.6 Variation curves of amino acid contentsafter different bakingtime
2.6 挥发性香味成分的变化
由表2可以看出,甘薯在烤制过程中共鉴定出44种香味成分。未烤制甘薯中香味成分含量最低,随着烤制时间的增加,甘薯中香味成分总含量呈现先增加后减少的趋势,到45 min时甘薯中香味成分总含量达到最高值。
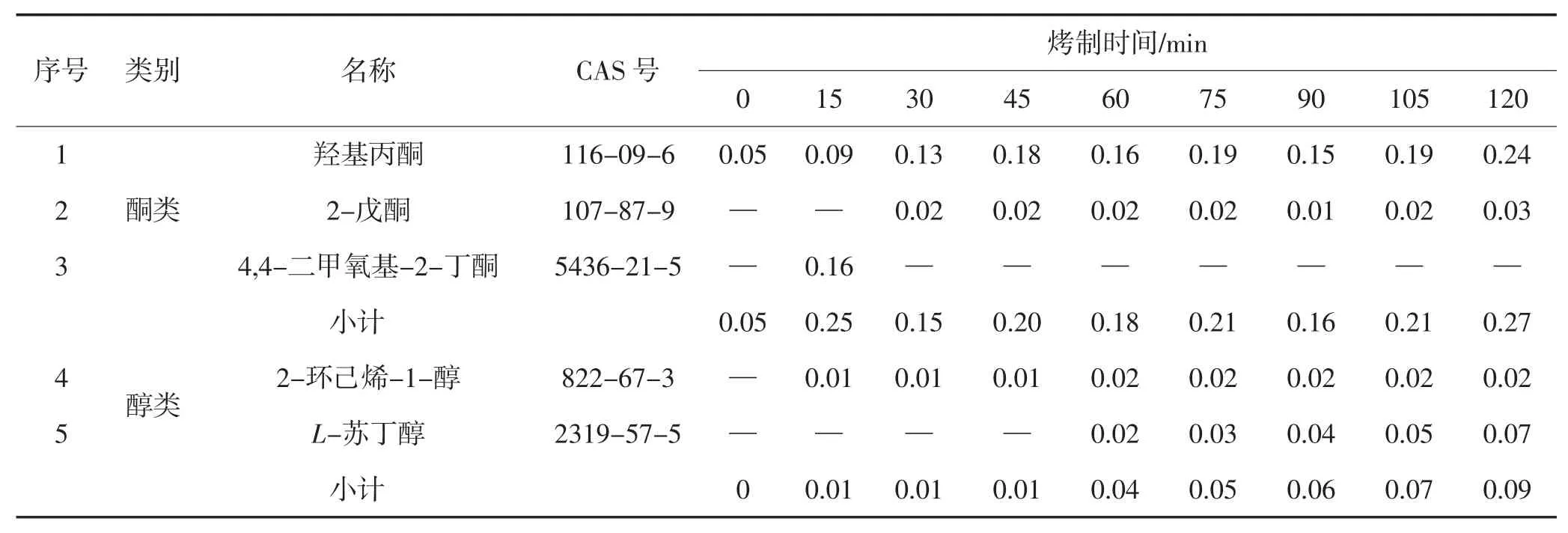
表2 不同烤制时间烤甘薯香味成分含量Table2 Contentsof aromacomponentsin baked sweet potatoesafter different bakingtime
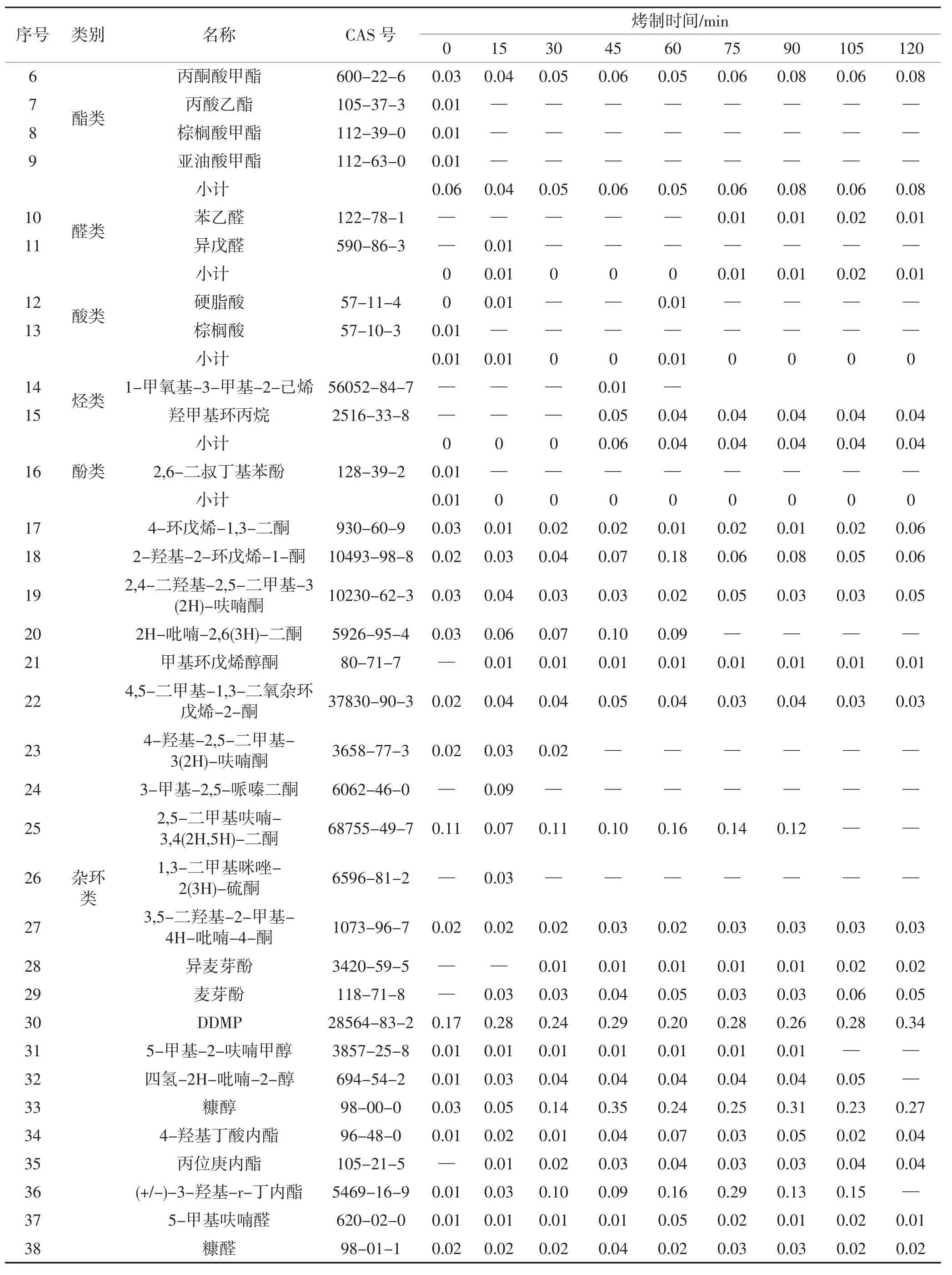
续表2 不同烤制时间烤甘薯香味成分含量Continue table 2 Contentsof aroma componentsin baked sweet potatoesafter different baking time
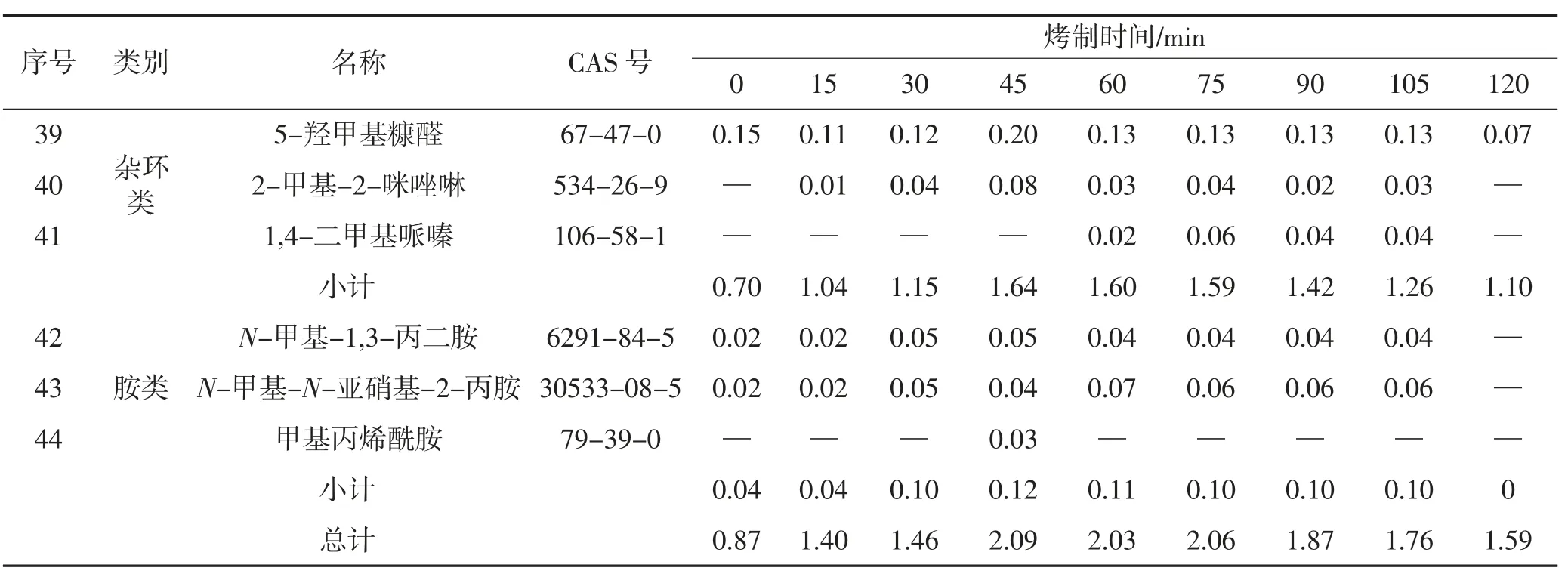
续表2 不同烤制时间烤甘薯香味成分含量Continue table 2 Contentsof aroma componentsin baked sweet potatoes after different baking time
将各烤制时间下香味成分进行分类,由图7可知,杂环类香味成分含量所占比重较大,主要包括环戊烯酮类、呋喃类、吡喃类等,产生于甘薯烤制过程中发生的美拉德和焦糖化反应,这些物质赋予烤甘薯烤甜香、焦甜香等香韵。如甲基环戊烯醇酮具有焦糖香及坚果香,主要用于食品香精的调制;异麦芽酚、麦芽酚具有浓烈的焦糖香和果香,主要用于食品加香与香味增效剂;糠醛呈甜感、焦糖的香韵;糠醇具有焦糖样或略有烤甜香韵;4-羟基-2,5-二甲基-3(2H)呋喃酮呈果味、焦糖、草莓的香气[21]。随着烤制时间的增加,杂环类香味成分含量呈现先增加后减少的趋势,原因可能是温度逐渐升高,甘薯水解产生的糖类与氮源发生美拉德反应的速率加快,烤制至90 min后,甘薯内部淀粉酶已完全失活,淀粉不再进行水解,麦芽糖作为反应底物不断被消耗,氨基酸含量尤其是易发生反应的半胱氨酸、异亮氨酸、谷氨酸、天冬氨酸、丝氨酸等氨基酸含量已接近最低值,氮源不足导致美拉德反应速率减缓。酮类、胺类物质含量呈现先增加后减少趋势,醇类物质总体呈现增加趋势,醛类、酸类、烃类、酚类各物质含量变化不大。
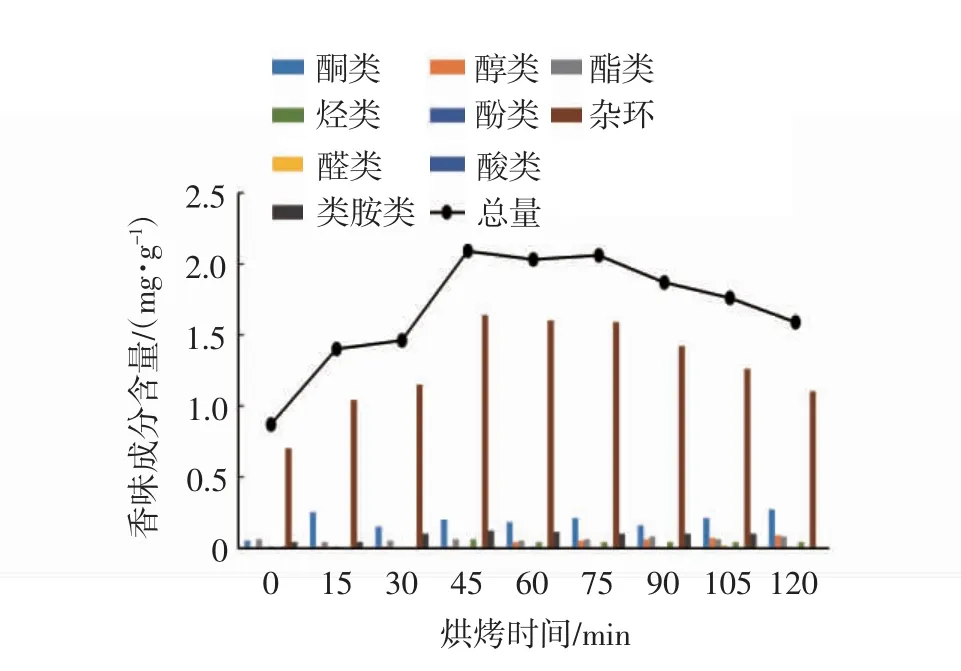
图7 不同烤制时间烤甘薯香味成分含量变化情况Fig.7 Changes of aroma componentsin baked sweet potatoes after different baking time
3 结论
甘薯在烤制过程中发生一系列复杂反应,主要是美拉德反应与焦糖化反应,赋予其烤甜香、焦甜香等独特的烤甘薯香韵。本文对甘薯在烤制过程中涉及的美拉德反应主要成分、淀粉酶活性及挥发性香味成分进行了测定分析,根据其动态变化规律将甘薯烤制过程中的美拉德反应分为以下3个过程:首先,在烤制前期(0~30 min),甘薯内部淀粉酶在适温下对淀粉进行水解生成大量还原糖,尤其是麦芽糖;然后,在烤制中期(30~90 min),甘薯中还原糖尤其是麦芽糖与谷氨酸、丝氨酸、天冬氨酸等氨基酸发生美拉德反应;最后,在烤制后期(90~120 min),甘薯内部易反应的氨基酸消耗殆尽,导致美拉德反应极为缓慢或终止。
本研究中甘薯的烤制温度为200℃,多项研究结果表明,当加热温度达到150~200℃时,醛糖或酮糖在没有氨基化合物存在的条件下会发生脱水、降解、缩合等反应,产生一些挥发性醛、酮等香味物质[22]。因此甘薯烤制过程中会伴随着焦糖化反应的进行,但该反应与甘薯内部理化指标的关系尚不明确,后续可结合焦糖化反应原理及影响因素等方面进行深入探究。
