基于PTEN/AKT通路变化探讨脾虚内环境与肝癌干性的关系*
2021-06-30吴英姿罗绍驹莫灼锚张诗军
陈 燕 吴英姿 罗绍驹 胡 浩 莫灼锚 张诗军△
1.中山大学附属第三医院中医科 (广东 广州,510630) 2.中山大学附属第一医院中医科
随着社会压力的增加和生活节奏的加快,越来越多的人表现出脾虚相关症状,而研究发现脾虚导致的内环境变化可能为肿瘤生长提供有利的土壤,正如《卫生宝鉴》所云“凡人脾胃虚弱,饮食不节或生冷过度,不能克化,致积聚结块”[1]。我们前期研究发现,脾虚内环境中有机阴离子转运肽(Oatp)2b1的分布及功能发生改变,此变化是脾虚湿浊转运障碍的物质基础之一,且与肝癌的发生和发展密切相关[2-4]。肿瘤干细胞(CSCs)干性的表达被认为是肿瘤发病、复发和转移的根源,研究发现机体受到内环境影响产生不同的肿瘤微环境,可能引发CSCs相关信号通路和表面分子标志物发生改变,其“干性”也可能随之发生变化[5,6],但脾虚内环境变化对肝癌CSCs干性的影响鲜有报道。本研究将观察脾虚内环境变化对CSCs干性及其相关信号通路PTEN/AKT的影响,进一步探讨脾虚内环境与肝癌的关系。
1 材料与方法
1.1 动物和细胞 SPF级C57BL/6小鼠60只(体重18~22 g,5~6周龄,雄性)以及Hepa1-6小鼠肝癌细胞株,由广东省医学实验动物中心提供,动物合格证号[SYXK(粤)2013-0002]。所有小鼠饲养于广东省医学实验动物中心SPF环境。本实验严格遵守实验动物福利和伦理原则,并通过广东省医学实验动物中心实验动物伦理委员会伦理审查(No.13201711-20)。
1.2 试剂和仪器 利血平购于Sigma公司。DMEM、Trypsin-EDTA、血清购于Gibco公司。Transwell板和Matrigel胶购于Corning公司。CCK8试剂盒购于北京金式金生物科技有限公司。主要使用仪器如下:超净工作台(苏静集团,SW-CJ-2FD),生物安全柜(苏静集团,BHC-1300IIA/B3),二氧化碳培养箱(Thermo,3111),低温冷冻离心机(Thermo,ST16R),台式低速离心机(湖南沪康,TDZ5-WS),显微镜(OLYMPUS,BX61),显微境成像系统(OLYMPUS,DP72),研究级倒置显微镜(mshOt,MF51),台式高速冷冻离心机(湖南湘仪,TGL-16),荧光PCR仪(Bio-Rad,CFX96)。
1.3 动物分组及脾虚模型建立 所有小鼠在广东省医学实验动物中心饲养1周后随机分为A组(空白组)、B组(脾虚组)、C组(肝癌组)、D组(脾虚肝癌组),每组15只。B组和D组小鼠给予0.1 mg/kg利血平皮下注射,A组和C组小鼠则皮下注射等量的生理盐水,1次/d,连续14 d,根据脾虚积分表评分,脾虚模型成模率100%[7]。
1.4 磁珠分离法分选CD133+Hepa1-6细胞 将培养好的2×107个Hepa1-6小鼠肝癌细胞加入300 μl磷酸缓冲液(PBS+0.5% BSA+2mmol/L EDTA),加入100 μl FCR Block缓冲液,再加入100 μl CD133磁珠,轻轻混匀后在冰上孵化30 min,用磷酸缓冲液洗一遍。将柱子放在分离架上,用磷酸缓冲液湿润后,再加入样品,然后用磷酸缓冲液洗柱子3次;再将柱子放入15 ml离心管,加入1 ml磷酸缓冲液,快速推入,离心后收集CD133+Hepa1-6细胞培养备用[8]。
1.5 脾虚肝癌模型建立 参照前期研究建立脾虚肝癌小鼠模型[9]。将C组和D组小鼠麻醉,碘伏消毒,沿左肋缘下方开腹,切口控制1 cm左右,暴露肝脏左叶;以无菌微量进样器抽取分选好的小鼠肝癌细胞CD133+Hepa1-6细胞,调整细胞密度为5×107个/ml,缓慢注射入肝脏,20 μl/只,无菌棉签压迫30 s,关闭腹腔缝合。SPF环境常规饲养28 d后,麻醉动物后颈椎脱臼处死,取肝组织和癌组织用于后续实验。
1.6 肝癌组织CD133+细胞培养 将C组和D组新鲜的肝癌组织用1× Hank′s液洗涤后剪碎,加入4 ml 0.5% dispase酶4℃消化过夜,离心弃上清后再加入0.25%胰蛋白酶37℃消化15 min,离心过筛网,收集沉淀,用10% DMEM培养3 d传代继续培养。参照1.4方法分选CD133+肝癌细胞并培养。
1.7 CD133+肝癌细胞体外增殖实验 CD133+肝癌细胞按1×103个/孔接种于96孔培养板,37℃、5% CO2条件培养24 h后进行CCK8检测,每孔加入10 μl CCK8试剂,37℃、5% CO2条件孵育4 h,用酶标仪检测在450 nm处的吸光值OD。
1.8 CD133+肝癌细胞侵袭和迁移实验 将Matrigel胶平铺于小室24孔板上,室温下孵育1 h,待胶凝固后出现白色层使用。Transwell板中的下室加入10% 胎牛血清DMEM培养液。将生长为对数期的CD133+肝癌细胞胰酶消化后,无血清培养液清洗、重悬后,调为5×105个/ml浓度,在上室内进行接种,每孔中加入200 μl 细胞稀释液(1×105个细胞),37℃、5% CO2条件培养16 h后,显微镜下观察拍照,计数进入下室的细胞数量。
1.9 肝脏和肝癌组织CD133、PTEN、AKT及Oatp2b1 mRNA水平检测 采用荧光定量Real Time PCR方法检测,基因库查找目的基因mRNA序列,在CDS区设计引物,引物序列见表1。逆转录反应条件为:37℃ 15 min,98℃ 5 min,10℃。荧光定量PCR反应条件为:95℃ 30 s,然后95℃ 5 s、62℃ 30 s、72℃ 1 min,40循环,然后95℃ 15 s,55℃ 1 min,95℃ 15 s。采用2-ΔΔCt法计算目的基因相对表达量。

表1 引物序列
1.10 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料采用方差分析,计数资料采用χ2检验。P<0.05时,差异具有统计学意义。
2 结果
2.1 各组小鼠体重和肿瘤体积观察 D组和C组由于肿瘤的生长而体重较A、B组增大。与C组相比,D组小鼠的体重和肿瘤体积明显增大(P<0.01)。见图1。

图1 肿瘤体积和小鼠体重比较 (与C组比较,*P<0.01)
2.2 CD133+肝癌细胞体外增殖能力观察 癌组织分离出CD133+细胞进行体外增殖,3 d后D组CD133+肝癌细胞OD值明显高于C组,说明脾虚肝癌组小鼠癌组织分选出的CD133+肝癌细胞增殖更快(P<0.05,P<0.01)。见图2。
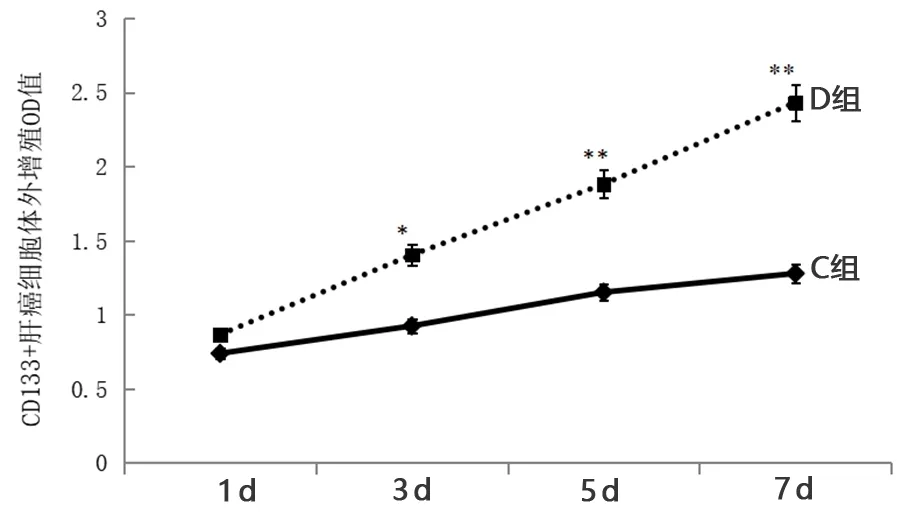
图2 两组CD133+肝癌细胞体外增殖能力比较(与C组比较,*P<0.05,**P<0.01)
2.3 CD133+肝癌细胞迁移和侵袭能力观察 迁移和侵袭实验中,小室内D组小鼠CD133+肝癌细胞数明显高于C组,即脾虚肝癌组CD133+肝癌细胞迁移和侵袭能力明显强于肝癌组(P<0.05)。见图3。
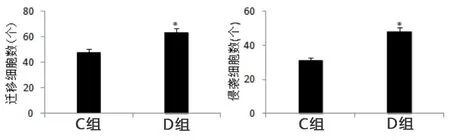
图3 两组CD133+肝癌细胞迁移和侵袭能力比较(与C组比较,*P<0.05)
2.4 各组肝脏和癌组织中Oatp2b1、CD133、PTEN和AKT mRNA表达情况 与A组相比,Oatp2b1 mRNA在B组、C组和D组肝组织以及D组癌组织中表达升高(P<0.01);与C组相比,D组肝组织中Oatp2b1 mRNA表达明显降低,而癌组织中则表达明显升高(P<0.01)。见图4。在癌组织中,与C组相比,D组CD133 mRNA表达明显升高(P<0.01),PTEN mRNA表达降低(P<0.05),而AKT mRNA的表达也明显升高(P<0.01),见图5。

图4 Oatp2b1 mRNA在各组肝组织和癌组织中的比较(与A组比较,*P<0.01;与C组比较,#P<0.01)

图5 CD133、PTEN和AKT mRNA在癌组织中的比较(与C组比较,*P<0.05,**P<0.01)
3 讨论
肝癌的死亡率位居全球肿瘤第3位,目前通过早发现早治疗,肝癌患者生存期显著延长,但肿瘤复发和转移是导致肝癌患者死亡的重要原因,目前研究证实肝癌复发和转移后5年死亡率高达70%以上,迫切需要更加完善的理论认识和治疗手段[10]。研究表明机体内环境变化与癌基因、抑癌基因、黏附因子、免疫调节等因素密切相关,除了受遗传影响,大部分肿瘤是机体内外环境因素和遗传因素共同作用的结果,机体内环境发生有利于肿瘤细胞生长的变化在肿瘤发病机制中起着极其重要的作用[11]。著名中医肿瘤专家于尔辛提出“肝癌的本是脾虚”的学术观点,并证实以脾为主辨证治疗,可以改善荷瘤机体整体状况,形成不利于肝癌生长的内环境,通过改善“患癌的土壤”而预防转移、复发[12]。我们前期研究发现脾虚小鼠Oatp2b1表达发生变化,且脾虚内环境促进小鼠肝癌的生长,但其具体机制尚不明确。
本研究采用利血平皮下注射法构建脾虚小鼠模型,小鼠出现精神疲倦、形体消瘦、食欲下降、大便稀溏等症状,说明脾虚模型建模成功[7]。在脾虚基础上,建立小鼠原位移植肝癌模型,结果发现脾虚肝癌小鼠肿瘤体积明显大于非脾虚肝癌小鼠,脾虚肝癌小鼠的体重也随着肿瘤的增大而明显增加,神疲、食欲下降等症状也较肝癌组明显。由此可见脾虚内环境有利于小鼠肝癌生长和发展。
Oatp2b1是人和动物体内重要的膜转运蛋白,在有机阴离子的转运中起着重要作用,介导内、外源物质的跨膜转运,对保持机体和细胞内外环境的稳态平衡起重要作用,Oatp2b1功能失调,将引起“湿浊”的吸收、分布和排泄障碍而导致疾病的发生[3]。我们前期研究Oatp2b1可能是脾虚湿浊内环境下肝癌发生和发展的“因湿致瘀”的物质基础之一,其在各组织中的表达异常导致湿邪不能正常外排瘀阻于肝,从而促进肝癌发生和发展[2, 4]。在本研究中,脾虚状态下湿浊转运障碍,机体发生代偿反应,故脾虚小鼠肝组织Oatp2b1 mRNA的表达高于空白组。在肝癌造模成功后,脾虚肝癌组肝组织Oatp2b1 mRNA表达低于非脾虚肝癌小鼠肝组织,提示脾虚内环境下肝组织Oatp2b1功能下调,机体内湿浊等毒素排泄障碍。我们还观察到肝癌组癌组织Oatp2b1 mRNA表达低于肝组织;而脾虚肝癌组癌组织中,Oatp2b1 mRNA表达则高于肝组织,且明显高于非脾虚肝癌小鼠癌组织。此结果表明脾虚内环境中,癌组织Oatp2b1 mRNA表达发生代偿性反应而升高,在非脾虚肝癌小鼠体内则没有出现该现象。以上结果提示机体脾虚内环境中Oatp2b1发生了变化,这种变化可能是导致脾虚有利于肝癌发生的重要原因。
越来越多的研究证实,肝癌CSCs自我更新、分化和增殖是肝癌发生和恶化的根源[13]。CSCs隐藏在肿瘤中,不易被识别和清除,是通过细胞表面标志物的表达来识别的,而CD133是肝癌CSCs的生物标志物之一[14]。肿瘤微环境是CSCs生长的“土壤”,微环境是受机体内环境影响的,机体受到内环境影响产生不同的肿瘤微环境,引发CSCs相关信号通路和表面分子标志物改变,导致CSCs与非CSCs之间存在动态的相互转换,机体内环境改变可能导致CSCs的增加[15]。靖林林等[16]研究发现肿瘤微环境的免疫抑制和能量代谢障碍在病机上以脾虚为主,肿瘤微环境对肿瘤细胞进行了重新编程,是癌毒转化的关键因素,并赋予CSCs分化潜能和干性,CSCs是至虚之处的毒根深藏。本研究结果显示,脾虚肝癌组癌组织CD133+肝癌细胞体外增殖、迁移和侵袭能力明显高于肝癌组,提示脾虚内环境变化促进了肝癌CSCs干性能力的发挥。
研究证实CD133+肝癌细胞具有高度致瘤性,在肝癌的生长、复发和转移中起重要作用,被认为是难以从根源上清除肝癌细胞的重要原因[17]。我们对癌组织中的CD133 mRNA进行了检测,结果显示脾虚肝癌小鼠癌组织CD133 mRNA表达明显高于非脾虚肝癌小鼠,提示脾虚内环境有利于CD133+肝癌细胞生长。
磷酸酶及第10号染色体缺失的张力蛋白同源区(PTEN)是机体内一个重要的抑癌基因,在干细胞的自我更新、基因组的稳定性方面起着重要作用,PTEN的异常表达与肿瘤侵袭和不良预后密切相关。AKT通路负责由磷脂酰肌醇-3羟基激酶始动的生物信息的传导,其活化可促进肿瘤细胞生长、增殖和血管生成,促进侵袭和转移。PTEN通过下调磷脂酰肌醇依赖性激酶AKT的活化来实现其抑癌作用,PTEN/AKT信号通路失衡在维持CSCs的干性方面发挥重要作用[18]。本研究结果显示,与肝癌组相比,脾虚肝癌组小鼠癌组织PTEN mRNA表达降低,而AKT mRNA表达则明显升高,提示脾虚内环境中抑癌基因PTEN表达被下调,PTEN/AKT信号通路失衡,导致AKT活化,此现象可能是脾虚内环境中CD133+肝癌细胞生长及其干性能力增强的原因之一。
综上所述,本研究提示脾虚内环境有利于肝癌发生和发展,可能与脾虚湿浊转运障碍的内环境中PTEN/AKT信号通路失衡促进肝癌细胞干性能力发挥有关,脾虚内环境可能是肝癌干细胞生长的有利土壤。但仍需进一步探讨其他肝癌干细胞标志物的表达情况,而脾虚内环境变化Oatp2b1表达异常是否参与调控PTEN/AKT信号通路仍需进一步研究。
