干燥工艺对马蹄大黄产地加工效果的影响
2021-06-29薛淑静王少华
卢 琪,薛淑静,杨 德,王少华,刘 益,李 露*
(1. 湖北省农业科学院农产品加工与核农技术研究所,武汉 430064;2. 长江大学生命科学学院,荆州 434023)
大黄为蓼科植物,是一味常用大宗药材,历代本草均有收载,富含蒽醌、蒽酮、萘苷类、酰基糖苷类、茋类及鞣质等活性成分,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄的功效,广泛用于医药中间体提取、中药饮片生产、中成药生产和保健品生产,市场领域十分广阔[1-4]。恩施州所产大黄,其基源为药用大黄,因加工的大黄药材产品形如马蹄,又称马蹄大黄,是恩施州的特色道地药材。马蹄大黄适宜在海拔1 300 m 左右的地区生长,生长采收周期为3 年,具有药效稳定、产量高等特点,是恩施州高山乡镇实施产业扶贫和实现稳定脱贫的好产业。
中药历来注重来源及产地加工方法,不同种类、不同产地加工方法,其质量差异较大[5]。大黄常采用炕干法进行干燥,此外还有烘干、晾干、晒干等[6]。研究表明,炕干方法不仅时间长达7 d 以上,产品质量难以把控、极易造成大黄品质下降[7]。大黄主根较粗大,不易干燥,熏干、晾干、晒干过程缓慢,可能造成大黄干燥过程中霉变、走油、色泽和气味的裂变等,导致大黄干燥效率低、品质不均一等[8]。此外,大黄中含有丰富的活性成分,如鞣质类、二蒽酮类、游离蒽醌类及结合蒽醌类,通过提高干燥温度或减小切片厚度,能定向加工出清热泻火型大黄,即最大程度保留结合型蒽醌[9]。谭鹏等[10]将大黄定制成5 mm 的薄片,45 ℃连续干燥8 h,能够保留游离蒽醌总量和番泻苷A、B 的含量,而另有研究表明大黄在50 ℃条件下干燥不利于番泻苷A的累积[11]。上述研究尚缺少对大黄产地加工效率和加工品质的统一考察。
为确保马蹄大黄道地药材质量,实现马蹄大黄的规范、高效加工,获得品质优良、性状均一的加工产品,探讨研究马蹄大黄产地加工工艺迫在眉睫。本研究在探讨干燥效率的基础上,对比各干燥条件下马蹄大黄的成分含量和抗氧化性能,以期建立马蹄大黄高效、优质的产地加工工艺。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 马蹄大黄于2019 年12 月采收于湖北省恩施州利川市,品种鉴定为药用大黄(Rheum officinaleBaill.),选取三年生的马蹄大黄为研究对象。
色谱级标准品(决明柯酮、芦荟大黄素、大黄素、大黄酸、大黄酚和大黄甲醚)及分析试剂(Folin-Ciocalteu 试剂、抗坏血酸、2, 2-二苯基-1-苦基肼基(DPPH)、1, 3, 5 - 三(2-吡啶基)-2, 4, 6 - 三嗪(TPTZ)均购于源叶生物科技有限公司。ABTS·+试剂盒购于上海碧云天生物技术有限公司。其他常规分析纯化学品购于国药化学试剂有限公司。
1.1.2 仪器与设备 酶标仪(Multiskan GO),美国Thermo Fisher 公司;热风干燥机(DHG-9140),上海一恒科学仪器有限公司;超声波清洗仪(KQ5200DE),昆山市超声仪器有限公司;超高效液相色谱仪(Waters Acquity),美国Waters 公司;液相色谱柱(UPLC BEH C18,100 mm × 2.1 mm, i d.,1.7 μm),美国Waters 公司;色差仪(CR-400),日本Minolta Camera 公司。
1.2 方法
1.2.1 大黄干燥工艺 新鲜的马蹄大黄洗净、晾干。按照市场要求,将马蹄大黄鲜样切分至4~5 cm 左右的厚度,进行干燥:(1)连续干燥,50、55、60、65、70、75 和80 ℃,热风干燥;(2)结合传统发汗工艺进行马蹄大黄干燥。大黄干燥过程中发汗一次,时长12~24 h[6],然而发汗中后期大黄质量无进一步的减少,影响干燥效率。本研究在结合干燥效率和传统干燥模式的前提下,采用间歇式的干燥模式,即干燥4 h 后间歇2 h(模拟发汗),如此往复,直至马蹄大黄含水量少于15%[12],干燥温度设置为:60、65、70、75 和80 ℃。
1.2.2 成分检测 参考中国药典2015 版的要求[12]对马蹄大黄蒽醌类成分进行提取。大黄干燥后粉碎(过4 号筛),称取0.15 g,加入甲醇25 mL,加热回流1 h,冷却,补足体积,过滤,得到甲醇提取液。取甲醇提取液5 mL,挥发去溶剂,加8%盐酸溶液10 mL,超声处理2 min,再加三氯甲烷10 mL,加热回流1 h,冷却后置于分液漏斗中分液,取三氯甲烷层,酸液再用三氯甲烷提取3 次,合并,减压蒸干,残渣用甲醇复溶后过滤,得到酸解萃取液。将甲醇提取液和酸解萃取液分别进行UPLC-Q-TOF-MSn 分析。流动相(A)蒸馏水/甲酸(0.1%,V/V);(B)甲醇。洗脱程序:0 min,85%A;5 min,65%A;15 min,45%A;27 min,15%A;29 min,85%A;32 min,85%A;流速0.3 mL·min-1,UV-Vis 采集范围210~600 nm,检测波长为254 nm。质谱条件:负离子模式,离子源源温度120 ℃;锥气流,50 L·h-1; 去溶剂温度,450 ℃;脱溶剂气流,800 L·h-1。样品锥电压和毛细管电压分别为30 V 和2 500 V。
1.2.3 水分干燥速率 用105 ℃干烘箱燥大黄至恒重,检测大黄水分含量。大黄水分干燥速率按照不同干燥时间大黄重量变化程度计算[13-14],公式如下:
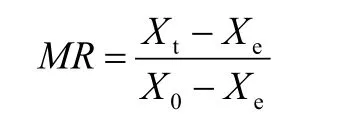
X0,大黄初始重量;Xt,干燥一定时间大黄重量;Xe,大黄干燥绝对重量。
1.2.4 总酚与总黄酮 采用Folin-Ciocalteu 方法计算大黄中总酚含量,结果用每克干大黄中没食子酸当量表示(mg·g-1)。采用NaNO2-AlCl3-NaOH 方法计算大黄中总黄酮含量,结果用每克干大黄中芦丁当量表示(mg·g-1)。
1.2.5 抗氧化能力分析 DPPH 自由基清除能力[15-16]:
将65 μmol·L-1的DPPH 乙醇溶液280 μL 与20 μL抗坏血酸标品或大黄粉的甲醇提取液(如1.2.3 所述)混合,置于96 孔板中,放置30 min,酶标仪517 nm 下读数。大黄DPPH 自由基清除能力以每克大黄粉中毫摩尔抗坏血酸当量表示(mmol·g-1)。FRAP 铁离子还原能力[15-16]:20 μL 大黄粉的甲醇提取液或抗坏血酸标品与280 μL Ferric-TPTZ 试剂混合,放置30 min,酶标仪593 nm 下读数。FRAP 值表示为每克大黄粉中抗坏血酸当量(mmol·g-1)。ABTS·+自由基清除能力[15-16]:按照试剂盒说明书要求制备ABTS·+工作溶液。10 μL 大黄粉的甲醇提取液或水溶性维生素E(Trolox)标品与200 μL 的ABTS·+工作液混合,放置6 min,酶标仪734 nm 下读数。大黄ABTS·+值以每克大黄粉中trolox 当量表示(μmol·g-1)。
1.2.6 统计分析 每组实验重复3 次,数据结果用平均值±SD 值表示。采用IBM SPSS Statistics 20.0进行数据处理,选择Duncan 分析进行样本单因素方差分析,P< 0.05 为显著性差异。
2 结果与分析
2.1 天麻干燥过程中水分变化速率
50~80 ℃条件下连续热风干燥马蹄大黄,使其水分含量满足药典要求,需要48~96 h,干燥过程中马蹄大黄水分含量变化速率如图1 所示。高温干燥虽然能耗大,但能够促进水分散失,提高干燥效率[17]。唐古特大黄,切片(3 cm)后干燥,45~85 ℃条件下需要19~56 h[2],远小于本研究的干燥时间,可能与不同大黄品种的个体大小有关。本研究的马蹄大黄个大、饱满,单个重约2 000 g,切片的重量约250 g,干燥难度较大。60~80 ℃条件下模拟发汗处理,间歇干燥马蹄大黄,干燥时间需要60~96 h。 间歇干燥过程中马蹄大黄水分含量变化速率如图2 所示。相比连续干燥,相同温度下间断干燥耗时较长,但能充分利用余热,有利于水分由内而外的散出,所以间歇干燥能耗少,节能环保。传统大黄发汗工艺,即干燥中途发汗一次,时长12~24 h[6],颇为耗时,不符合马蹄大黄的高效干燥工艺的要求。本研究采用间歇干燥法的同时兼顾发汗工艺,有利于大黄干燥效率的提高。
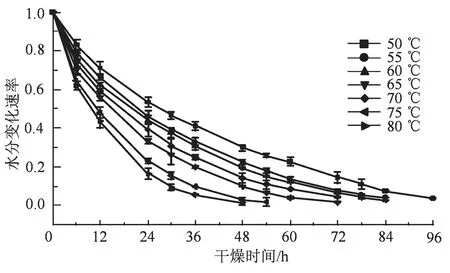
图1 不同温度连续干燥过程中马蹄大黄的水分变化速率Figure 1 The changes of moisture rates in horseshoe shaped Rheum officinale Baill. during continuous drying at different temperature
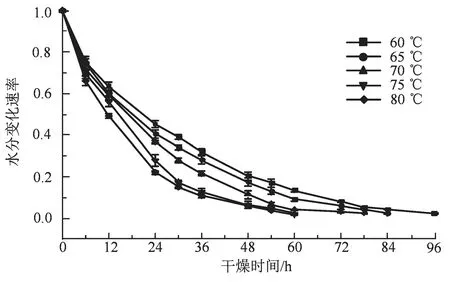
图2 不同温度间断干燥过程中马蹄大黄的水分变化速率Figure 2 The changes of moisture rates in horseshoe shaped Rheum officinale Baill. during intermittent drying at different temperature
2.2 马蹄大黄蒽醌类成分推断及定量分析
马蹄大黄甲醇提取物、酸解产物及5 种标准品的液相色谱图如图3 所示。按照液相出峰的紫外吸收光谱、出峰顺序以及质谱离子碎片信息,结合前人的文献报道,对马蹄大黄提取成分逐一进行定性分析[18-20],结果如表1 所示。峰10~14 对应5 种标准品,分别是芦荟大黄素、大黄酸、大黄素、大黄酚和大黄甲醚。峰10 的分子离子峰为m/z 269.1[M-H]-,峰1 的分子离子峰为m/z 431.1[M-H]-,两者相差162,即峰1 中存在葡萄糖基。芦荟大黄素-8-O-葡萄糖苷在大黄中存在量大,能够分离制备[18],推测峰1 为芦荟大黄素-8-O-葡萄糖苷。根据质谱信息和紫外吸收图谱,峰2 为番泻苷,峰3 为决明柯酮-8-O-葡萄糖苷[21]。峰6 的分子离子峰m/z 449.1[M-H]-,比峰3(m/z 407.1[M-H]-)多42,推测峰6 比峰3 多一个乙酰基,为决明柯酮-8-O-乙酰基葡萄糖苷。按同样的推断方式,结合液相出峰顺序,峰4、5、7、8 和9 分别为大黄酚-1-O-葡萄糖苷、大黄酚-8-O-葡萄糖苷、大黄酚-8-O-乙酰基葡萄糖苷、大黄甲醚-8-O-葡萄糖苷和大黄甲醚-8-O-乙酰基葡萄糖苷[19-20]。 按照药典要求,大黄经甲醇提取后进行盐酸水解,可将化合物中的糖苷键打开,使糖基游离出来,形成对应的苷元[15]。 如图3 所示,经酸解后,峰1 芦荟大黄素-8-O-葡萄糖苷消失,其对应的苷元芦荟大黄素(峰10)明显增加;峰4、5 和7 消失,三者对应的苷元大黄酚明显增加(峰13);峰8 和9 消失,二者对应的苷元大黄素甲醚明显增加(峰14)。大黄素和大黄酚(峰11 和12)在甲醇提取液中含量微弱,且未发现对应的糖苷,但在酸解液峰11 和12 均有所增加,推测大黄素和大黄酚可能以聚合体或多种微量糖苷的形式存在。 酸解可以简化成分,方便计算,但操作繁琐,且不能全面反应成分组成,故本研究对大黄甲醇提取液直接进行分析。糖苷化合物采用其对应苷元的标品进行相对定量,即峰1 采用芦荟大黄素标曲定量,峰4、5 和7 采用大黄酚标曲定量,峰8 和9 采用大黄素甲醚标曲定量,其他3 种成分,峰2、3 和6 均采用紫外吸收光谱接近的大黄素标曲定量。
马蹄大黄甲醇提取液中共鉴定得到的14 种成分,其中蒽醌类成分13 种,蒽醌类成分含量占总成分的85.31%~95.65%,各干燥条件下的成分含量如表2 所示。采用70 和80 ℃连续烘干得到总蒽醌类化学成分总和最高,而60 ℃间接干燥蒽醌类总含量最低。分析对比糖苷类成分及其对应的苷元,如芦荟大黄素-8-O-葡萄糖苷与芦荟大黄素;大黄酚-1-O-葡萄糖苷、大黄酚-8-O-葡萄糖苷、大黄酚-8-O-乙酰基葡萄糖苷与大黄酚;大黄甲醚-8-O-葡萄糖苷、大黄甲醚-8-O-乙酰基葡萄糖苷与大黄甲醚,得到如下规律:(1)连续干燥和间歇干燥,随着的温度苷元类成分(芦荟大黄素、大黄酚与大黄甲醚)逐渐减少,而与苷元对应的各类糖苷则呈增加趋势,说明随着烘干时间的延长,糖苷类化合物逐渐水解,形成其对应的苷元[6];(2)大黄酚及其葡萄糖苷是马蹄大黄中主要的蒽醌类化合物;(3)间歇干燥,即模拟发汗干燥,相比同温度的连续干燥,延长了干燥时间,更加剧了糖苷类蒽醌物质的水解,且总蒽醌类成分的含量并未因模拟发汗处理得到改善。
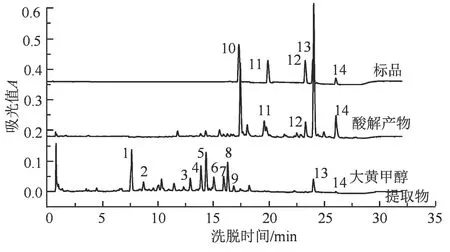
图3 马蹄大黄甲醇提取物、酸解产物及5 种标品的液相色谱图Figure 3 Liquid chromatograms of methanol extracts, acidolysis products and five commercial standards of horseshoe shaped Rheum officinale Baill.
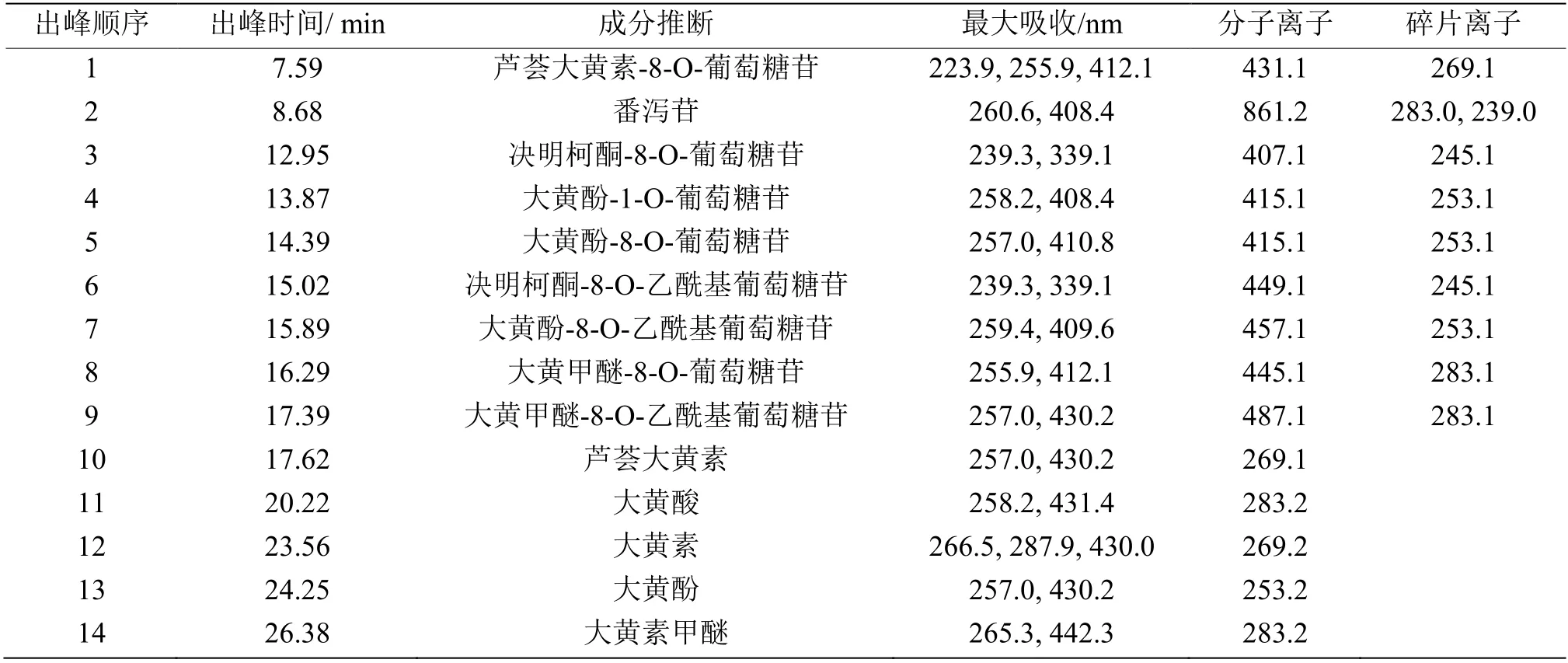
表1 UPLC-Q-TOF-ESI-MSn 推断马蹄大黄提取成分Table 1 The identification of chemical compounds extracted form horseshoe shaped Rheum officinale Baill. by UPLC-Q-TOF-ESI-MSn

表2 马蹄大黄甲醇提取蒽醌类化学成分的定量分析Table 2 Quantitative analysis of the anthraquinones of methanol extract of horseshoe shaped Rheum officinale Baill. μg·g-1
2.3 马蹄大黄总酚、总黄酮及抗氧化能力分析
各干燥条件下马蹄大黄甲醇提取液的总酚、总黄酮含量及抗氧化能力(DPPH、FRAP、ABTS)对比如表3 所示。通过相关性分析,发现总酚和总黄酮之间具有良好的相关性(相关系数,r2= 0.787),而总酚、总黄酮与总蒽醌类成分的相关性较差。本研究中马蹄大黄甲醇提取物中除蒽醌类物质外,马蹄大黄提取液中存在其他的酚类或黄酮类成分。前人研究表明,大黄药材中存在没食子酸、儿茶素、表儿茶素、表儿茶素没食子酸酯、白藜芦醇葡萄糖苷等其他酚类化合物,其中儿茶素是主要成分[22-23]。相同温度下,连续干燥马蹄大黄的各抗氧化能力要优于间歇干燥,可能与糖苷键的水解有关,糖苷键对酚类成分抗氧化性能尤为重要[24]。对比抗氧化能力,80 ℃连续干燥的马蹄大黄具有最强的DPPH、ABTS 自由基清除能力,50 ℃连续干燥的马蹄大黄具有最优的铁离子还原能力,但整组实验的铁离子清除能力无显著差异。

表3 不同干燥条件下马蹄大黄总酚、总黄酮及抗氧化能力对比Table 3 Comparison of total phenolic content, total flavonoid content and antioxidant capacity of horseshoe shaped Rheum officinale Baill. under different drying conditions
3 讨论与结论
恩施利川的马蹄大黄饱满、粗壮,难以干燥,干燥速率是制约其产地加工的重要因素。本研究按市场对马蹄大黄原料的要求,将其切成厚片(4~5 cm),进行连续热风干燥和间歇热风干燥(模拟发汗工艺)。研究结果表明,马蹄大黄中有14 种活性成分,包含11 种蒽醌类成分,马蹄大黄中的蒽醌类成分多以糖苷的形式存在,与前人的研究基本一致[25]。提高干燥温度或减小切片厚度,能减少大黄加热时间,最大程度保留结合型蒽醌,从而定向加工出清热泻火型大黄[9]。本研究发现干燥过程中蒽醌类成分的糖苷键逐渐水解,形成游离的苷元,干燥速率越慢,糖苷水解越严重。糖苷键对酚类成分抗氧化性能尤为重要,这一水解过程可能影响后续大黄提取成分的抗氧化能力。
各干燥条件下,80 ℃连续干燥,马蹄大黄蒽醌类成分总量最多,60 ℃间歇干燥蒽醌类成分总量最少。相同温度下,间歇干燥充分利用余热,干燥马蹄大黄能耗小于连续干燥,但连续干燥的蒽醌成分含量、抗氧化性能均要优于间歇干燥。80 ℃连续干燥马蹄大黄,干燥速率快,总蒽醌、总酚、总黄酮含量高,抗氧化能力强,最适于马蹄大黄的干燥。本文仅针对2019 年11 月采收的三年生大黄进行研究,不同成熟期和采收时间的马蹄大黄的干燥工艺需要进一步研究、验证。
