同羊ETAA1 基因InDel 检测及其与生长性状的关联分析
2021-06-29唐晓琴陈平博袁婷婷赵海东刘世荣孙秀柱
唐晓琴,陈平博,袁婷婷,赵海东,刘世荣,张 宇,孙秀柱
(1. 西北农林科技大学动物科技学院,杨凌 712100;2. 西北农林科技大学草业与草原学院,杨凌 712100)
近年来,随着人们膳食结构的改变,肉质细嫩,可御风寒、补气血的羊肉渐渐受到了消费者的青睐。其中同羊作为陕西省优质肉羊品种,市场需求量也在逐年增加[1]。但由于同羊群体数量少,优质同羊肉供不应求,且同羊个体间表型差异较大,因此需要对其生长性状进行科学系统的选育,以提高整个品种的生产优势[2-3]。利用分子标记辅助育种技术来进行同羊的选育,对同羊品种的发展及遗传资源多样性的保护具有重要的意义。
肿瘤相关抗原1(Ewing tumor associated antigen 1,ETAA1)是一种与人的脂肪分布相关的重要基因[4]。Ma 等人的研究表明ETAA1基因可能与绵羊尾部脂肪发育有关[5]。Wang 等的研究发现该基因在肥尾和短尾绵羊脂肪组织中也有差异表达[6]。ETAA1是ATR 激酶激活物,ATR 激酶是一种DNA修复的关键蛋白,在感受到DNA 损伤的迹象后ATR激酶就会活化细胞的修复系统。ETAA1可以通过调节ATR 维持基因组稳定性[7-13]。Mills 等的研究表明,较小的InDel 变异可能是人类遗传特征和疾病的关键因素[14],因此推测ETAA1基因中的InDel 也可能通过影响基因组稳定性等对绵羊的生长发育产生影响。本试验以同羊为研究对象,检测基因ETAA1中潜在的InDel 位点,并对其与同羊的生长性状进行关联分析,筛选影响同羊生长发育的分子标记,为同羊肉用性状的选育提供理论基础。
1 材料与方法
1.1 试验材料及样品采样
本试验以陕西白水同羊原种场中166 只无任何亲缘关系的同羊为研究对象,使用真空采血管对同羊进行颈静脉采血,使其与EDTA 充分混合后将血样置于-80 ℃的环境中保存以便长期使用。对采集血液的同羊进行体尺性状的测量并记录,包括体高、体长、荐高、背高、臀端高、胸深、胸宽、腰角宽、臀端宽、头长、头深和管围等。此外,对脂尾的长度和宽度以及周长测量并记录。
1.2 血液DNA 的提取和均质化
1.2.1 血液DNA 的提取 使用全血基因组DNA 快速提取试剂盒(北京艾德莱生物科技有限公司)提取同羊血样DNA,试验步骤参照试剂盒说明书进行。
1.2.2 血液DNA 数量和质量检测及均质化 使用Nanodrop 2000 检测DNA 浓度,所有同羊样品DNA的浓度均大于50 ng·μL-1,OD260/280均在1.8 左右,OD260/230均在2.0 以上,记录测定结果。将每个DNA原液抽取30 μL 用双蒸水均质化到50 ng·μL-1,编号并记录。
1.3 引物设计及PCR
登录 Ensembl 数据库(http:// asia.ensembl.org/index.html),在绵羊基因组中找到基因ETAA1潜在的大于6 bp 的 InDel 位点,查找并下载该InDel 位点前后300~500 bp 的序列。根据 InDel位点前后300~500 bp 的序列,使用Primer Premier Software(5.0)设计相应的引物,并使用NCBI Primer Blast (https://www.ncbi.nlm.nih. gov/tools/primer-blast/)验证引物特异性。ETAA1基因的特异性引物信息见表1。

表1 引物信息Table 1 Primer information
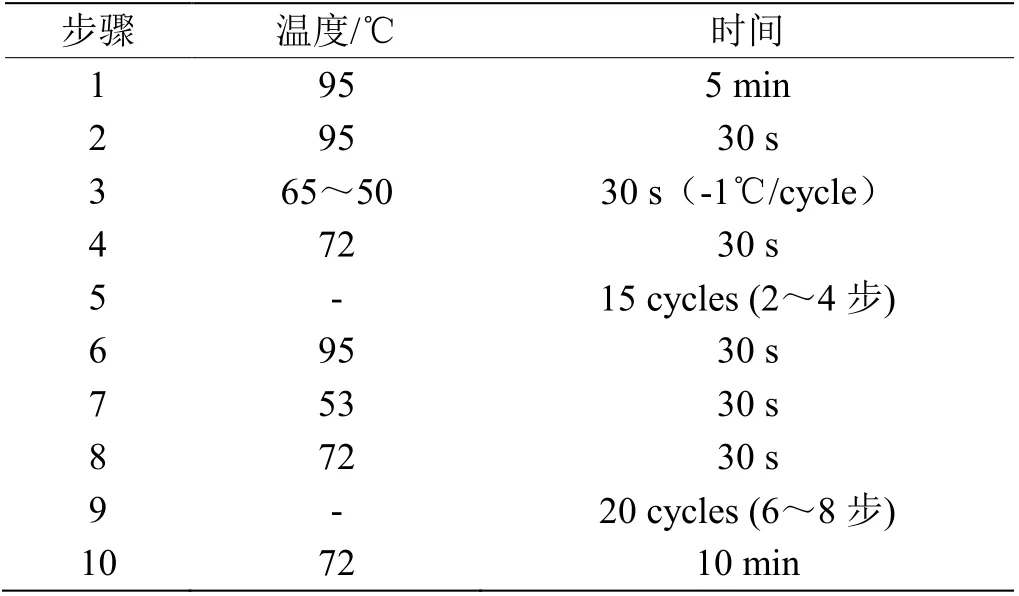
表2 TD-PCR 程序Table 2 Touch Down-PCR program
将同羊DNA 稀释到工作浓度,从已稀释的DNA 样中随机挑选24 个样品构建混池。并以此作为模板进行PCR 和琼脂糖凝胶电泳。qPCR 扩增体系(25 μL):2× Taq Master Mix 12.5 μL,DNA 模板1 μL,上、下游引物各1 μL,ddH2O 9.5 μL。PCR程序见表2。将经过PCR 扩增后的产物利用2.5%~3%浓度的琼脂糖凝胶电泳进行结果分型(120 V,60 min)。记录分型结果。得到分型结果后,3 种基因型各随机挑选10 个样本的PCR 产物送至上海生工进行测序,验证琼脂糖凝胶电泳分型结果的准确性。
1.4 数据统计
统计同羊ETAA1基因InDel 的分型结果、生长性状及脂尾性状,利用线性模型来确定基因型与同羊各个生长性状及脂尾之间的关系,基本线性模型如下。
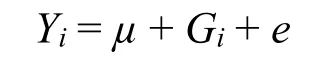
其中Yi为每只同羊的生长性状测量数据,μ为总体均值,Gi为基因型的效应,e为随机误差。使用SPSS 22.0 软件进行单因素方差分析[15],结果用“平均值±标准差”表示;利用在线软件MSR(http://www.msrcall.com/Gdicall.aspx)对变异位点进行基因型统计和哈代温伯格平衡检验;统计ETAA1基因InDel 位点的基因型和等位基因频率分布。
2 结果与分析
2.1 ETAA1 基因InDel 检测
根据NCBI 公布的ETAA1参考基因组设计扩增潜在InDel 位点前后片段的特异性引物,进行PCR和琼脂糖凝胶电泳,结果显示,ETAA1基因的InDel位点存在3 种基因型,分型结果见图1(a),泳道1、2 和5 为213 bp 条带大小的DD 型,泳道4 为225 bp条带大小的II 型,泳道3 为213 bp 和225 bp 条带大小的ID 型;3 种基因型各随机挑选10 个个体的PCR 产物进行测序,验证琼脂糖分型结果准确性,测序结果与琼脂糖分型结果一致,见图1(b)。
对ETAA1基因InDel位点的基因型和等位基因频率进行统计后发现,该InDel 位点中DD 基因型频率为0.500 0,II 基因型频率为0.090 4。DD 基因型为优势基因型。I 和D 的等位基因频率分别为0.295 2 和0.704 8,对群体进行遗传参数估计发现该位点基因纯合度为0.583 9,杂合度为0.416 1,有效等位基因数为1.712 6,多态信息含量为0.329 5,处于中度多态性(0.25<PIC<0.5),同时也处于Hardy-Weinberg 平衡中(P> 0.05)(表3)。
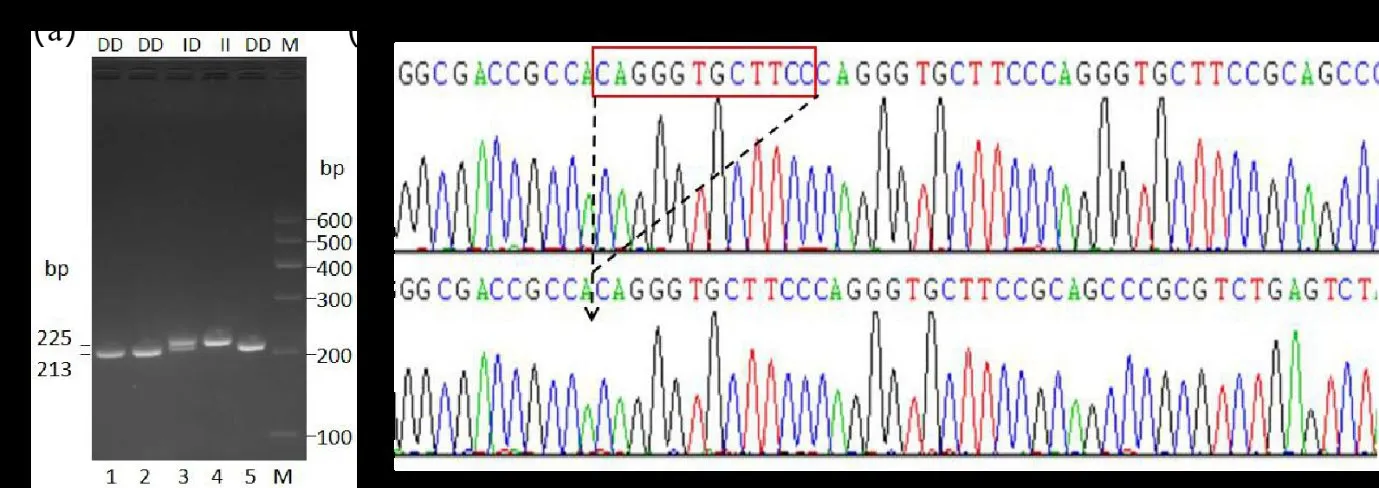
图1 同羊ETAA1 基因InDel 的电泳分型条带(a)和测序结果(b)Figure 1 Electrophoresis typing bands(a) and sequencing results(b) of ETAA1 gene InDel in Tong sheep
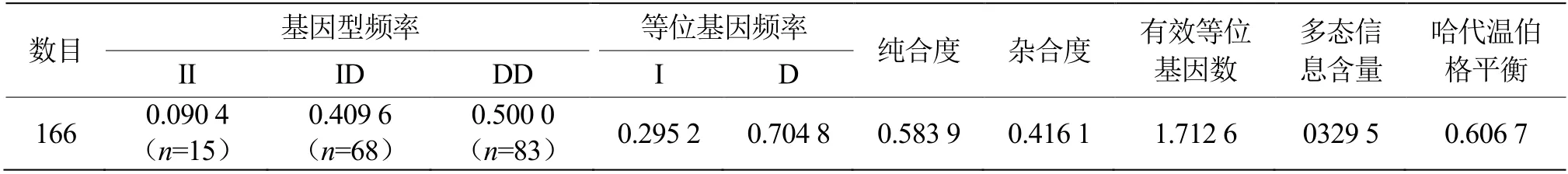
表3 同羊ETAA1 基因InDel 位点遗传多态性Table 3 Genetic polymorphism of InDel of ETAA1 gene in Tong sheep

表4 ETAA1 基因InDel 位点对同羊公羊生长性状及尾脂的影响Table 4 Effect of ETAA1 gene InDel locus on growth traits and tail trait of the Tong sheep ram
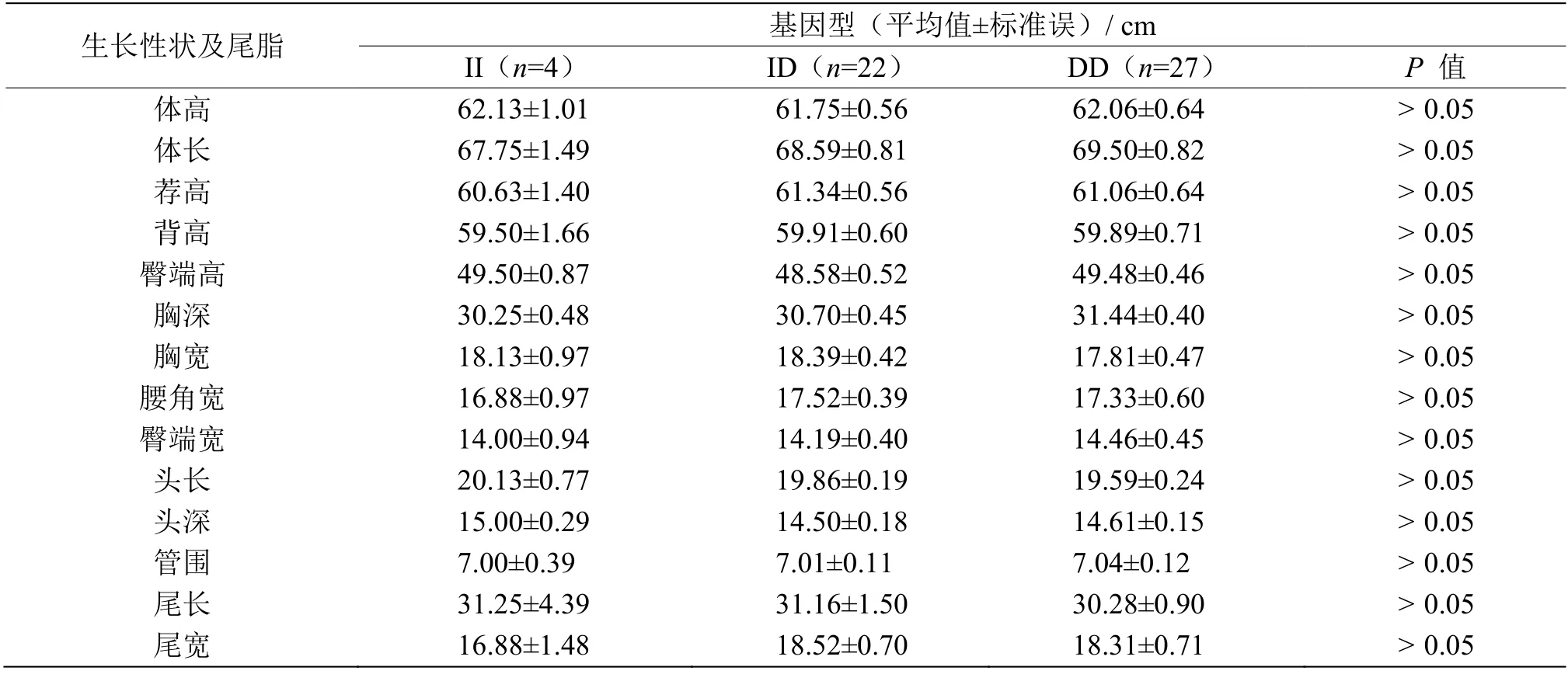
表5 ETAA1 基因InDel 位点对同羊母羊生长性状及尾脂的影响Table 5 Effect of ETAA1 gene InDel locus on growth traits and tail trait of the Tong sheep ewe
2.2 InDel 位点与同羊生长性状关联分析
利用SPSS 22.0 软件将同羊ETAA1基因InDel位点多态性分别与同羊不同性别生长性状及其尾脂进行关联分析,其中生长性状包括体高、体长、荐高、背高、臀端高、胸深、胸宽、腰角宽、臀端宽、头长、头深、管围、尾长和尾宽。结果分析了InDel位点3 种不同基因型对应的不同生长性状及尾脂测量数据之间的差异。结果表明,同羊ETAA1基因的InDel 位点在公羊臀端高这一生长性状上II 基因型显著高于DD 基因型与ID 基因型(P< 0.05),对公羊与母羊尾脂性状无显著影响 (P >0.05)(表4,表5)。
3 讨论与结论
通过对有效等位基因数(Ne)和多态信息含量(PIC)数值的分析,可以检测出目标基因的遗传多样性和遗传潜力。本研究中,同羊有效等位基因数为1.712 6,这表明该基因多态在同羊群体中分布较为不均匀。哈代-温伯格平衡(Hardy-Weinberg)检测发现同羊群体中处于哈代-温伯格平衡之中(P< 0.05),多态信息含量分析发现在同羊群体中该位点 PIC 为0.329 5,介于0.25 和0.5 之间,处于中度多态,说明该基因变异较大,在选育中有较大选择潜力。
InDel 指在同一物种不同个体间相同的DNA 序列上发生的片段插入或者缺失,由于不同个体间存在差异,所以可以作为多态分子标记,具有重复性高,特异性好的特点,InDel 多态性也常常与动物的生长发育有关[16-18]。ETAA1是在肿瘤细胞或正常细胞上存在的抗原分子,常用于临床肿瘤的诊断。正常细胞可微量合成,而在肿瘤细胞增殖时高度表达。ETAA1作为ATR 激酶激活剂,通过激活ATR 来控制细胞周期进程,DNA 损伤时进行DNA 修复和凋亡[19-20]。Miosge 等研究发现ETAA1突变的小鼠在接种疫苗后会产生具有缺陷的效应T 细胞反应[21]。Osiński 等通过全基因组关联分析发现ETAA1基因rs4141819 SNP 与不孕症相关[22]。Yu 等发现ETAA1基因位点突变与遗传性非息肉性大肠癌相关[23]。Childs 等发现ETAA1基因rs1486134 SNP 与胰腺癌有着显著相关性[24]。基于上述研究,可以得知ETAA1可能和DNA 修复、细胞周期控制,胚胎发育等生理过程以及肿瘤细胞的增殖转移有密切关系,据此推测ETAA1基因可能会通过影响细胞生命活动从而影响家畜的生长发育。现在已经有大量研究证明基因多态性与家畜的生长性状有着密切的联系,闫海龙等的研究发现陕北白绒山羊GHR基因的InDel 显著影响了山羊的生长性状[25]。杨华等发现猪的IGFBP2基因第2 内含子上的SNP 位点与猪的背膘厚、眼肌高、眼肌宽和骨率等性状呈极显著相关[26]。陶萨茹拉等的研究表明绵羊BMP15基因第一外显子的B2、B4 位点多态性与绵羊繁殖性状有关[27]。高晔等发现陕北白绒山羊中β-catenin基因的一个InDel 的位点与陕北白绒山羊胸深显著相关[28]。Zhang 等发现肉牛SIRT4基因的InDel 对生长性状有着显著影响[29]。以上这些研究都表明了基因多态性可能会对家畜的生长性状产生影响。本研究在基因ETAA1中筛选出了一个位于内含子区域的插入12 bp 的InDel 突变,并对该InDel 位点多态性与同羊的生长性状及其尾脂性状进行了分析。该位点尽管存在于非编码区,但研究内含子对于编码序列和蛋白质的调控都有重要的作用。有研究发现内含子通过与DNA、RNA 或蛋白质相互作用参与RNA 的生成与加工、转录调控和染色质重塑等过程,进而在细胞增殖、分化和机体正常发育过程以及疾病的发生发展中发挥重要作用[30]。研究结果显示该InDel 位点多态性对同羊尾脂性状并无显著影响,而InDel 位点不同基因型与公羊臀端高性状显著相关(P< 0.05),且该位点II 基因型的公羊臀端高显著高于ID 和DD 基因型(P< 0.05),表明II基因型对同羊公羊的臀端高具有一定的正向调节作用。因此,该InDel 位点可以作为同羊生长性状的有效分子标记,为今后更好地开展同羊分子育种研究提供参考。
本研究在ETAA1中检测到一个InDel 多态性位点,该InDel 位点与同羊公羊生长性状臀端高显著相关(P <0.05),II 基因型的臀端高显著高于ID 和DD基因型。因此该位点可以作为同羊生长性状的候选分子标记,为同羊的育种提供了一定的理论基础。
