果蝇F-box基因Ppa促进脂肪储存
2021-06-28杨光武田嫄
杨光武,田嫄
果蝇F-box基因促进脂肪储存
杨光武,田嫄
贵州大学生命科学学院,贵阳 550025
脂质是构成生物体的重要成分之一,脂质代谢的精确调节和稳态维持对人类健康至关重要。泛素化途径通过降解脂质相关蛋白来调控脂质代谢。()编码一种F-box蛋白,后者是SCF (Skp1-Cullin1-F-box)泛素化复合体成员之一。已有的研究表明在调控果蝇体节的正常发育和着丝粒组蛋白的正确定位方面发挥重要的作用,但在脂肪代谢方面的功能研究却未见报道。本研究以黑腹果蝇()作为研究对象,探究了在脂肪储存中的功能。通过与绿色荧光蛋白融合表达,检测PPA的亚细胞定位;应用CRISPR/Cas9技术,构建的缺失突变体;通过BODIPY 493/503或Nile red脂滴染色,对缺失突变体和超量表达果蝇的脂滴形态改变进行分析。随后,在缺失突变体中超量表达以验证其功能。结果表明,PPA-GFP融合蛋白定位于唾液腺和脂肪体的细胞核中。与对照组果蝇相比,缺失突变体表现为脂滴变小;超量表达显示出脂滴变大。在突变体中超量表达能够将脂滴回复至正常状态。综上所述,本研究揭示了在果蝇中具有促进脂肪储存的功能。
脂肪储存;脂滴;CRISPR/Cas9;
脂质代谢紊乱与肥胖、高血压、糖尿病等代谢综合征息息相关[1]。脂滴(lipid droplets, LDs)是由单层磷脂、中性核心脂质和相关蛋白组成的细胞器,大多数动物的中性脂质都储存在脂滴中[2]。脂滴在许多方面都发挥着重要的生物学功能:首先,它是细胞内脂肪酸转运的重要位点,脂肪酸含量高的高脂细胞能够通过脂滴向相临的低脂细胞转运脂肪酸[3];其次,它是特定病毒的组装平台,肝细胞中的脂滴为极低密度脂蛋白的产生提供脂质基础,而丙肝病毒能够侵入极低密度脂蛋白分泌途径并附着在其表面,促进丙肝病毒以低密度脂病毒颗粒的形式释放[4];在神经调节方面,遗传性痉挛性截瘫相关基因的敲除小鼠表现出运动协调和认知能力的缺陷,并且在神经元中显示出大量的异位脂肪累积[5]。脂滴的大小受到核心脂质含量、单层磷脂组成和促进脂滴融合相关蛋白的影响[6,7]。大脂滴的形成有两种机制,一种是脂滴的生长和膨胀,通常是通过将中性脂质添加到脂滴核心来实现,另一种是由较小脂滴融合形成,但融合活性很低[8]。
真核生物中广泛存在一类叫做F-box的蛋白家族[9]。F-box蛋白家族的N端具有特征性的F-box结构域,负责与其他蛋白结合形成SCF复合体,该复合体是一类E3泛素化连接酶,其C端具有底物识别结构域[10]。F-box蛋白与结合蛋白Skp1、骨架蛋白Cullin1和RING-finger蛋白Rbx1共同组成SCF复合体。该复合体招募携带泛素分子的E2结合酶并识别底物蛋白,参与选择性降解生物活性蛋白质的泛素–蛋白酶体途径(ubiquitin proteasome pathway, UPP),在细胞凋亡、细胞周期调控、信号转导和免疫应激等方面发挥重要作用[11,12]。研究表明,UPP介导多个脂滴相关蛋白的降解,例如,PLIN1是位于脂滴表面的特征性结合蛋白,能够抑制脂质降解,在小鼠的3T3-L1脂肪细胞中,PLIN1与选择性自噬受体SQSTM1相互作用,并通过与泛素化蛋白特异性结合来降解PLIN1[13,14]。
是果蝇中继后第二个被发现的编码F-box蛋白的基因[15]。研究表明,在早期胚胎发育过程中发挥作用。在体内与由编码的Eve共同作用,抑制转录激活因子Prd(由编码,),调控包括()在内的体节极性基因的表达。在正常表达的细胞中,mRNA被Eve抑制,确保了Prd被激活,从而激活下游靶基因的表达;而在不表达的细胞中,mRNA紧挨Prd,并将Prd条带降解,抑制下游靶基因的表达[16,17]。此外,在着丝粒的稳定性维持方面也发挥重要作用,着丝粒组蛋白CID决定着丝粒的特性和功能,超量表达会使得该蛋白错误定位于染色体的非着丝粒区域,导致异位着丝粒的产生,从而引发染色体的错误分离[18]。介导的泛素化途径能够降解错误定位的CID,使该蛋白重新定位于着丝粒[19]。本研究通过蛋白定位、突变体分析和基因挽救实验,发现可以促进果蝇中的脂肪储存。
1 材料与方法
1.1 果蝇品系
实验中所用到的果蝇均在玉米面培养基中饲养,严格按照实验规章制度操作,果蝇来源及用途见表1。
1.2 果蝇组织染色
将3龄幼虫在1×PBS缓冲液中解剖,获得脂肪体和唾液腺。将组织放入4%多聚甲醛中固定30 min后,用1×PBS清洗2次,每次5 min。使用脂滴染料BODIPY 493/503或者Nile red避光染色30 min,使用细胞核染料DAPI避光染色10 min,使用细胞骨架染料Phalloidin 594避光染色30 min。用1×PBS清洗3次,每次5 min。在载玻片上滴加30 μL的70%甘油,将染色完毕的样品转移至载玻片上,盖玻片压片,最后用指甲油封片,将制作完成的片子在激光共聚焦显微镜上扫描成像。
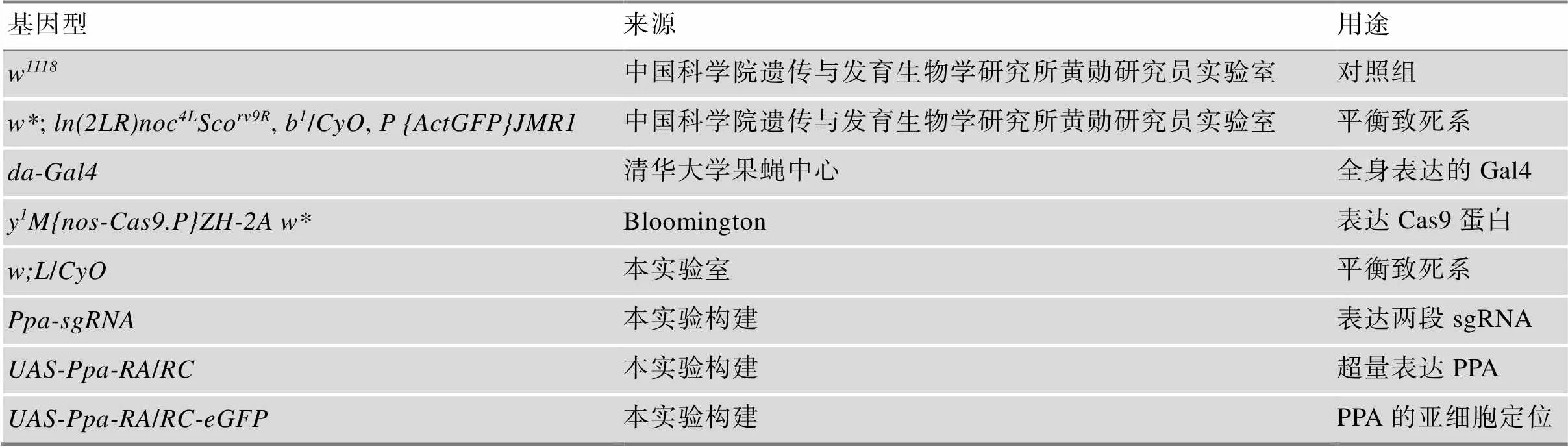
表1 本研究中所用的果蝇品系
1.3 PPA的亚细胞定位分析
通过在/编码区的C端添加表达绿色荧光蛋白的GFP序列,构建得到转基因果蝇/。29℃下,利用驱动/的全身表达,解剖3龄幼虫的唾液腺和脂肪体,使用DAPI和Phalloidin 594染色标记细胞核和细胞骨架,激光共聚焦显微镜下扫描成像。
1.4 sgRNA表达载体的构建
通过网站www.flyrnai.org/crispr2设计两段sgRNA序列,其位于的CDS区的第78~97 nt和第518~538 nt,并在引物前添加I酶切位点。将设计好的sgRNA序列在Flybase上进行序列比对,确保在基因组中没有其他配对区域。sgRNA及检测引物序列见表2。
根据设计的sgRNA序列合成单链寡核苷酸片段,经过退火形成两端有粘性突出末端的双链片段。用T4连接酶将sgRNA1和sgRNA2的退火片段分别连接到I酶切后的线性化载体pMD18T-U63- BsmB1上。经过转化实验,筛选得到两个连接成功的质粒,pMD18T-U63--sgRNA1和pMD18T-U63--sgRNA2。通过PCR扩增给U63--sgRNA1和U63--sgRNA2添加接头序列。利用Golden-gate连接将两段由U63启动子驱动的sgRNA连接到中间载体PCR/TOPO/GW-I-Bb。最后将组装好的质粒通过LR反应重组连接,得到pUAST-attB--sgRNAs表达载体。

表2 本研究中所用的引物序列
1.5 突变体鉴定与脂滴表型分析
将构建的pUAST-attB--sgRNA质粒送至珠海联合华益公司进行显微注射,得到转基因果蝇。将与表达Cas9蛋白的果蝇杂交,后代中得到同时表达Cas9蛋白与sgRNA的果蝇。使用-chk-F和-chk-R进行Founder的PCR鉴定,通过杂交得到纯合的突变果蝇,并通过PCR扩增和DNA测序比对确定突变位点。具体的杂交策略如图1所示。
研究选取了两株突变体Ppa和Ppa以及两者的杂交后代Ppa/Ppa进行分析,解剖获得3龄幼虫的脂肪体,使用DAPI和BODIPY 493/503标记细胞核和脂滴,激光共聚焦显微镜下扫描成像。通过Image-Pro Plus 6.0软件对特定面积内(143 μm×143 μm)的不同直径脂滴进行数量统计,对照组与实验组各选取3个样本进行统计。通过GraphPad Prism 8软件进行统计学分析并绘制统计图。
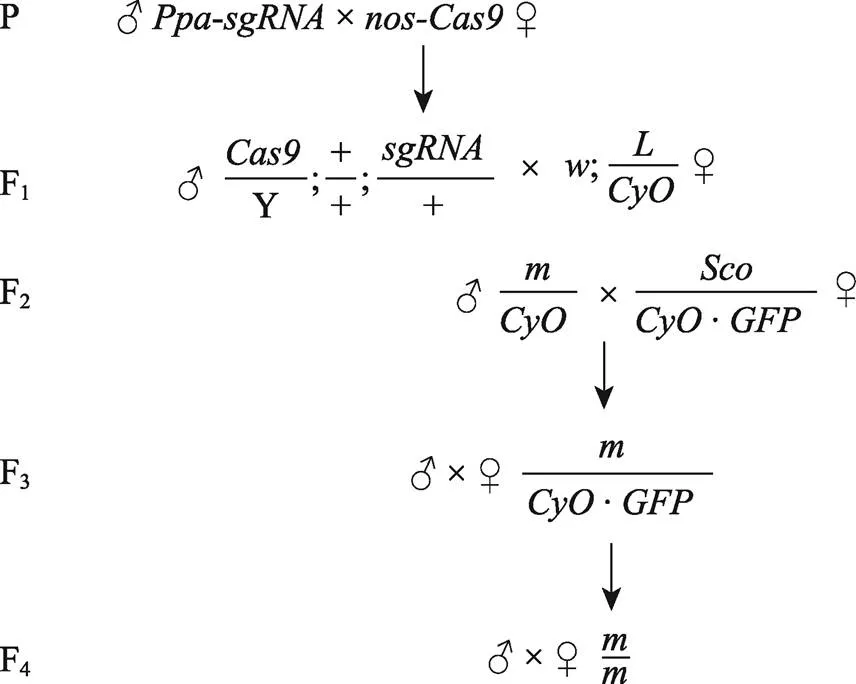
图1 利用CRISPR/Cas9技术的基因敲除杂交策略
1.6 超量表达Ppa的脂滴表型分析
T-A克隆/的编码区,通过RⅠ和Ⅰ连接至pUAST-attB,获得了转基因果蝇/。29℃下,利用驱动/的全身表达,解剖3龄幼虫的脂肪体,使用DAPI和Nile red染色标记细胞核和脂滴,激光共聚焦显微镜下扫描成像。通过Image-Pro Plus 6.0软件对特定面积内(143 μm×143 μm)的不同直径脂滴进行数量统计,对照组与实验组各选取3个样本进行统计。通过GraphPad Prism 8软件进行统计学分析并绘制统计图。
1.7 基因挽救实验
通过遗传操作,构建得到Ppa;da>UAS-Ppa- RA/的果蝇。29℃下,在突变体Ppa中利用驱动/的全身表达,解剖3龄幼虫的脂肪体,使用DAPI和BODIPY 493/503染色标记细胞核和脂滴,激光共聚焦显微镜扫描成像。
2 结果与分析
2.1 PPA融合荧光蛋白定位于细胞核
在前期工作中,发现超量表达能够增强果蝇唾液腺的异位脂肪累积。本研究首先通过与绿色荧光蛋白融合表达,对PPA的定位进行分析。经查Flybase得知,基因具有3个转录本,其中RA和RC具有相同的编码区,RA与RB的mRNA序列一致,且RB的编码区在RA/RC的基础上越过了一个终止密码子UGA。本研究克隆了/的编码区,构建了融合蛋白表达载体并得到转基因果蝇/。通过驱动/的全身表达,发现PPA-PA/PC在3龄幼虫唾液腺的细胞核中检测出强烈的荧光信号(图2A),并在3龄幼虫脂肪体的细胞核中检测出较弱的荧光信号(图2B),表明可能参与脂质代谢。
2.2 Ppa缺失突变体的获得与脂滴表型分析
为了进一步探究对脂肪代谢的影响,本研究利用CRISPR/Cas9技术构建基因缺失突变体。首先,构建了attB--sgRNA表达载体,通过显微注射得到表达sgRNA的转基因果蝇。将与表达Cas9蛋白的果蝇杂交,对进行基因敲除。通过对杂交后代的遗传筛选和PCR鉴定,得到了两株纯合可活的缺失突变体Ppa和Ppa,具体策略详见材料与方法。随后对突变体进行测序鉴定,发现Ppa缺失了445 bp,Ppa缺失了446 bp,如图3所示,缺失的片段位于编码区的前端。
通过BODIPY对3龄幼虫脂肪体中的脂滴进行染色标记,发现与对照组w相比,突变体Ppa和Ppa中的脂滴明显减小(图4:A~C)。在对照组中观察到直径较大的大脂滴,但在突变体中则表现为小脂滴的增加。由于CRISPR/Cas9技术具有潜在的脱靶效应,故本研究对两个片段缺失等位基因的反式杂合突变体Ppa/Ppa的脂滴进行了分析,以消除遗传背景上的其他未知突变对表型的影响,研究发现Ppa/Ppa的脂滴较对照组明显减小,小脂滴数量明显增多(图4D)。随后对特定面积内不同直径的脂滴进行统计,发现不同直径的脂滴所占的比例具有显著差异。与对照组相比,突变体表现出10 μm以上大脂滴减少(图4F)。为了进一步验证突变体中脂滴减小的表型,随后在突变体Ppa中超量表达,发现脂滴较突变体明显增大,但较对照组无显著差异(图4:E和F),说明能够回复突变体中脂滴减小的表型,并且提示的缺失是导致脂滴减小的原因,也进一步揭示了参与脂肪储存的调控。

图2 PPA-GFP在3龄幼虫中的亚细胞定位
使用驱动/的全身表达。A:唾液腺的GFP信号;a:唾液腺的细胞核染色;aʹ:唾液腺的细胞骨架染色;aʺ:唾液腺的荧光信号合并图。B:脂肪体的GFP信号;b:脂肪体的细胞核染色;bʹ:脂肪体的细胞骨架染色;bʺ:脂肪体的荧光信号合并图。DAPI (蓝色):细胞核染色;GFP (绿色):PPA-GFP的融合荧光蛋白;Phalloidin (红色):细胞骨架染色;Salivary gland:唾液腺;Fat body:脂肪体。标尺:25 μm。
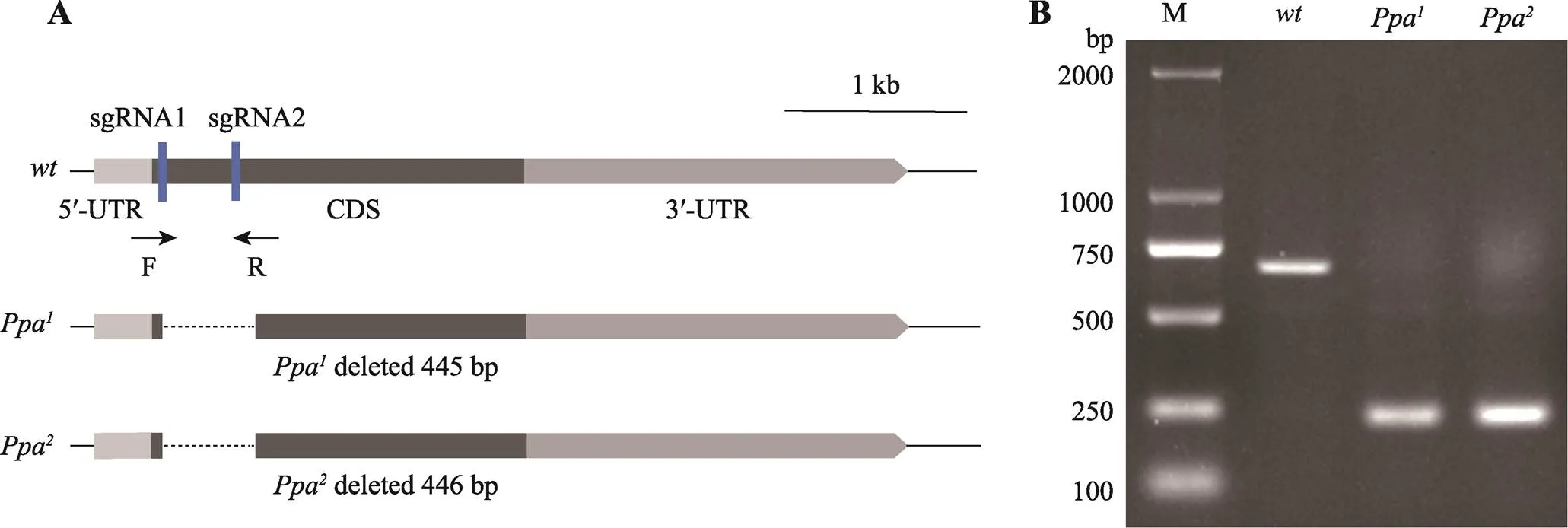
图3 突变体中的缺失区域示意图与PCR扩增凝胶电泳图
A:突变体缺失区域示意图。只有一个外显子,蓝色方框表示sgRNA位点,虚线表示缺失片段。B:突变体的PCR扩增结果(使用检测引物-chk-F和-chk-R进行鉴定)。M:2 kb DNA marker;:对照组(w);Ppa和Ppa:片段缺失等位基因。
2.3 超量表达Ppa增强脂滴储存的能力
为了进一步验证在脂肪储存中的作用,本研究检测了超量表达对脂滴的影响。使用Nile red对3龄幼虫脂肪体中的脂滴进行染色标记,发现与对照组相比,超量表达/导致脂滴直径明显增加,表现为大脂滴的数量显著增多(图5:A和B)。针对脂滴大小的差异,统计了特定面积内不同直径脂滴的分布比例,与对照组相比,超量表达/表现出直径10 μm以上的大脂滴比例明显增加,而1~5 μm的小脂滴比例明显减少(图5C),表明超量表达能够导致脂肪体中小脂滴减少和大脂滴增加。
综上所述,本研究通过亚细胞定位分析,发现定位于唾液腺与脂肪体的细胞核中;通过缺失突变体的脂滴形态分析,发现脂滴较对照组表现为直径变小;通过超量表达,发现脂肪体中的脂滴较对照组表现为直径增加,并且突变体中超量表达能够将突变体的脂滴减小表型回复至野生型状态。以上结果表明具有促进脂肪储存的作用。
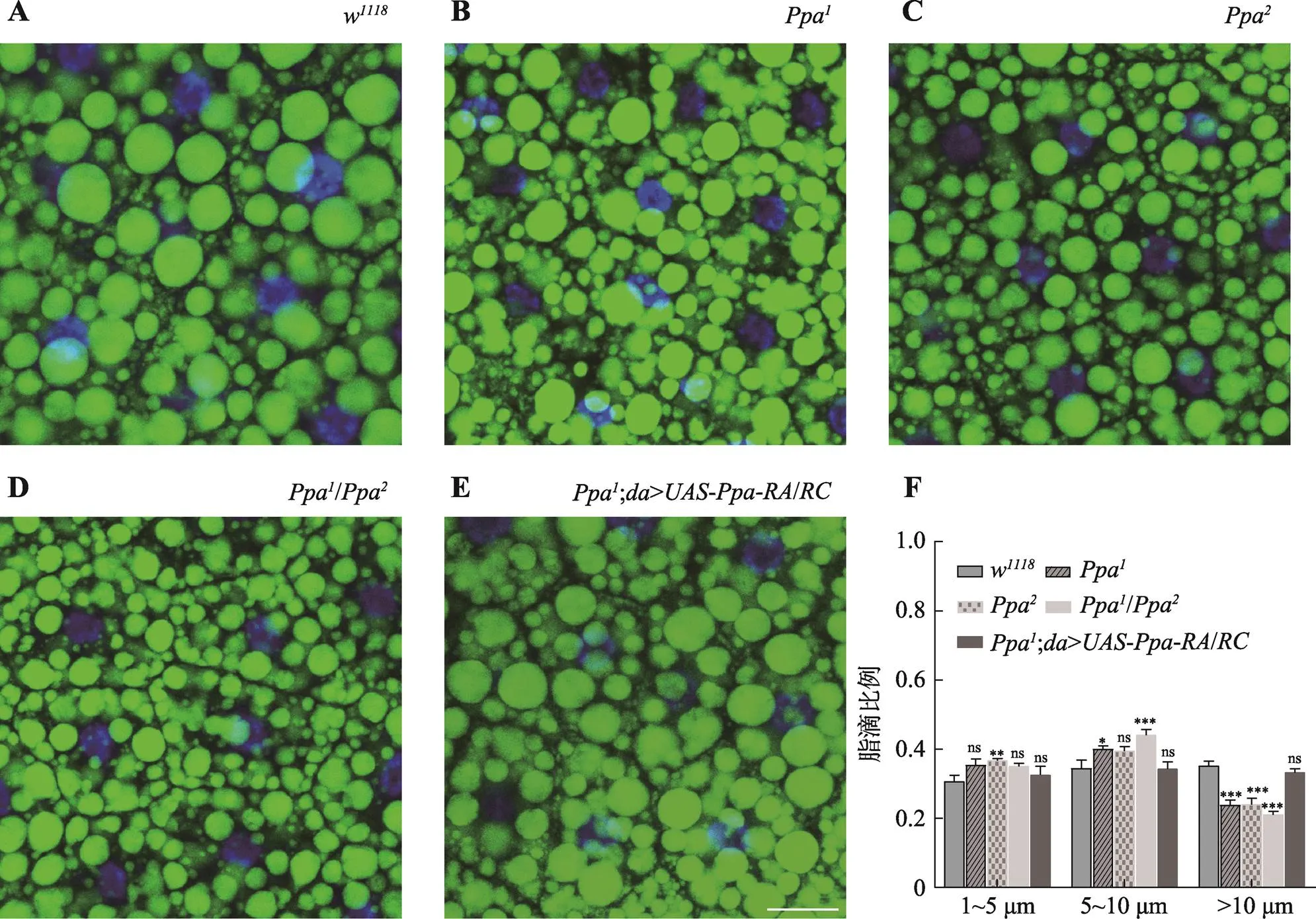
图4 Ppa缺失突变体在3龄幼虫中的脂滴直径变小
A~E:3龄幼虫的脂滴染色图。w:对照组;Ppa和Ppa:片段缺失等位基因;Ppa/Ppa:两个等位基因的反式突变体;Ppa;/:突变体中超量表达;BODIPY (绿色):脂滴染色;DAPI (蓝色):细胞核染色。F:特定面积内(143 μm× 143 μm)不同直径脂滴的分布比例统计图。X轴是脂滴直径(μm),Y轴为特定面积内不同直径的脂滴所占的比例。1~5 μm:直径1~5 μm的脂滴;5~10 μm:直径5~10 μm的脂滴;>10 μm:直径10 μm以上的脂滴。ns:>0.05;*:<0.05;**:<0.01;***:<0.001。标尺:25 μm。

图5 超量表达Ppa导致3龄幼虫中的脂滴大小增加
A、B:29℃下,和/的3龄幼虫的脂滴染色图。Nile red (红色):脂滴染色;DAPI (蓝色):细胞核染色。C:特定面积内(143 μm×143 μm)不同直径脂滴的分布比例统计图。X轴是脂滴直径(μm),Y轴为特定面积内不同直径的脂滴所占的比例。1~5 μm:直径1~5 μm的脂滴;5~10 μm:直径5~10 μm的脂滴;>10 μm:直径10 μm以上的脂滴。*:<0.05;***:<0.001。标尺:25 μm。
3 讨论
在小鼠()中,F-box基因家族成员的缺失引发了高血糖和胰岛素抵抗;同时,在小鼠肝脏中超量表达不仅能够显著抑制高脂喂养引发的胰岛素抵抗,而且可以降低肥胖小鼠的高血糖[20,21];人体细胞周期素依赖性激酶抑制蛋白(CDKIs)成员p27的缺失导致脂肪细胞数量的增加,F-box蛋白S期激酶Skp2能够识别p27并对其进行降解;并且在的基因敲除小鼠中,皮下细胞和内脏的脂肪细胞数量下降了50%,表明Skp2具有促进脂肪的作用[22]。在本研究中,选取了F-box家族成员PPA作为研究对象,发现片段缺失突变体表现为小脂滴增多,而超量表达导致大脂滴增加,并且突变体中超量表达能够回复突变体脂滴减小的表型,这与的作用是相似的表明了F-box家族蛋白确实参与了脂质代谢调控。
一般而言,F-box蛋白通过泛素-蛋白酶体途径介导靶蛋白的降解,目前已报道的靶蛋白包括转录因子Prd和着丝粒组蛋白CID,它们调控着体节发育和着丝粒定位[17,19],但未见报道与脂肪相关的靶蛋白。已有的研究表明,在HeLa细胞中敲除E3泛素连接酶编码基因导致脂滴丰度增加,MARCHF6的泛素化底物包括Perilipin2 (PLIN2)、胆固醇转运蛋白NPC1和胆固醇合成限速酶LDM,这些蛋白直接参与脂滴组成或胆固醇合成[23,24]。此外,泛素–蛋白酶体途径参与调控脂质代谢通路的多个关键酶。在小鼠肝脏中,脂肪甘油三酯脂酶ATGL是一种主要的甘油三酯分解酶,能够将甘油三酯分解成游离脂肪酸。研究表明,E3泛素连接酶COP1靶向降解ATGL,敲除小鼠的脂滴数量显著减少,而超量表达引发小鼠脂滴数量的增加,表明COP1的功能是抑制脂肪分解[25]。此外,在奶牛乳腺上皮细胞中抑制蛋白酶体活性后,乙酰辅酶A羧化酶ACC的mRNA表达量显著下调,但脂肪酸合成酶FASN的mRNA表达量显著上调,说明泛素蛋白酶体途径能够调控脂肪酸合成[26]。作为SCF泛素化复合体的组分,具有富亮氨酸重复序列,该结构域能够识别底物蛋白,推测其底物蛋白可能与脂质合成或者脂滴结构形成相关。也有研究报道,F-box蛋白可以与其他蛋白结合形成复合体发挥作用,在酿酒酵母中,F-box蛋白Ctf13与Skp1、Cep3形成核心,这个由3种蛋白组成的核心与Ndc10结合,形成着丝粒复合体CBF3,该复合体对动粒的组装至关重要[9,27]。本研究发现具有促进脂肪储存的功能,而其下游的调控网络还有待进一步研究。
致谢:
感谢中国科学院遗传与发育生物学研究所黄勋研究员提供的果蝇工具株和表达载体;感谢广州霍夫曼免疫研究所焦仁杰教授和四川大学华西医院陈海洋教授提供的sgRNA载体构建和基因敲除方案。
[1] Fahy E, Cotter D, Sud M, Subramaniam S. Lipid classification, structures and tools., 2011, 1118 (11): 637–647.
[2] Welte MA, Gould AP. Lipid droplet functions beyond energy storage., 2017, 1862(10 Pt B): 1260–1272.
[3] Welte MA. Expanding roles for lipid droplets., 2015, 25(11): R470–R481.
[4] Filipe A, Mclauchlan J. Hepatitis C virus and lipid droplets: finding a niche., 2015, 21(1): 34–42.
[5] Inloes JM, Hsu KL, Dix MM, Viader A, Masuda K, Takei T, Wood MR, Cravatt BF. The hereditary spastic paraplegia-related enzyme DDHD2 is a principal brain triglyceride lipase., 2014, 111(41): 14924–14929.
[6] Xu X, Park JG, So JS, Lee AH. Transcriptional activation of Fsp27 by the liver-enriched transcription factor CREBH promotes lipid droplet growth and hepatic steatosis., 2015, 61(3): 857–869.
[7] Wilfling F, Wang HJ, Haas JT, Krahmer N, Gould TJ, Uchida A, Cheng JX, Graham M, Christiano R, Fröhlich F, Liu XR, Buhman KK, Coleman RA, Bewersdorf J, Farese RV, Walther TC. Triacylglycerol synthesis enzymes mediate lipid droplet growth by relocalizing from the ER to lipid droplets., 2013, 24(4): 384–399.
[8] Krahmer N, Guo Y, Wilfling F, Hilger M, Lingrell S, Heger K, Newman HW, Schmidt-supprian M, Vance DE, Mann M, Farese RV, Walther TC. Phosphatidylcholine synthesis for lipid droplet expansion is mediated by localized activation of CTP:phosphocholine cytidylyltransferase., 2011, 14(4): 504–515.
[9] Wang XY, Sun LP, Zhang JF, Li H, Lv WQ, Zhang QQ. F-box proteins and their functions., 2008, 20(5): 807–811.王秀燕, 孙莉萍, 张建锋, 李辉, 吕文清, 张其清. F-box蛋白家族及其功能. 生命科学, 2008, 20(5): 807–811.
[10] Kipreos ET, Pagano M. The F-box protein family., 2000, 1(5): REVIEWS3002.
[11] Chen K, Cheng HH, Zhou RJ. Molecular mechanisms and functions of autophagy and the ubiq-uitin-proteasome pathway., 2012, 34(1): 5–18.陈科, 程汉华, 周荣家. 自噬与泛素化蛋白降解途径的分子机制及其功能. 遗传, 2012, 34(1): 5–18.
[12] Xie CM, Wei WY, Sun Y. Role of SKP1-CUL1-F-box- protein (SCF) E3 ubiquitin ligases in skin cancer., 2013, 40(3): 97–106.
[13] Sohn JH, Lee YK, Han JS, Jeon YG, Kim JI, Choe SS, Kim SJ, Yoo HJ, Kim JB. Perilipin 1 (Plin1) deficiency promotes inflammatory responses in lean adipose tissue through lipid dysregulation., 2018, 293(36): 13974–13988.
[14] Ju LP, Han JF, Zhang XY, Deng YJ, Yan H, Wang CR, Li XH, Chen SQ, Alimujiang M, Li X, Fang QC, Yang Y, Jia WP. Obesity-associated inflammation triggers an autophagy- lysosomal response in adipocytes and causes degradation of perilipin 1., 2019, 10(2): 121.
[15] Dui W, Lu W, Ma J, Jiao RJ. A systematic phenotypic screen of F-box genes through a tissue-specific RNAi- based approach in., 2012, 39(8): 397–413.
[16] Clark E, Akam M. Odd-paired controls frequency doubling insegmentation by altering the pair-rule gene regulatory network., 2016, 5: e18215.
[17] Raj L, Vivekanand P, Das TK, Badam E, Fernandes M, Finley RL, Brent R, Appel LF, Hanes SD, Weir M. Targeted localized degradation of Paired protein indevelopment., 2000, 10(20): 1265–1272.
[18] Heun P, Erhardt S, Blower MD, Weiss S, Skora AD, Karpen GH. Mislocalization of thecentromere- specific histone CID promotes formation of functional ectopic kinetochores., 2006, 10(3): 303–315.
[19] Moreno-moreno O, Medina-giró S, Torras-llort M, Azorín F. The F box protein partner of paired regulates stability ofcentromeric histone H3, CenH3(CID)., 2011, 21(17): 1488–1493.
[20] Zhao JJ, Xiong XL, Li Y, Liu X, Wang T, Zhang H, Jiao Y, Jiang JJ, Zhang HJ, Tang QQ, Gao X, Li XJ, Lu Y, Liu B, Hu C, Li XY. Hepatic F-box protein FBXW7 maintains glucose homeostasis through degradation of fetuin-A., 2018, 67(5): 818–830.
[21] Zhang C, Chen F, Feng L, Shan Q, Zheng GH, Wang YJ, Lu J, Fan SH, Sun CH, Wu DM, Li MQ, Hu B, Wang QQ, Zhang ZF, Zheng YL. FBXW7 suppresses HMGB1- mediated innate immune signaling to attenuate hepatic inflammation and insulin resistance in a mouse model of nonalcoholic fatty liver disease., 2019, 25(1): 29.
[22] Cooke PS, Holsberger DR, Cimafranca MA, Meling DD, Beals CM, Nakayama K, Nakayama KI, Kiyokawa H. The F box protein S phase kinase-associated protein 2 regulates adipose mass and adipocyte number., 2007, 15(6): 1400–1408.
[23] Scott NA, Sharpe LJ, Capell-Hattam IM, Gullo SJ, Luu W, Brown AJ. The E3 ubiquitin ligase MARCHF6 as a metabolic integrator in cholesterol synthesis and beyond., 2021, 1866(1): 158837.
[24] Scott NA, Sharpe LJ, Capell-hattam IM, Gullo SJ, Luu W, Brown AJ. The cholesterol synthesis enzyme lanosterol 14α-demethylase is post-translationally regulated by the E3 ubiquitin ligase MARCH6., 2020, 477(2): 541–555.
[25] Ghosh M, Niyogi S, Bhattacharyya M, Adak M, Nayak DK, Chakrabarti S, Chakrabarti P. Ubiquitin ligase COP1 controls hepatic fat metabolism by targeting ATGL for degradation., 2016, 65(12): 3561–3572.
[26] Liu LL, Guo AW, Li QQ, Wu PF, Yang YJ, Chen FF, Li SH, Guo PJ, Zhang Q. The regulation of ubiquitination in milk fat synthesis in bovine., 2020, 42(6): 548–555.刘莉莉, 郭爱伟, 李青青, 吴培福, 杨亚晋, 陈粉粉, 李素华, 郭盘江, 张勤. 泛素化途径在奶牛乳脂生成过程中的调控作用. 遗传, 2020, 42(6): 548–555.
[27] Leber V, Nans A, Singleton MR. Structural basis for assembly of the CBF3 kinetochore complex., 2018, 37(2): 269–281.
The F-box genepromotes lipid storage in
Guangwu Yang, Yuan Tian
Lipid is one of the important components of living organisms. The precise regulation and homeostasis maintenance of lipid metabolism are essential to human health. The ubiquitination pathway regulates lipid metabolism by degrading lipid-related proteins.encodes an F-box protein, which is a member of the SCF ubiquitination complex. Previous studies reported thatregulated the body segmentation and the correct localization of centromere histones, while its function in lipid metabolism has not been reported. In this study,was used to explore the function ofin lipid storage.The subcellular localization of PPA was detected by fusion with green fluorescent protein. The deletion mutant ofwas constructed via CRISPR/Cas9 technology. The morphological changes of lipid droplets in deletion mutants andoverexpression flies were analyzed by BODIPY 493/503 or Nile red staining.Further,was overexpressed in the deletion mutant to verify its function.The results showed that PPA-GFP fusion protein were localized in the nuclei of salivary gland and fat body. Compared with the control flies, the lipid droplets indeletion mutants became smaller, and overexpression ofexhibited larger lipid droplets. Overexpression ofin the deletion mutant could restore the lipid droplets to normal state. In summary, this study demonstrated thatcould promote lipid storage in.
lipid storage; lipid droplets; CRISPR/Cas9;
2021-03-05;
2021-04-28
国家自然科学基金项目(编号:31600962)和贵州省科学技术基金资助项目(编号:[2017]1043)资助[Supported by the National Natural Science Foundation of China (No. 31600962) and Guizhou Provincial Science and Technology Foundation (No. [2017]1043)]
杨光武,在读硕士研究生,专业方向:发育生物学。E-mail: ygw1996426@163.com
田嫄,博士,副教授,研究方向:果蝇脂肪代谢。E-mail: ytian1@gzu.edu.cn
10.16288/j.yczz.21-084
2021/5/7 14:44:00
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20210507.1031.002.html
(责任编委: 阎言)
