黄土高原雨养区不同种植年限紫花苜蓿土壤真菌群落的分布特征
2021-06-28罗珠珠张耀全牛伊宁李玲玲蔡立群蔡雪梅刘家鹤
马 欣,罗珠珠,张耀全,牛伊宁,李玲玲,蔡立群,蔡雪梅,刘家鹤
(1.甘肃农业大学资源与环境学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;3.延安市农业科学研究所,陕西 延安 716000)
紫花苜蓿(Medicagosativa)有着高产、耐瘠、保土等优良特性,在西部黄土高原地区广泛种植,是当地退耕还林的主要草种[1],亦是粮改饲、发展草牧业的优质牧草,种植苜蓿可促进当地草食畜牧业健康发展[2]。苜蓿根瘤可在根瘤菌的作用下固定游离氮,地上部枯枝落叶可经微生物分解增加土壤有机碳含量,改善土壤质量[3]。土壤微生物是土壤生态系统的重要组成部分,可调节土壤养分转化和系统的稳定性,提高其抗干扰能力[4]。一般情况下,多年生植物通过根系分泌物对土壤微生物的群落结构和分布产生影响,从而改变微生物的丰富度和多样性[5]。紫花苜蓿属于轴根型牧草,根系发达,多年种植紫花苜蓿会导致土壤容重减小、深层水分亏缺,土壤质量及牧草品质逐步退化[6-7],亦会对土壤微生物结构和功能产生影响。
真菌是土壤微生物中数量最多的类群之一[8],可通过参与土壤中碳素转化、物质循环影响腐殖质的形成,稳定土壤结构和理化性质[9],是维持生态系统功能的基础和生态系统健康的指示物[10]。Yang[11]、钱雅丽[12]等对黄土高原半干旱区不同土地利用类型真菌群落的研究发现种植紫花苜蓿有利于土壤真菌的生长和繁殖,从而提高真菌丰富度和多样性,特别是通过影响土壤颗粒机械组成、养分含量、pH,进而影响土壤子囊菌和担子菌等优势菌群的分布格局[13]。研究表明,连作抑制土壤中细菌及固氮菌的生长,促进真菌群落的繁殖,导致土壤由高肥力‘细菌型’向低肥力‘真菌型’转换[14-15]。耿德洲[16]等在宁南黄土高原的研究表明,随着苜蓿种植年限的增加真菌群落多样性降低,群落组成从农田逐渐向天然草地方向演变。麻冬梅[6]在宁南山区的研究表明,不同种植年限苜蓿地土壤微生物群落均以细菌为主,其丰度随苜蓿种植年限的增加而增加,真菌的变化趋势则不明显,数量一直在0.10~0.14万个·g-1范围徘徊;邰继承[17]对内蒙古灰色草甸土的研究发现,种植苜蓿能够有效促进微生物群落的发展,种植5 a的紫花苜蓿土壤细菌数量是种植2 a苜蓿地细菌数量的1.86倍,但真菌数量无明显变化。
目前,研究黄土高原雨养农业区紫花苜蓿的研究多集中在水分利用效率[18-19]、土壤理化性质[20-21]以及温室气体排放[22-23]等方面,对于土壤微生物群落的研究较少。而研究土壤真菌群落结构和多样性可为农田土壤的可持续发展提供理论依据。因此,本研究以农田为对照,通过Illumina MiSeq高通量测序研究黄土高原地区不同种植年限苜蓿土壤真菌群落组成及多样性特征,以探明不同种植年限苜蓿土壤真菌群落演变规律及优势菌属分布特征。研究结果在理论上有助于从分子生物学角度揭示苜蓿种植年限对土壤真菌群落特征的影响,在实践上可为区域苜蓿适宜种植年限的选择提供指导意义。
1 材料与方法
1.1 研究区概况
试验设在甘肃省定西市安定区李家堡镇的甘肃农业大学旱作农业综合试验站(104°44′E,35°28′N)进行,该区属于典型的黄土高原半干旱雨养农业区,平均海拔约为2 000 m,年均太阳辐射592.9 kJ·cm-2,平均日照时数2 476.6 h,年均气温6.4℃,0~10℃积温范围为2 239.1~2 933.5℃,无霜期为141 d,年均降雨量400 mm,年蒸发量1 531 mm,干燥度2.53。土壤类型为黄绵土,土壤容重1.19 g·cm-3,pH 值8.36,土壤有机质12.01 g·kg-1,全氮0.76 g·kg-1,全磷0.79 g·kg-1。
1.2 试验设计
试验以玉米田为对照,2003年(L2003)、2005年(L2005)、2012年(L2012)建植的紫花苜蓿人工草地为研究对象,小区面积均为3 m×7 m=21 m2,随机区组排列,3次重复。苜蓿品种为当地传统品种陇东苜蓿,整个生育期无人为干预,各处理田间管理保持一致,每年刈割两次(6月和10月)。苜蓿人工草地在2003、2005和2012年建植时施纯氮105 kg·hm-2,纯P2O5105 kg·hm-2,之后在苜蓿生长期间未进行施肥、灌水。玉米品种为‘先玉335’,2013年开始种植玉米,持续至今,每年播前人工撒施纯N 200 kg·hm-2,纯P2O5105 kg·hm-2,生育期不再追肥,收获后期玉米根系不还田。
1.3 土样采集
在每个采样小区中,于2018年苜蓿头茬花期按照五点采样法用土钻采集0~30 cm和30~60 cm土层土壤样品,去除样品中的植物根系、石块等杂物混合均匀后过2 mm筛,装入灭菌自封袋,干冰保存,带回实验室置于超低温冰箱中用于土壤真菌群落结构和多样性的测定。
1.4 真菌ITS高通量测序
将用于测定的土样送至上海美吉生物医药科技有限公司进行真菌 ITS 高通量测序,引物如表1所示。从土壤样品中抽提基因组DNA后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA,然后对样品的ITS区进行PCR扩增(ABI GeneAmp® 9700型,Thermo Fisher Scientific,USA),将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司,USA)切胶回收PCR产物,Tris_HCl洗脱, 2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM~ST蓝色荧光定量系统(Promega公司,USA)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合,随后构建Miseq文库,用Illumina平台Miseq 300测序仪测序[24-25]。
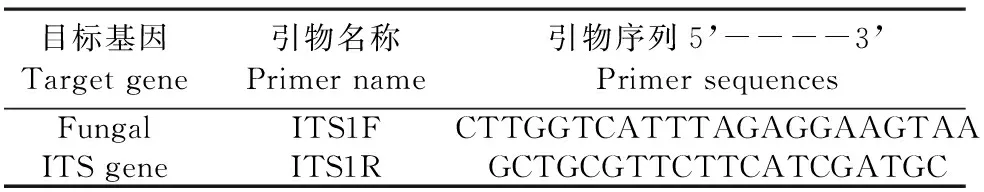
表1 目标基因的引物名称及引物序列
1.5 Alpha多样性指数计算方法
微生物α多样性[26]:
式中,Chao1表示菌群丰度;Sobs为实际观测到的OTU数;n1为只含有一条序列的OTU数目;n2为只含有两条序列的OTU数目。
Simpson和Shannon代表微生物多样性:
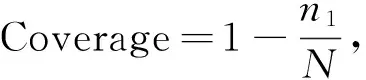
1.6 数据处理
使用Mothur指数分析,基于指数评估的OTU相似水平97%得出土壤真菌Alpha多样性指数(Shannon和Simpson)、菌群丰富度指数(Chao1)。土壤微生物群落结构和多样性指数均采用SPSS 22.0和Excel数据处理软件,差异显著性分析利用单因素方差分析(ANOVA)和多重比较法(Duncan)。维恩图(Venn)通过I-Sanger云平台(美吉公司,上海)进行处理,主成分分析使用Canoco 5,AI软件进行图表修饰。
2 结果与分析
2.1 土壤真菌群落OTU特异性分析
通过对不同种植年限土壤样品中真菌群落Venn图(图1)的比较分析发现,随种植年限增加,耕层0~30 cm苜蓿土壤真菌群落物种数在增加,L2003、L2005、L2012分别获得OTUs 731、746、691个,农田获得OTUs 752个,各处理特有物种分别为108、125、116和216,占各处理物种总数的14.77%、16.76%、16.79%%和28.72%;共有物种OTUs 303个,占物种总数量的10.38%。L2003和L2005共有物种数(506),高于L2003和L2012(468)、L2005和L2012(474)物种共有数。30~60 cm土层中L2003、L2005、L2012和农田分别获得OTUs 678、675、631、697个,共有275个,占物种总数的10.26%;L2003特有OTUs 114个,L2005特有OTUs 139个,L2012特有OTUs 95个,农田特有OTUs 186个。这表明随苜蓿种植年限延长土壤真菌物种数增加,但不同种植年限苜蓿土壤真菌特有物种数均少于农田土壤。
2.2 土壤真菌群落 Alpha多样性
Miseq高通量测序结果优化后共获得389693条有效序列,对所有样品进行抽平得到38560条序列后进行后续分析。由表2看出,样品测序覆盖度均在0.99以上,说明测序数据量合理,基本能真实反映土壤微生物的群落组成。与农田相比,耕层0~30 cm种植苜蓿对Shannon指数无明显影响,但其随着苜蓿种植年限的延长显著增加(P<0.05),表现为L2003和L2005处理显著高于L2012,分别增加18.47%和21.34%。Chao1和Simpson指数在农田和不同种植年限苜蓿间均无显著差异。耕层以下30~60 cm土壤剖面真菌群落的Chao1指数、Shannon指数和Simpson指数随着种植年限的变化呈现出与耕层0~30 cm类似的趋势,但处理间均无显著差异。

表2 不同处理真菌Alpha多样性指数
2.3 门水平土壤真菌群落组成特征
本研究所有供试黄绵土样品中共检测到真菌6门24纲73目156科313属,土壤真菌群落门水平主要包括4个类群(图2),占真菌总数的99%以上,分别为:子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)和unclassified_k__Fungi。黄绵土子囊菌门相对丰度随土层深度增加而降低,接合菌门和担子菌门相对丰度则表现为相反趋势。
与农田相比,耕层0~30 cm苜蓿土壤子囊菌门相对丰度显著增加(P<0.05),且随苜蓿种植年限延长先降低后升高,不同种植年限苜蓿土壤比农田土壤提高17.50%~32.08%。接合菌门、担子菌门和unclassified_k__Fungi相对丰度表现为苜蓿土壤显著低于农田土壤(P<0.05),且随种植年限延长先升高后降低。其中接合菌门相对丰度降低62.36%~73.54%,担子菌门丰度降低60.08%~78.84%,unclassified_k__Fungi相对丰度降低8.16%~55.05%。不同种植年限苜蓿土壤优势门丰度亦存在差异,L2003子囊菌门相对丰度显著高于L2005处理12.42%(P<0.05),接合菌门相对丰度显著低于L2005处理153.54%(P<0.05)。耕层以下30~60 cm真菌优势门群落相对丰度随着苜蓿种植年限的变化呈现出与耕层0~30 cm类似的趋势。农田土壤子囊菌门和担子菌门相对丰度显著高于苜蓿土壤(P<0.05);接合菌门相对丰度表现出农田和L2005处理显著高于L2003和L2012处理(P<0.05);unclassified_k__Fungi相对丰度在农田和不同种植年限苜蓿土壤间无明显差异。
2.4 属水平土壤真菌群落组成特征
土壤真菌在属水平种类繁杂,各个门科下属分类地位不明确的菌属占总序列的10.98%~32.71%,耕层0~30 cm土壤真菌相对丰度>1%的菌属分布见图3。农田土壤前3种优势真菌属分别为被孢霉属(Mortierella,19.63%)、绿僵菌属(Metarhizium,13.67%)和腐质霉属(Humicola,11.63%),且表现为农田土壤显著高于苜蓿土壤(P<0.05),其中被孢霉属相对丰度提高62.38%~73.48%,绿僵菌属丰度提高64.83%~85.55%,腐质霉属丰度提高88.43%~93.53%。苜蓿土壤共有优势真菌属为刺孢属(Phaeomycocentrospora, 10.49%~29.54%)、白僵菌属(Beauveria,10.10%~13.02%)、被孢霉属(5.21%~13.19%)和绿僵菌属(1.98%~4.81%)。随苜蓿种植时间延长,刺孢属、赤霉菌属(Gibberella)相对丰度呈先降低后升高趋势,被孢霉属、Tetracladium属和隐球菌属相对丰度呈相反趋势先升高后降低,白僵菌属、绿僵菌属和Lectera属相对丰度逐渐升高。
30~60 cm土层,农田土壤优势属为被孢霉属(32.45%),相对丰度显著高于苜蓿土壤28.11%~80.75%(P<0.05)(图4)。刺孢属(7.94%~17.95%)和被孢霉属(6.25%~23.33%)为苜蓿土壤共有优势菌属。随苜蓿种植时间延长,刺孢属、被孢霉属和Tetracladium属相对丰度呈先升高后降低趋势,白僵菌属、绿僵菌属、土赤壳属和丛赤壳属(Nectria)相对丰度呈先降低后升高趋势,而镰刀菌属相对丰度显著增加。统计分析表明,L2012刺孢属相对丰度显著低于L2003和L2005(P<0.05),降低45.95%和555.77%;L2012处理白僵菌属和绿僵菌属相对丰度显著高于其余处理(P<0.05),增加84.73%~98.28%和51.22%~92.82%;L2003镰刀菌属相对丰度显著高于L2005和L2012处理54.00%和64.04%(P<0.05)。
2.5 土壤真菌群落结构的主成分分析
主成分分析(图5)表明,不同种植年限苜蓿土壤真菌属在PC1轴和PC2轴上解释度分别为66.90%和17.13%,农田和苜蓿草地土壤真菌群落显著分开。农田土壤真菌群落主要分布在第一、四象限,苜蓿土壤真菌群落主要分布在第二、三象限。载荷因子反映真菌属水平丰度与所提取主成分之间的相关性,载荷因子绝对值越高,表示该真菌属对主成分的影响越大[27]。表3结果表明,丛赤壳属、土赤壳属和镰刀菌属与第一主成分(PC1)具有较高的相关性,Lectera菌属、支顶孢属和赤霉菌属与第二主成分具有较高相关性,而这6类菌属均属子囊菌门肉座菌目类植物病原菌。与第一、二主成分相关的菌属均与植物病害相关,说明长期种植苜蓿引起相关病原菌累积。

表3 真菌属水平丰度的主成分载荷因子Table 3 Component loading factor of soil fungalgenera in relative abundance
3 讨 论
3.1 苜蓿种植对黄绵土真菌多样性的影响
土壤微生物群落结构组成及多样性的增加能够改变土壤微生态的稳定性,其在一定程度上可反映土壤健康状况[28]。真菌参与土壤有机物质分解,是土壤生态系统中不可或缺的一部分[29]。赵彤等[30]对宁南山区不同植被类型土壤微生物群落进行比较时发现,苜蓿人工草地能够显著改善土壤微生物多样性,这主要是因为不同作物根系分泌物存在异质性,释放根系分泌物(氨基酸、分泌酶、粘液和细胞裂解物)会影响微生物多样性,且凋落物经分解后释放的有机物质成分和数量亦使土壤微生物群落结构组成和多样性发生不同程度的变化[31-32]。已有研究表明,氮含量添加会降低真菌丰度及多样性并改变真菌的群落结构;相对细菌来说,真菌有更强的吸收氮素和磷素的能力[33-35]。本研究发现,氮含量添加的农田土壤真菌群落多样性Chao1、Simpson和Shannon指数与苜蓿土壤并无明显差异,这说明黄绵土区不同作物根系分泌物引起的土壤微生物多样性的差异可能主要存在于细菌群落而非真菌群落,本试验后续还需进一步探索。但是本研究发现,不同种植年限的紫花苜蓿草地土壤真菌多样性发生了改变,随着苜蓿种植年限延长,真菌群落的多样性(Shannon指数)显著增加,之后随着苜蓿生长的衰败又有所降低。这与耿德洲[16]在宁南山区研究的结果基本一致,但是最高值出现的年份有所不同,这可能与当地苜蓿适宜种植的年限有关,陇中黄土高原苜蓿适宜种植的年限可达10 a[36],远远长于宁南山区苜蓿6 a的适宜种植年限。多年生植物通过分泌根系分泌物对土壤微生物的群落结构和分布产生影响,进而改变微生物的丰富度和多样性[5]。苜蓿为多年生草种,根系发达,根系分布可直接改变真菌群落结构多样性[37];且随着苜蓿种植时间的延长到达旺盛期后地表覆盖物不断增加,凋落物和根系的腐解程度增大,苜蓿根瘤菌的固氮作用增强,使土壤有机碳和养分含量增加,根系通过养分转化和能量传递等过程提高了真菌丰富度[16,38-39]。随着苜蓿草地慢慢退化,苜蓿自身较强的化感物质通过根系分泌物、植株残体分解和地上部分淋洗等形式被释放到土壤中,并呈现逐年富集的趋势[40],这种自毒效应损害了根系的生长发育并降低根瘤菌固氮能力[41],引起土壤养分含量和微生物丰度与多样性下降。
3.2 苜蓿种植对黄绵土真菌群落分布特征的影响
农田土壤真菌群落组成与苜蓿存在差异,说明作物类型、耕作和施肥等措施对土壤中微生物群落组成有着显著影响。本研究发现农田和苜蓿土壤真菌均以子囊菌门为主,占比达到了69.15%~91.45%,其次为接合菌门和担子菌门,这与肖礼和Wang[42-43]等在黄土高原地区土壤真菌的研究结果相似,进一步说明子囊菌门为黄绵土真菌优势菌门,但由于受不同种植作物影响,不同生境中其相对丰度具有一定差异[42-43]。子囊菌门以腐生菌为主,可将土壤中的有机物质分解成易被作物吸收的养分,土壤中难以分解的纤维素和木质素主要依赖于子囊菌[44]。本研究中苜蓿土壤子囊菌门相对丰度显著高于农田土壤,农田土壤虽然通过长期耕作提高了土壤轻组C和N含量,但连续种植苜蓿增加了土壤腐殖质含量,且苜蓿能与根瘤菌形成共生关系固氮,所以苜蓿能为子囊菌的生长提供良好的繁殖条件[45-46]。农田土壤担子菌门相对丰度显著高于苜蓿土壤,可能是因为传统耕作措施种植玉米影响作物残茬分解过程,使土壤中木质素含量升高,增加了担子菌门相对丰度,而苜蓿土壤长期种植不翻耕,分解速率降低,导致担子菌门丰度较低[47]。本研究耕层土壤接合菌门相对丰度随着苜蓿种植年限的延长呈先升高后降低趋势,长期种植苜蓿且未翻耕,植物残体落叶等进入土壤转化为腐殖质,使有机物质含量提高,为微生物的生长和繁殖提供了充足的底物[48],而接合菌门恰恰能很好地利用腐生环境[49]。苜蓿种植15 a以后地上生物量降低,养分含量降低与生长衰退同时发生[50],有机物质的减少导致接合菌门相对丰度随之减小。
本研究中被孢霉属相对丰度表现为农田土壤显著高于苜蓿土壤,随苜蓿种植年限延长被孢霉属相对丰度先增加后降低。被孢霉属能促进植株生长,是土壤中的有益微生物,可补充氮素、溶磷,提高植物的抗病性[51-52];健康植株土壤中的相对丰度显著高于发病植株土壤[53]。玉米根系分泌糖和氨基酸,能促进微生物活化难利用的磷[54],进而提高了被孢霉属丰度。随苜蓿种植时间延长,土壤养分和地上生物量均逐渐增加,为被孢霉属的生长繁殖提供了充足的底物,而持续种植紫花苜蓿会导致土壤产生干层,当苜蓿种植年限达到一定的阶段,土壤干燥化严重,此时土壤孔隙度降低、空气含量下降,水分条件和氧气含量成为了限制被孢霉属生长繁殖的限制性因素,缺乏生存条件的被孢霉属丰度又逐渐下降[7,45,50]。本研究农田土壤绿僵菌属相对丰度显著高于苜蓿土壤,且随苜蓿种植年限延长逐渐下降。绿僵菌具有较强的耐高温和耐旱特性,丰富的N、P可以促进菌丝的生长并能增加其菌苔厚度[55]。农田土壤由于连年施肥使得速效N、P含量较高,且覆膜使土壤温度持续上升,提高了氮素转化速率,增加了绿僵菌属丰度;L2012处理的苜蓿处于生长旺盛期,土壤中可以被利用的营养物质多,能够为绿僵菌的生长与繁殖提供适宜的环境[56]。随着苜蓿种植年限的延长,土壤速效磷含量大幅降低[57],导致绿僵菌的丰度持续降低。本研究中农田土壤腐质霉属相对丰度均显著高于苜蓿土壤,可能是因为腐质霉属营腐生,可在土壤内或病株残体上越冬,农田玉米收获后根系残留在地表过冬,碳含量充足,加之覆膜保湿,为腐质霉属的繁殖保证了水分和营养条件。
主成分分析发现,土壤镰刀菌属、丛赤壳属和土赤壳属均与第一主成分具有较高的相关性,镰刀菌属是重要的植物病原菌之一,对种子萌发、根系、根茎生长产生不利影响[58]。本研究苜蓿土壤镰刀菌属相对丰度随种植时间延长随之增长,由于苜蓿随种植时间的增加可通过根系分泌物和植株残体分解等形式释放化感物质到土壤中,产生自毒效应,并呈现出逐年富集的趋势[40],特别是对其根系的生长发育及根瘤菌的固氮能力造成损害[41],使病原真菌含量逐渐增长。丛赤壳属和土赤壳属作为子囊菌门肉座菌目的分生孢子在草本植物的根际大量存在,为腐生真菌,常引起植物根腐病等病害[59-60],本试验中与第一主成分相关性较高的菌属均为与植物病害有关的病原菌,这与苜蓿种植年限有一定的关系。
4 结 论
与农田相比,种植苜蓿对土壤真菌多样性无明显影响,但其表现为随苜蓿种植年限的延长显著增加,之后随着苜蓿生长的衰败有所降低。不同种植年限苜蓿地土壤真菌群落结构组成相似性高,但其优势菌群分布受种植时间的影响。黄土高原雨养农业区农田和苜蓿土壤真菌优势门为子囊菌门(56.46%~91.45%)、接合菌门(5.23%~32.83%)和担子菌门(1.92%~9.06%);农田土壤已分类优势菌属为被孢霉属(19.63%~32.45%),苜蓿土壤优势菌属为刺孢属(7.94%~29.54%)、被孢霉属(5.21%~23.33%)和白僵菌属(3.13%~29.73),且表现为随着种植年限延长,耕层土壤促生菌(白僵菌属和绿僵菌属)丰度下降,部分病原菌(镰刀菌属、赤霉菌属)丰度增加。
