单生育期水分胁迫对温室葡萄根际土壤酶活性及微生物群落的影响
2021-06-28高彦婷杨昌钰李红霞
高彦婷 ,黄 珍,张 芮,王 菲,董 博,杨昌钰,李红霞
(1.甘肃农业大学水利水电工程学院,甘肃 兰州 730070;2.陕西省土地工程建设集团,陕西 西安 710075;3.甘肃省农业科学院,甘肃 兰州 730070)
土壤作为陆地生态系统的关键组分,在全球物质循环、能量转化过程中扮演着重要角色[1-2]。土壤微生物是土壤养分转化与腐殖质形成过程的重要参与者,在维持土壤生态功能中不可或缺[3]。土壤酶是土壤系统中最活跃的有机成分之一[4],其反映土壤微生物的活性,代表土壤中物质代谢的旺盛程度,是评价土壤营养物质循环转化以及各种农业措施和肥料施用效果的重要指标[5-6]。目前,土壤微生态调控已然成为土壤生态学研究的热点[7-9],且土壤微生物数量、土壤酶活性与土壤微生物群落结构组成等已作为土壤健康的生物指标来指导农田水肥管理[10-11]。
刘振香等[12]研究表明,施用有机肥可以显著提高土壤微生物数量、多样性及丰富度,提高微生物的生物量和代谢活性[13],但会降低细菌群落优势度;过多施用有机肥并不能无限提高土壤微生物的丰富度和改善微生物的群落结构[14-15]。高彦波等[16]研究表明土壤酶活性与土壤肥力高度相关,磷酸酶与磷的相关性显著[17],土壤碳氮可影响土壤酶活性[18],较高的有机碳含量能促进土壤酶的合成[19-20],在本底氮含量低的地区土壤酶活性与全氮表现为正响应[21-22]。李宝福等[23-25]研究表明由于根系分泌物和根际微生物积极活动的关系,植物根际的土壤酶促过程要比根际外强得多。Badiane等[26]利用土壤酶活性监测半干旱热带地区土壤质量,结果表明,植被、耕作方式及年限都会对土壤酶活性产生影响,但不同的酶对这些因素的响应不同。灌溉是农业生产中最主要的农业管理措施之一,具有促进作物生长和提高产量的作用,同时也对土壤微生物的数量、群落结构和活性产生影响[27]。研究表明,土壤水分的增加为各种酶促反应提供了反应条件与场所,酶活性随土壤含水量的升高而增强[28-29];但过多的土壤水分会增加Fe2+等还原性因子,进而影响土壤酶释放,降低其活性[30]。综上可知,以往研究多涉及土壤微生物、酶活性与肥料[12-15]、养分[16-22]、植物[23-26]、耕作方式等的相关性,虽然已有关于控水对农田土壤酶活性和微生物特征影响的研究[28-30],但是关于控水对葡萄根际土壤的微生物群落结构和土壤酶的影响机制,尤其是水分管理对温室葡萄根际土壤微生物群落结构的影响机理尚不清晰。西北地区是我国温室栽培的优势产区和农业水资源匮乏的地区,为此,研究充分供水和水分胁迫对温室葡萄根际土壤微生物群落结构和土壤酶活性的影响,揭示控水对温室葡萄根际土壤酶活性和微生物群落结构的影响机制,可为温室葡萄科学用水管理提供一定理论依据和数据支撑。
1 材料与方法
1.1 试验区概况
试验于2017年5—12月在甘肃省兰州市永登县设施栽培葡萄试验基地进行,地理位置102°38′E,36°12′N,海拔2 005 m,地处干旱半干旱地区,属大陆性气候,年均气温5.9℃,降雨量290 mm,蒸发量4 640 mm。试验区土壤主要为壤土,田间持水量27.2%(体积比),容重1.42 g·cm-3,土壤pH值8.15,全氮0.82 mg·kg-1,碱解氮37.08 mg·kg-1,硝态氮108.36 mg·kg-1,铵态氮20.25 mg·kg-1。
1.2 试验设计
选用当地主栽葡萄‘红地球’,晚熟欧亚品种,依据灌溉试验规范将其生育期划分为5个(见表1)。
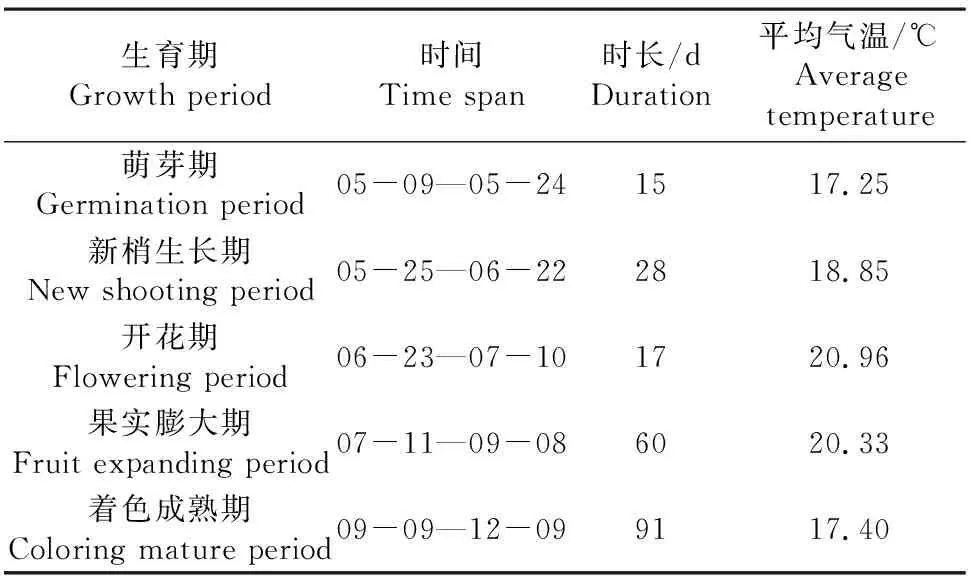
表1 2017年葡萄生育期划分表
葡萄种植于6 m×80 m的土墙草帘温室大棚中,单臂Y型矮单篱架栽培方式,行距2.0 m,株距0.8 m。采用单因素完全随机试验,在全生育期以土壤含水率下限为田间持水率θf的75%为充分供水对照(CK),每个生育期设定土壤含水率下限依次为45%θf的重度水分胁迫处理(S)和60%θf的轻度水分胁迫处理(M),3次重复,共计33个小区,各小区面积均为12 m2(2 m×6 m)。具体设计如表2。

表2 试验处理
采用1管1行滴灌控制系统,于各小区同侧铺设滴灌带,灌水由各分支前的阀门控制。灌水时间由各处理实测土壤含水率确定,当试验地实测土壤含水率(0~100 cm平均值)占田间持水率百分比达到表2中设计下限值时灌水,灌水定额均为270 m3·hm-2,灌水后充分供水(CK)土壤含水率达到田间持水率,轻度S和重度M胁迫处理分别达到85%θf和75%θf,非胁迫生育期灌水后土壤含水率上限与CK组相同,即都达到田间持水率。在标准试验地之间铺设1 m深2 mm厚的聚乙烯土工膜以防止土壤水扩散。所有试验地施肥、修剪、病虫害防治及除草等农艺措施均与当地温室葡萄栽培管理相同。
1.3 土壤样本采集与处理
1.3.1 土壤含水率的测定 在各试验小区沿葡萄行方向距端点2、4 m位置,离主干横向20~30 cm同侧位置选取2个测点,在各点纵深分别为10、20、40、60、80、100 cm处取土样,用烘干法测定相应深度处土壤含水率,取样点含水率取各纵深点的算术平均值,小区含水率取两个点平均值。全生育期每10 d取样一次,灌水前后土壤含水率接近灌水控制下限值(表2)时加测。
1.3.2 土壤细菌群落多样性、微生物生物量碳及土壤酶活性的测定 各处理同侧距端点1、3、5 m处,去除土壤表层杂物,在靠近根系处用直径2 cm土钻钻取深度20 cm左右处土壤样本,同处理三测点土样混匀后,去除可见根,装入无菌密封样本袋中,用冰盒尽快带回实验室,过2 mm筛低温(-20℃)保存,用于土壤细菌群落多样性、微生物生物量碳及土壤酶活性的测定。
土壤细菌群落多样性委托北京诺禾致源生物信息科技有限公司通过高通量16S rDNA扩增子测序处理;微生物生物量碳采用氯仿熏蒸浸提法[31];土壤酶(蔗糖酶、淀粉酶)活性均采用3,5-二硝基水杨酸比色法测定[32]。
1.4 数据处理
采用Excel 2007和SPSS 21.0数据分析软件进行统计分析和作图,并用邓肯(Duncan)法进行多重比较检验。
2 结果与分析
2.1 单生育期水分胁迫对葡萄根际土壤酶活性的影响
从图1可以看出,全生育期内CK处理土壤蔗糖酶活性呈“M”型变化、淀粉酶活性呈倒“V”型变化,且均在果实膨大期达到最高水平(分别为5.41 mg·g-1·d-1和2.35 mg·g-1·d-1)。
由单生育期水分胁迫下土壤蔗糖酶活性的单因素方差分析可知(图1A),萌芽期GS、GM处理较对照CK分别高66.7%和73.2%,但所有处理间均无显著性差异。新梢生长期,PM较CK略有提升,差异不显著,但两者均显著高于PS,其他处理间均不存在显著性差异。开花期,处理FS、FM均较CK略高,但无显著性差异,GS、PS显著高于CK。果实膨大期,各处理的土壤蔗糖酶活性均达最大值,其中EM处理显著高于CK,而ES处理较CK无显著性差异,却显著低于EM,说明果实膨大期的轻度水分胁迫也能够显著提高土壤中蔗糖酶活性。着色成熟期,处理CS、GS均低于CK,但不存在显著性差异,而GM处于最高水平,显著高于CS和CM,但与CK间无显著差异。这可能由于该时期在葡萄生育期中历时最长(91 d),长时间水分胁迫抑制了土壤中蔗糖酶活性,而GM处理在葡萄生长早期抑制了葡萄的营养生长,促进葡萄根的生长,复水后的补偿效应使得后期生长中土壤微生物活动增强,表现为土壤蔗糖酶活性增强。
土壤淀粉酶活性在单生育期水分胁迫条件下也存在明显变化(图1B)。萌芽期GS处理较CK减小19.7%,二者间无显著性差异,但均显著低于GM;新梢生长期PM有所提升,PS有所下降,但与CK均无显著性差异,而PM显著高于PS;开花期FS在各处理间处于最低水平,FM比CK高出13.5%,但与CK均无显著性差异,PM在各处理间处于最高水平,显著高于FS,但与CK间不存在显著差异,可能因为新梢生长期受轻度胁迫导致的水分亏缺在开花期迅速得以补充,使得土壤淀粉酶活性增强,而PS表现不明显,分析可能是新梢生长期重度水分胁迫抑制了根的生长,即使开花期恢复灌溉仍不能使土壤淀粉酶活性得到恢复。果实膨大期,除ES外,各处理淀粉酶活性均达到整个生育期的最大值,表现为PM>FM>EM>PS>CS>FS>CM>GM>CK>GS>ES,ES显著低于PM和FM,但与CK差异不显著。 着色成熟期后,随着气温的降低微生物活动强度减弱,土壤淀粉酶活性普遍降低;处理CS、CM较CK分别降低了54.0%和22.3%,但均无显著性差异。
2.2单生育期水分胁迫对葡萄根际土壤微生物生物量碳的影响
表3表明,充分供水处理CK土壤微生物量碳在全生育期内经历了从萌芽期到开花期快速增大、生育期后期(果实膨大期和着色成熟期)缓慢减小的过程,且开花期积累达到最大值(242.48 mg·kg-1)。
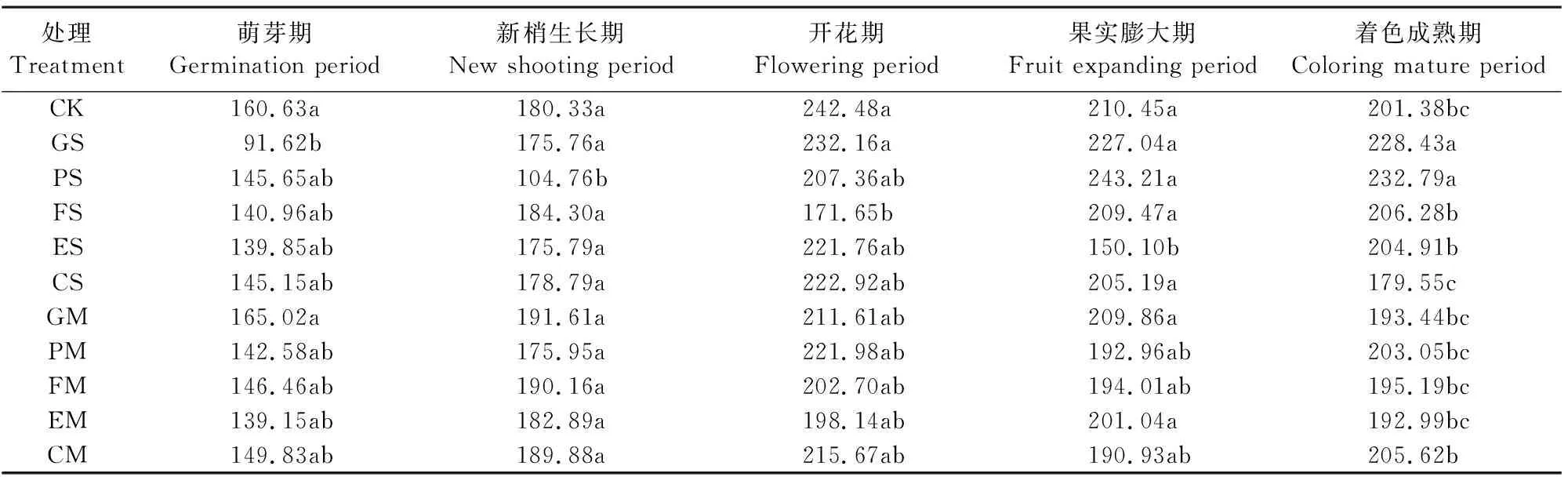
表3 单生育期水分胁迫对根际土壤微生物生物量碳的影响/(mg·kg-1)
萌芽期GS处理下的土壤微生物量碳显著小于CK,降低了43.0% ,GM较CK增加了2.7%,但无显著性差异;新梢生长期PS处理土壤微生物量碳明显降低,且显著低于CK及其他处理,PM土壤微生物量碳虽较CK降低2.4%,但二者间无显著性差异;除处理FS和EM外,开花期各处理的土壤微生物量碳都达到了全生育期的最大值,FS较CK降低29.2%,且与CK和GS有显著性差异;果实膨大期ES处理的土壤微生物量碳较CK降低28.7%,且二者间存在显著性差异,EM处理较CK降低4.5%,二者间无显著性差异;着色成熟期处理CS较CK降低10.8%,但二者间不存在显著性差异,处理CM的土壤微生物量碳高于CK;ES处理的土壤微生物量碳在这一时期恢复灌溉后迅速提升,但与CK无显著差异,而处理GS及PS分别比CK高出13.4%和15.6%,差异达到显著性水平。说明着色成熟期水分胁迫处理对土壤微生物量碳的影响较充分供水处理不明显;而萌芽期和新梢生长期的重度水分胁迫在恢复灌溉后对生育期末期微生物量碳的积累有利。
2.3 水分胁迫对葡萄根际土壤微生物α-多样性的影响
菌群丰度指数Chao1和菌群多样性指数Shannon与群落多样性呈正比,测序深度指数Coverage越高说明样本中序列被检出的概率越高。选取温室栽培葡萄开花期、果实膨大期和着色成熟期CK、GS、PS、FS、ES、CS 处理根际土壤进行高通量测序,研究单生育期水分胁迫条件下根际细菌群落结构和物种多样性的变化情况。表4中样本覆盖率在0.966~0.982间,说明根际土壤样本微生物测序结果获得了绝大多数样本信息,能够反映样本代表的根际土壤中微生物的真实情况。
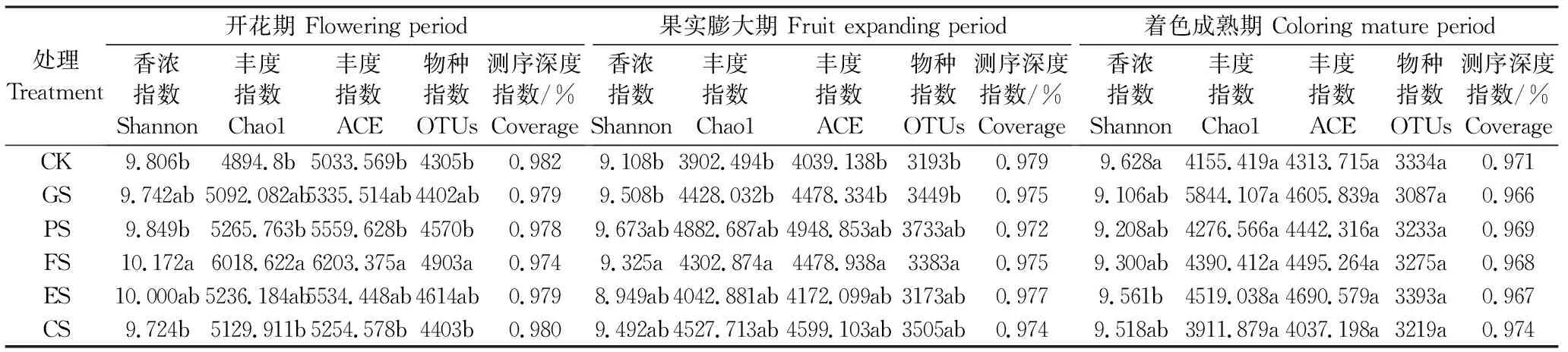
表4 不同生长期根际土壤微生物群落α-多样性
由表4可以看出,不同生育期重度水分胁迫对葡萄根际土壤微生物群落的丰富度和多样性均有影响。开花期FS的Chao1、ACE和Shannon及OTUs指数均显著高于CK,同时也高于处理PS和CS。果实膨大期,处理ES的Shannon指数较对照CK降低1.7%,差异不显著;处理FS的指数Chao1和ACE、Shannon及OTUs依然显著高于对照CK。着色成熟期处理CS的指数Chao1、ACE和OTUs均小于对照CK,但差异不显著;处理ES的Shannon指数显著小于对照CK,指数Chao1、ACE和OTUs均大于对照CK,但差异不显著。
2.4 门水平上根际土壤细菌群落组成及结构
2.4.1 葡萄根际土壤细菌相似度聚类分析 基于 weighted UniFrac距离的层次聚类分析( 图2)结果显示,不同生育期水分胁迫条件下葡萄根际土壤菌群结构差异明显。开花期(图2A),处理FS和CK距离最近,ES、GS和PS可聚为一类,CS和CK距离最远;果实膨大期(图2B),处理PS和CK距离最近,FS、CS和ES可聚为一类,GS和CK距离最远;着色成熟期(图2C),处理GS和CK距离最近,PS和CK趋同性最差。
2.4.2 葡萄根际土壤细菌群落组成分析 对门水平上各胁迫处理样本中相对丰度排名前十的菌落分组物种(其余丰度相对较低的归为Others)与CK样本进行相关性分析并绘制其相对丰度图(图2)。门水平上微生物丰度排名前十的物种在单生育期水分胁迫下差异明显,但变形菌门(Proteobacteria)始终是优势类群,占比为36.04%~54.58%(平均41.06%)。
开花期(图2A),各菌门占比递减次序为:厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、
拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、奇古菌门(Thaumarchaeota)、浮霉菌门(Planctomycetes)、热微菌门(Thermomicrobia),平均占比分别为:13.49%、13.09%、5.42%、6.2%、4.68%、3.78%、2.89%、2.47%、1.76%。其中,CS处理的变形菌门(Proteobacteria)占比最低,与占比最高的CK处理差异显著,说明开花期水分胁迫对变形菌门(Proteobacteria)有抑制作用;处理FS的变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)相对占比较处理CK分别降低了0.4%和4.67%,但差异不显著;处理ES和CS的浮霉菌门(Planctomycetes)相对占比显著高于其占比最小的CK处理,说明水分胁迫有利于浮霉菌门(Planctomycetes)的生长。排名前十其他门细菌群落的相对占比与CK处理不存在显著性差异。
果实膨大期(图2b),各菌门占比递减次序为:放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、奇古菌门(Thaumarchaeota)、螺旋体门(Spirochaetes),平均占比分别为:9.86%、8.74%、8.56%、6.41%、3.82%、3.39%、2.67%、1.60%、1.42%。其中,ES处理的放线菌门(Actinobacteria)相对占比最高(12.22%)且显著高于CK,说明果实膨大期水分胁迫有助于放线菌门(Actinobacteria)的繁殖,其酸杆菌门(Acidobacteria)和浮霉菌门(Planctomycetes)的相对占比分别高出CK的1.6%和1.35%,差异显著。TOP10其他门细菌群落的相对占比与CK处理差异不显著。
着色成熟期(图2c),各菌门占比递减次序为:芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、奇古菌门(Thaumarchaeota)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、广古菌门(Euryarchaeota),平均占比分别为:9.36%、8.10%、6.88%、6.54%、4.27%、4.27%、4.00%、3.27%、3.27%。其中,CS的变形菌门(Proteobacteria)较CK提高3.63%,拟杆菌门(Bacteroidetes)降低0.76%,绿弯菌门(Chloroflexi)降低0.62%,说明着色成熟期水分胁迫有利于变形菌门(Proteobacteria)的生长,会抑制放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi)的繁殖,但均无显著性差异;其放线菌门(Actinobacteria)丰度最低,广古菌门(Euryarchaeota)最高,且均与其他处理差异显著。TOP10其他门细菌群落的相对占比与CK处理差异不显著。
2.5 温室葡萄根际土壤环境因子在门分类水平上的相关性分析
采用斯皮尔曼(Spearman)相关分析法对不同生育期葡萄根际土壤环境因子(土壤水分、土壤淀粉酶活性、土壤蔗糖酶活性、土壤微生物生物量碳)在根际土壤细菌门分类水平上的相关性进行研究表明,不同生育期水分胁迫下葡萄根际土壤环境因子对细菌门分类水平上的影响不同(图3)。土壤含水率只在开花期与温室葡萄根际土壤丰度排名TOP10的细菌中变形菌门(Proteobacteria)呈显著正相关(相关系数为0.5026),与放线菌门(Actinobacteria)呈显著负相关(相关系数为-0.5253)(图3A),在果实膨大期和着色成熟期与细菌各门类相对丰度相关性不显著(图3B、C);土壤淀粉酶在果实膨大期与根际土壤中拟杆菌门(Bacteroidetes)呈显著正相关(相关系数为0.5191),与奇古菌门(Thaumarchaeota)呈极显著负相关(相关系数为 -0.6078)(图3B),在开花期和着色成熟期与细菌各门类相对丰度相关性不显著(图3A、C);土壤蔗糖酶在果实膨大期与根际土壤中浮霉菌门(Planctomycetes)和放线菌门(Actinobacteria)分别呈显著和极显著正相关(相关系数分别为0.5108和0.6615)(图3B),在着色成熟期与广古菌门(Euryarchaeota)和厚壁菌门(Firmicutes)分别呈显著和极显著负相关(相关系数分别为-0.5248和-0.6017)(图3C),在开花期与细菌各门类相对丰度相关性不显著(图3A);土壤微生物量碳在开花期与放线菌门(Actinobacteria)呈极显著负相关(相关系数为-0.6285)(图3A),在果实膨大期与浮霉菌门(Planctomycetes)、奇古菌门(Thaumarchaeota)呈显著正相关(相关系数分别为0.5294和0.4799),与放线菌门(Actinobacteria)呈极显著正相关(相关系数为0.6347),与变形菌门(Proteobacteria)呈极显著负相关(相关系数为-0.6017)(图3B),在着色成熟期与细菌各门类相对丰度相关性不显著(图3C)。
3 讨 论
不同类型的土壤酶活性随生育期的变化不尽相同[33]。本研究中温室葡萄全生育期内,CK处理土壤蔗糖酶活性呈“M”型变化、淀粉酶呈抛物线型变化趋势,且均在果实膨大期达到最高水平。水分作为影响农作物生长的重要环境因子,对土壤酶活性有至关重要的作用。田幼华等[34]研究表明,土壤酶活性随土壤水分的增加而增加。万忠梅等[35]认为,在干湿交替和较干旱条件下土壤酶活性高于长期处于淹水条件,同时随着土壤含水量的增加酶活性逐渐降低。本研究中各生育期M处理(轻度水分胁迫)的土壤蔗糖酶和淀粉酶活性均高于S处理(重度水分胁迫)和除着色成熟期外的CK对照,这与周芙蓉等[36]一定程度水分胁迫能提高土壤酶活性的结论一致。着色成熟期土壤蔗糖酶和淀粉酶活性普遍降低,可能由于气温的降低导致微生物活动强度减弱,进而影响了酶活性,也可能是因为该期时间较长,长时间水分胁迫抑制了土壤酶活性。土壤酶活性与土壤微生物量较其他土壤性质更迅速地响应控水管理[37],着色成熟期水分胁迫对土壤微生物量碳的影响与充分供水差异不显著;而萌芽期和新梢生长期的重度水分胁迫在恢复灌溉后对生育期末期微生物量碳的积累有利。
土壤微生物类群在土壤生态系统中有着非常重要的作用,其数量特征可表征土壤质量好坏及肥力的高低[38-40]。试验中微生物群落丰富度指数(Chao1和ACE)、香农指数(Shannon)及OTUs在各处理基本表现为:开花期最大,膨大期减小,着色成熟期有所回升,且在处理FS中增大明显。说明开花期重度水分胁迫处理能够增加同期土壤微生物群落多样性,因为开花期适宜的温度和湿度为微生物提供了良好的环境,有助于微生物生长繁殖;膨大期重度水分胁迫对同期微生物群落多样性影响不明显,但能够增加其着色成熟期微生物群落多样性,分析原因可能是随着季节变化低气温抑制了微生物的生长,使得微生物数量在果实膨大期有所下降;着色成熟期大量植物腐烂后使得土壤中有机质增加,有助于微生物生长,故在该期微生物数量和多样性有所回升,这与李杰[41]、赵萌[42]等得出微生物数量和多样性受季节变化影响显著的结论一致。
研究发现不同生育期水分胁迫对设施葡萄根际土壤微生物在门分类水平上相对丰度影响程度不同,根际土壤优势类群为变形菌门(Proteobacteria),其他优势种群包括放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)等,这与王晓雯等[43]对葡萄园土壤细菌群落结构的研究结果类似。相关性分析表明,土壤含水率在开花期与变形菌门呈显著正相关,与放线菌门呈显著负相关,在果实膨大期和着色成熟期与细菌各门类相对丰度相关性不显著,即开花期土壤水分是影响根际土壤变形菌门和放线菌门相对丰度的主要因素。农田土壤微生物多样性包含物种、结构、遗传和功能等多样性,针对多年生藤本植物葡萄,本研究仅就一个年度内的控水对温室葡萄根际土壤微生物物种多样性进行了分析,后期应结合其他多样性方面的检测,就连续多年水分调亏对温室葡萄根际土壤生态环境的影响做更深入的研究。
4 结 论
1)温室葡萄根际土壤酶活性、微生物量碳均随季节变化,水分胁迫对温室葡萄根际土壤酶活性有不同程度的影响,且在各个生育期恢复灌溉后,会对胁迫造成的土壤酶活性及微生物量碳的降低有不同程度的补偿,土壤蔗糖酶活性对土壤水分变化较淀粉酶更为敏感。
2)水分胁迫的持续时间对温室葡萄微生物群落结构多样性和丰富度影响较大,短期水分胁迫(如开花期)对其有提高作用,长时间尤其重度胁迫(如果实膨大期)对微生物群落结构多样性抑制作用显著,且水分胁迫对微生物群落结构积极或不利的影响都具有一定的滞后性和延续性。
3)不同处理对温室葡萄根际土壤门分类水平上相对丰度有不同程度影响,并且同一处理在各生育期内不同门分类细菌变化情况不同,温室葡萄根际土壤中门分类水平上细菌优势类菌群为变形菌门(Proteobacteria)。
4)在不同生育期,影响根际土壤细菌相对丰度的主要因素不同。开花期,土壤水分、土壤微生物生物量碳是影响根际土壤变形菌门和放线菌门相对丰度的主要原因;果实膨大期,土壤淀粉酶、蔗糖酶活性及土壤微生物生物量碳是影响土壤细菌相对丰度的主要因素;着色成熟期,蔗糖酶活性为影响根际土壤细菌相对丰度的主要因素。
