空芯针穿刺诊断的乳腺导管原位癌病理学升级的危险因素分析
2021-06-28李严王珏陈锐李硕史晓青徐迎港张娓娓查小明
李严, 王珏, 陈锐, 李硕, 史晓青, 徐迎港, 张娓娓, 查小明
Sentinel lymph node biopsy
随着乳房X线检查的普及,乳腺导管原位癌(ductal carcinoma in situ,DCIS)的检出率增加,占每年新诊断的乳腺癌病例的20%~25%[1]。DCIS指肿瘤细胞局限于单个导管束,是导管内上皮细胞因轻度至重度异型而发生的导管内病变,未突破基底膜,无间质浸润,未发生转移。因此,DCIS不会发生腋窝淋巴结或远处转移[2-3]。目前,超声引导下空心针活检术(core needle biopsy,CNB)已成为诊断乳腺病变的常用方法,然而取样量的限制可能导致无法获得最具侵袭性的病变成分,这可能导致术前病理诊断的不精确。此外,超声引导CNB诊断的DCIS中有8%~56%术后升级为微浸润或浸润性癌[4-6],同时腋窝前哨淋巴结活检(sentinel lymph node biopsy,SLNB)的阳性率达到1.4%~13.0%[7-8]。CNB诊断为单纯DCIS的患者在进行乳房手术时是否需要进行腋窝分期还存在很多争议。因此,我们需要进一步探究影响穿刺确诊为DCIS发生病理学升级的危险因素。在本研究中,我们回顾分析本中心经超声引导CNB诊断为DCIS的病例,探寻导致术后病理学升级的危险因素。
1 资料和方法
1.1 临床资料 对2013年1月至2019年12月南京医科大学第一附属医院乳腺病科收治的乳腺癌病例进行筛选,入组的标准为:①女性患者;②超声引导下CNB诊断为乳腺DCIS;③肿瘤分期为cN0M0;④接受腋窝分期诊断。患者术前在超声引导下使用14G巴德手动式穿刺活检枪进行肿块穿刺活检,穿刺前患者已签署乳房肿块穿刺活检知情同意书,穿刺确诊后,患者接受手术治疗。乳房手术包括全乳房切除术和保乳手术,腋窝手术包括SLNB和腋窝淋巴结清扫术(axillary lymph node dissection, ALND)。术中发现SLN阳性的患者进一步行ALND。标本经过石蜡包埋、切片、染色后阅片,进行HE染色和免疫组织化学(immunohistochemistry,IHC)检测,至少两名病理医生分析。最终病理结果分为DCIS、乳管原位癌伴微浸润性(ductal carcinoma in situ with microinvasive, DCISM)和乳管浸润性癌(invasive breast cancer, IBC),DCISM被定义为乳腺癌细胞突破基膜并侵犯临近组织,浸润灶最大径不超过1 mm,而浸润灶超过1 mm被称为IBC。采用IHC检测法对术后标本进行雌激素受体、孕激素受体和HER2测定,雌激素受体和孕激素受体阳性被定义为≥1%阳性染色的肿瘤细胞。IHC 0或1+为HER2阴性,IHC 3+为HER2阳性,IHC 2+为HER2不确定。Ki67的分界值为14%。
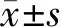
2 结果
2.1 临床特征 本研究纳入348例患者,年龄27~88(51±11)岁。总体病理低估率为53.74%(187/348),分别有61例(17.53%)最终病理上升级为DCISM,126例(36.21%)最终病理上升级为IBC。共310例(89.08%)接受乳房全切手术,仅有38例(10.92%)接受保乳手术。249例患者进行了SLNB(71.55%),99例患者(28.45%)接受ALND治疗。根据石蜡切片病理结果,28例(8.05%)患者中发现腋窝淋巴结转移,其中1~2个腋窝淋巴结转移占89.29%(25/28),≥3个腋窝淋巴结转移的患者占10.71%(3/28)。
2.2 DCIS术后病理学升级的危险因素分析 对DCIS术后病理学升级临床病理学特征进行分析,结果显示:肿瘤大小,组织学分级,BI-RADS分类,病灶内有无钙化点是病理学升级的影响因素,见表1。
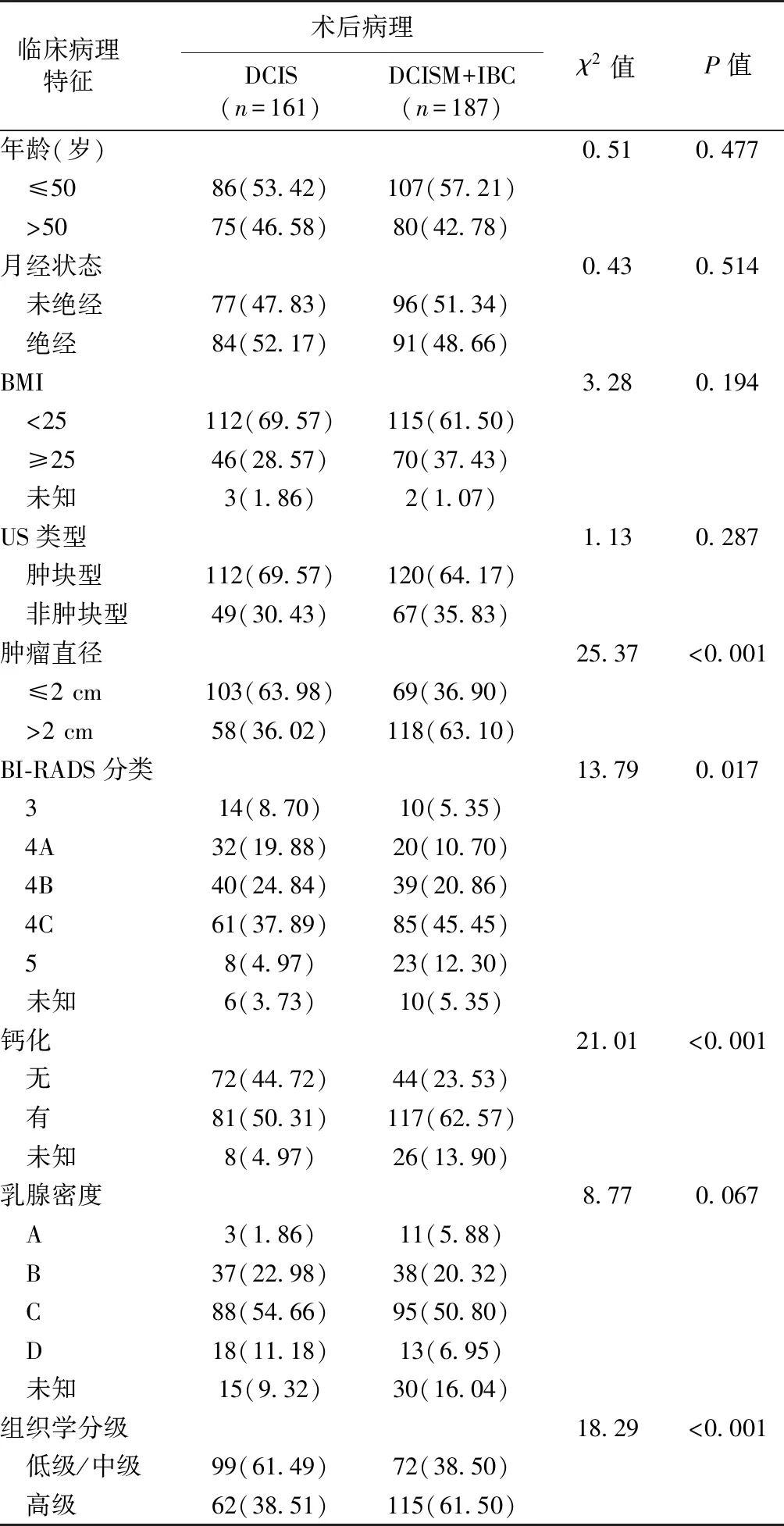
表1 DCIS术后病理升级为DCISM、IBC的临床病理学特征 [例(%)]
对上述4个相关因素与病理学升级的结果进行多因素logistic回归分析结果显示,肿瘤直径、组织学分级、病灶内有无钙化是病理学升级的独立影响因素,肿瘤直径>2 cm、组织学分级高、病灶内存在钙化的患者术后病理学升级的风险更高,见表2。
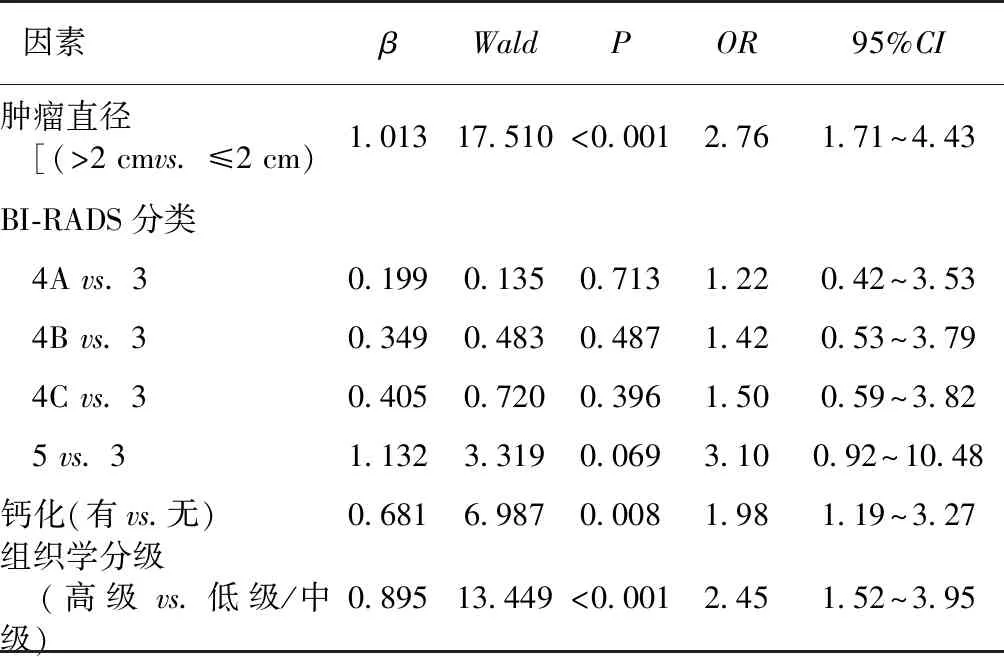
表2 DCIS术后病理升级为DCISM、IBC临床病理学特征的多因素Logistic回归分析
2.3 腋窝淋巴结转移情况 术后DCIS组未发现有腋窝淋巴结阳性病例;术后病理升级的病例中,腋窝淋巴结转移率为14.97%(28/187),DCISM组腋窝淋巴结阳性率为3.28%(2/61),IBC组腋窝淋巴结转移率为20.63%(26/126)。术后腋窝淋巴结阳性率DCISM组和DCIS组相比,差异无统计学意义(P=0.075);而IBC组的腋窝淋巴结阳性率高于DCIS组(P<0.001)和DCISM组(P=0.002),差异均有统计学意义。
2.4 DCIS升级为IBC的危险因素分析 对DCIS术后病理升级为IBC的临床病理学特征进行分析,肿瘤直径>2 cm,高组织学分级,病灶内有钙化是DCIS病理升级为IBC的危险因素,详见表3。
表3 DCIS病理学升级为IBC的临床病理学特征[例(%)]
乳腺密度是DCIS病理升级为IBC的独立影响因素,在乳腺密度为D、C、B类的患者术后病理升级为IBC的风险低于乳腺密度为A类的患者,详见表4。
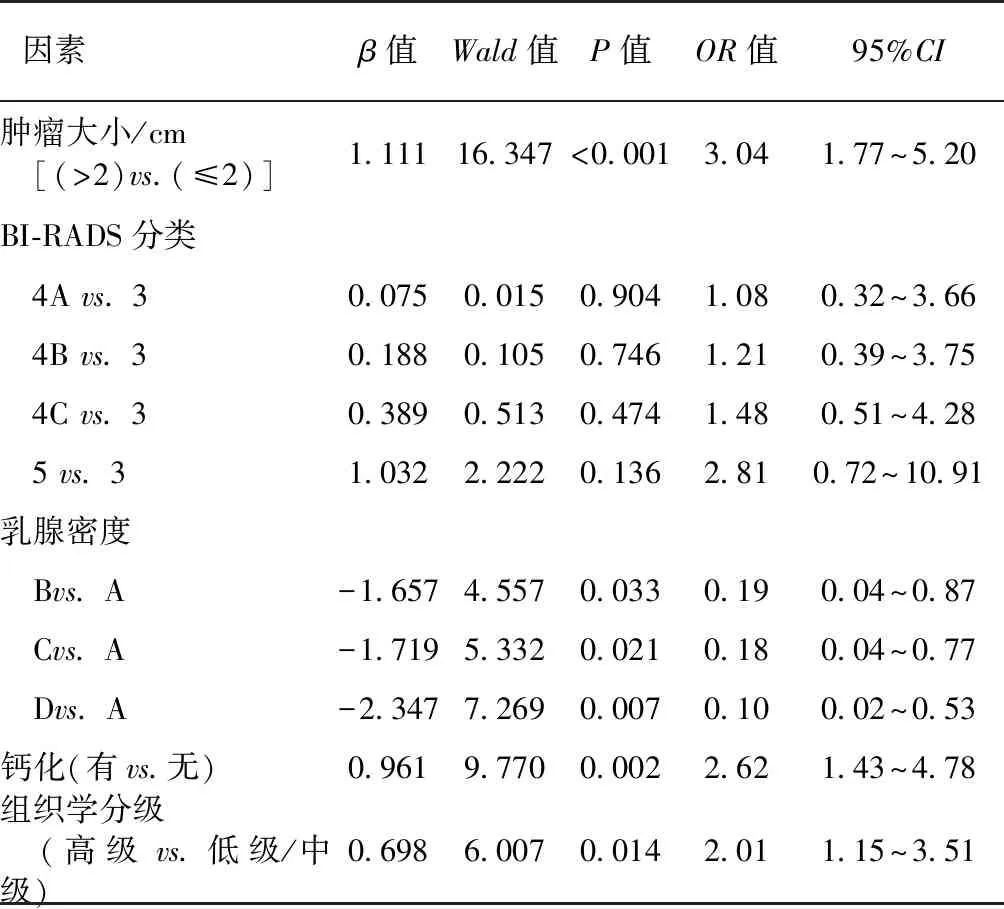
表4 DCIS病理学升级为IBC临床病理学特征的多因素Logistic回归分析
3 讨论
乳腺导管原位癌术后病理学升级的危险因素包括肿瘤体积大、组织学分级高、超声可见肿物、空芯针类型等[1,6,9]。但这些研究的样本量大小不一,预测因素也不尽相同,部分结论甚至相互矛盾。尽管Kondo等[10]和James等[11]曾提出了风险预测模型,但目前为止,仍没有公认的预测标准。研究发现,约26%的穿刺诊断为DCIS的患者病理学升级为IBC,同时有4%~29.6%的DCIS患者升级为DCISM[1,9,12-13]。在本研究中,病理升级为DCISM和IBC的比例分别为17.53%和36.21%。多因素分析得出病理升级的独立风险因素包括:肿瘤较大(>2 cm),组织学分级较高,病灶内有钙化。术后病理升级为IBC者,腋窝淋巴结转移的可能性升高,腋窝分期手术是不可避免的。
一项包括7 350个病例的Meta分析显示,肿瘤大小是病理学升级的独立预测因素[9]。另外,Lee等认为核分级是导致病理升级的重要因素[14]。Kondo等认为乳房钼靶的可疑发现与最终病理学升级有关[10]。同样,我们也发现钼靶发现钙化的患者更容易发生病理学升级。由于乳腺MRI价格昂贵,大多数患者术前并未进行该检查,在分析中,我们没有纳入乳腺MRI的影像学特点因素。既往研究发现乳腺BI-RADS分类4B或4C的患者发生病理学升级的风险远低于BI-RADS 5类的患者[15]。然而在本研究,我们发现BI-RADS分类越高的患者,其病理学升级风险有更高的趋势,但无明显统计学差异。值得注意的是,我们发现乳腺较致密的乳腺癌患者术后病理学升级为IBC的风险较低,提示对于乳房体积较大、密度较小的乳腺癌患者,术前CNB来评估肿瘤的浸润性是不准确的。
此外,其他预测因素中值得关注的是HER2,Ki-67[10,14,16-18]。但由于穿刺诊断的DCIS的IHC并不能用来指导全身治疗,本研究中的CNB标本极少做IHC检测,因此HER2及Ki-67状态未被纳入分析。在本研究中,仅10.9%的患者接受保乳手术,相比于其他研究,保乳率较低。主要原因有:第一,中国乳腺癌患者的乳房比西方国家乳腺癌患者体积小,对于肿块较大和多中心病变的乳腺癌患者,不得不选择全切手术。第二,乳房重建技术以及义乳模型的完善足以满足乳腺癌患者对美的追求。
既往的研究报道,DCIS患者腋窝转移的发生率约为5%[1,19],然而,由于穿刺病理会被低估,导致DCIS患者的腋窝阳性率增加到10%~20%。在本研究中,总体人群腋窝淋巴结阳性率为8.05%。在DCIS组,腋窝淋巴结阳性率为0(0/161),若DCIS发生病理学升级,腋窝淋巴结阳性率则增加到14.97%(28/187)。分组分析显示,DCISM组和IBC组分别有3.28%(2/61)和20.63%(26/126)的患者腋窝淋巴结阳性。分析发现腋窝淋巴结阳性率在DCIS组和DCISM组间没有统计学差异,而IBC组患者腋窝淋巴结阳性率明显高于DCIS组和DCISM组。
综上,肿瘤较大(>2 cm),组织学分级较高,钼靶发现钙化的患者更有可能在最终病理上升级。相比之下,小肿块(≤2 cm)组织分化较好,钼靶下未发现钙化的患者发生病理学升级的风险更低,最终的病理更有可能是单纯的DCIS,对于这些患者,腋窝分期可以省略。另外,随着辅助放疗和全身系统治疗的持续进展,对于腋窝临床评估为阴性的患者,辅助治疗或许可以替代腋窝手术治疗。在未来,需要更多的前瞻性临床研究来确定哪些患者可以避免腋窝分期。
