种植体周围组织不同健康状况下龈沟液微生物特性分析*
2021-06-27鄂玲玲王俊成史连瑞王潇宇李鸿波
徐 雯 鄂玲玲 张 戎 王俊成 刘 琳 史连瑞 王潇宇 李鸿波
目前,口腔种植技术已成为修复缺失天然牙的主要治疗方式。有研究表明,牙种植体的长期存留率高达95%-99%[1]。随着种植修复的广泛使用,种植体周围病的发生也在增加。Derks等[2]通过Meta分析估计种植体周围黏膜炎的患病率为43%。Mombelli等[3]通过长达5-10年的纵向研究发现种植体周围炎的患病率为20%左右。国际口腔种植共识会议[4]和国内种植修复临床评价标准[5]均提出种植体临床评估级别分为4个等级,即成功、状况良好、状况一般和失败。维护好种植体周围软硬组织健康是目前的研究热点,其与生物力学、种植体设计和宿主的情况密切相关。口腔种植学教材指出[6]细菌是引起种植体周围粘膜炎症和边缘骨吸收的主要病因,但对于微生物菌群的研究仍然相对欠缺。本研究根据种植体周围健康状态进行分组,从临床角度出发,研究种植体周围健康状态与微生物菌群的特性。
1.材料与方法
1.1 研究对象 本研究对象选自2016年1月至2019年12月于中国人民解放军总医院口腔科进行种植治疗并完成冠修复5年内的患者。经筛选共纳入27名患者的42颗种植体。本研究经中国人民解放军总医院人类伦理委员会批准(批准号:S2020-396-01)。
纳入标准:年龄为18岁以上种植单冠患者;全身健康状况良好;非吸烟;余留牙的牙周情况良好或经牙周治疗后可获得良好牙周的患者;牙种植体均位于后牙区;骨水平种植体;未服用影响骨代谢的药物。
排除标准:过去12周内全身抗生素治疗或预防性治疗;牙种植周围有急性炎症;牙种植体手术中行引导骨组织再生手术者;夜磨牙、深覆患者;无牙颌患者;即刻种植。
1.2 研究方法
1.2.1 实验分组 本研究根据国际种植体健康情况分级[4]和国内种植修复临床评价标准[5]记录种植体周围组织健康状况,分为成功(Success,S 组)、状况良好(Satisfactory survival,S.S 组)和状况一般(Compromised survival,C.S 组),三组种植体分别为15 颗、14 颗和13 颗。失败组因种植体有松动、骨吸收等问题,当患者复诊时种植体常已脱落,无法采集样本,故未设计失败组。所有种植体检查均由接受过专业培训的1名口腔医生进行。国际种植体健康情况分级标准如下所示。
1.2.2 临床数据采集 使用专业牙周探针进行探诊检查,记录探诊深度。初始植入牙种植体和患者复诊时均需使用锥形束(NewTom 5G,意大利)对种植体进行放射学检查,并使用NNT 5.6分析软件对种植体边缘骨吸收进行测量。

牙种植体效果临床评估分级
测量方法[7]:植体植入后选取种植体-骨界面(First bone-implant contact,FBIC)为参考点。植体植入后即刻进行影像学检查,测量植体初始植入深度(Initial depth of implant placement,IDIP)与参考线之间的距离;患者复诊时测量FBIC与参考线之间的距离。种植体边缘骨吸收为FBIC与参考线的距离减去IDIP 与参考线的距离得到种植体边缘骨吸收(单位用mm表示)。
1.2.3 龈沟液样本采集 本研究取样时间均为晴天上午,维持取样地点温度为25℃。①采样前将标有患者信息的标签贴于15ml无菌离心管;②去除龈上菌斑和牙石,用棉卷对相应种植体进行隔湿,气枪吹干;③镊子夹持30#无菌纸尖蓝色部分,轻插入种植体近颊、颊、远颊龈沟内直至有轻微阻力止。纸尖在该位置保持60秒之后立即取出;④一般采集6-8个无菌纸尖的量。采集完毕,立即将纸尖放入离心管内,置于干冰上,15min之内送至实验室-80℃冰箱待用。
1.2.4 16S rRNA 基因测序 采用CTAB 法提取DNA,使用PCR通用引物(341F和806R)扩增细菌16S rRNA 基因V3-V4 区域。在Bio-radT100梯度PCR 仪上进行循环:98℃预变性1min,进入30个循环扩增阶段,每个循环含98℃、10sec 变性;50℃,30sec 退火,72℃,30sec 延伸,72℃保温5min。对目的条带进行产物回收,运用NovaSeq6000进行高通量测序。本研究所有测序工作均委托北京诺禾致源科技股份有限公司进行。
1.2.5 统计分析 患者临床数据应用SPSS 25.0进行统计学分析,定量数据以Mean±SD表示,通过单因素方差分析进行统计学检验,采用Levene′s test 进行方差齐性检验,方差齐时采用LSD,方差不齐时,采用Tamhane。16S rRNA 基因测序中三组样本间的微生物差异采用ANOSIM 分析检验组间和组内差异。定义P<0.05有统计学差异。
2.结果
2.1 患者信息 本研究共招募27名志愿者,其中男性15名,女性12名,年龄范围为24-90岁,平均年龄52.48岁。采集患者牙种植体周围的龈沟液,共计42个标本,见表1。

表1 受试者种植体周围平均骨吸收量和平均探诊深度情况
2.2 稀释曲线 稀释曲线以样本中抽取的测序数据量和对应的物种数目(测序深度)构建曲线,可直接反映测序数据量和样本量的合理性。由图1知,随着序列数增加,三组样本的曲线趋于平缓。说明测序数据量合理,足以进行后续微生物分析。

图1 样本稀释曲线图。S组:成功组;S.S组:状况良好组;C.S组:状况一般组。
2.3 多样性分析Alpha 多样性是指某个群落或生境内部的多样性,常与丰富度和多样性息息相关。观察Chao1 与ACE 指数可发现微生物群落丰富度。观察Shannon 和Simpson 指数可发现微生物群落多样性。由表2 可知,Chao1 指数显示C.S组丰富度小于S组和S.S组但不具有显著差异(P>0.05)。Shannon指数显示(图2)S.S组菌落多样性高于S组和C.S组,与S组有显著差异(P<0.05)。
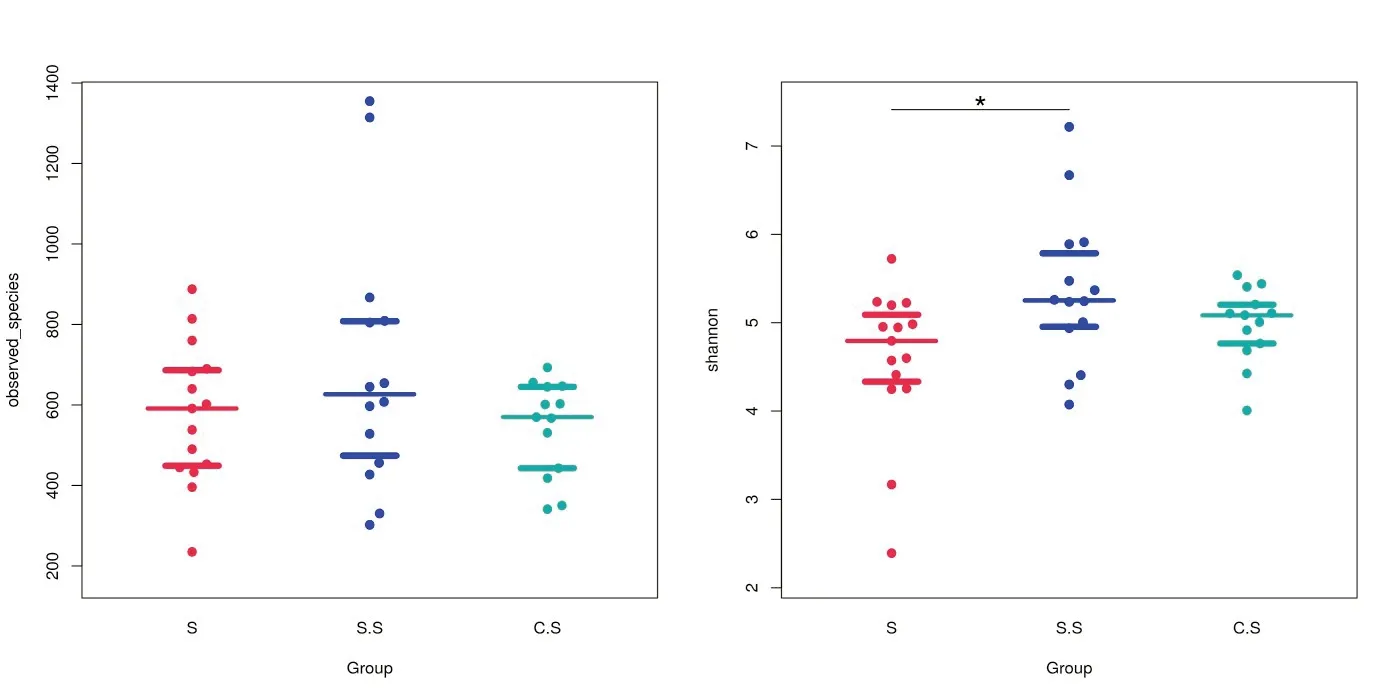
图2 三组样本Shannon指数。S组:成功组;S.S组:状况良好组;C.S组:状况一般组;*,P<0.05,S组与S.S组比较。

表2 三组样本Alpha多样性指数
2.4 属水平三组龈沟液菌群的比较 由图3 可发现三组样本的优势菌属为链球菌属(Streptoccus)、卟啉单胞菌属(Porphyromonas)、马赛菌属(Massilia)、罗氏菌属(Rothia)、不动杆菌(Acinetobacter)、普雷沃菌属(Prevotella)、梭杆菌属(Fusobacterium)、密螺旋体属(Treponema)、嗜血杆菌属(Haemophilus)、奈瑟菌属(Neisseria)等。图4显示三组样本中相对丰度显著不同的菌属。种植体健康状况由良好发展到一般时,棒状杆菌属相对丰度逐渐降低,致病菌产线菌属(Filifactor)和Lentimicrobium 相对丰度逐渐升高,丛毛单胞菌属(Comamonas)相对丰度显著减少,且三组之间差异显著(P<0.05)。与S.S 组和C.S 组相比,S 组中棒状杆菌属的相对丰度显著增加(P<0.05)。与S组和S.S 组相比,C.S 组中产线菌属和Lentimicrobium 的相对丰度显著增加,丛毛单胞菌属(Comamonas)的相对丰度显著减少(P<0.05)。短波单胞菌属(Brevundimonas)相对丰度在S.S 组最高,显著高于S组和C.S组(P<0.05)。

图3 三组样本在属水平上物种相对丰度柱形图。S组:成功组;S.S组:状况良好组;C.S组:状况一般组。

图4 三组样本菌属比较。S组:成功组;S.S组:状况良好组;C.S组:状况一般组。
2.5 三组龈沟液中细菌代谢差异 功能分析表明(图5),与C.S组相比,S组和S.S组具有更多与生命活动相关的代谢通路,例如氨基酸代谢和能量代谢。这些代谢途径有利于细菌的繁殖生长。C.S组中免疫系统、糖的合成和代谢以及内分泌系统更加活跃。
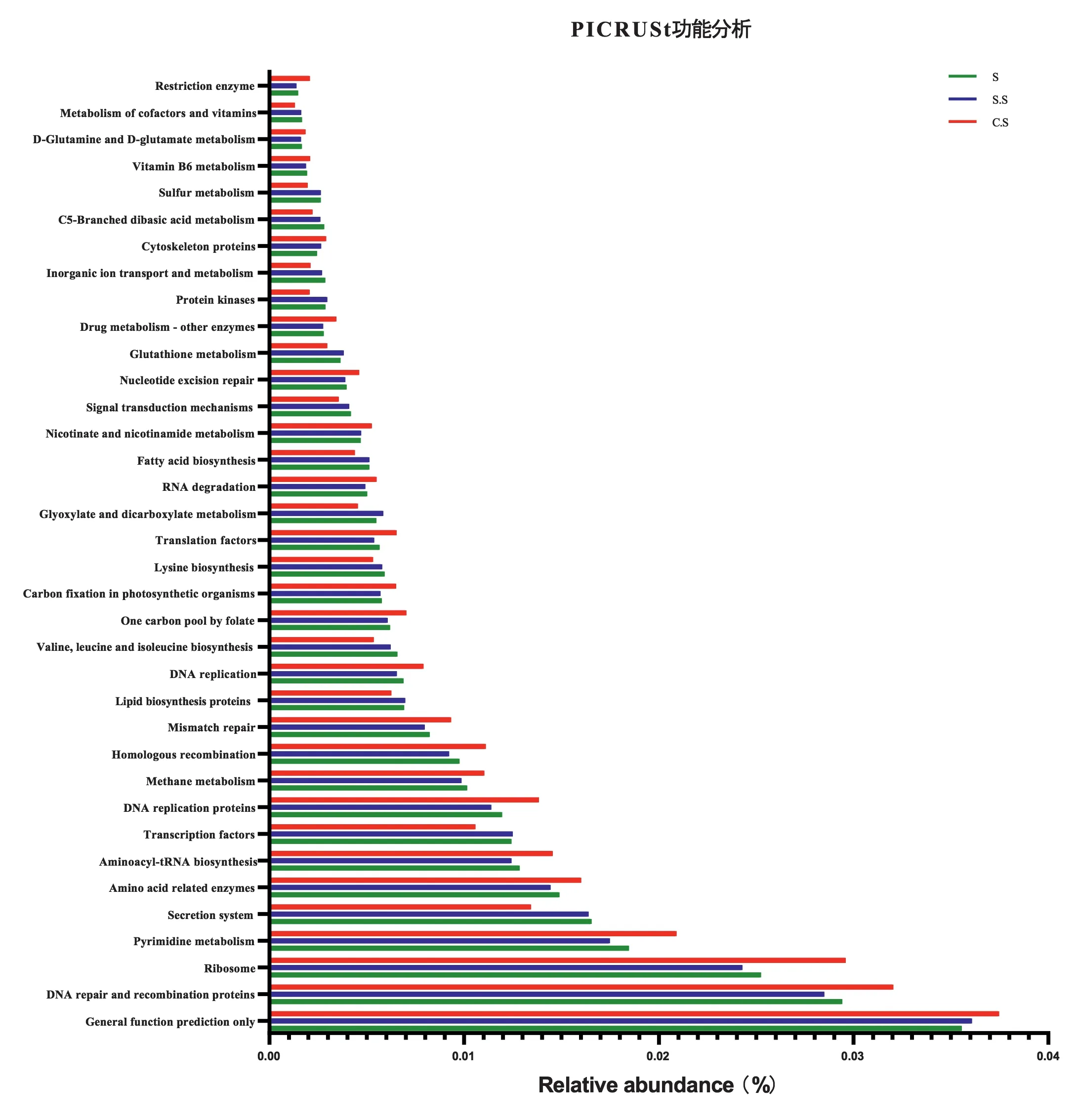
图5 PICRUSt功能预测。S组:成功组;S.S组:状况良好组;C.S组:状况一般组。
3.讨论
种植体周围病是影响种植体成功与否的重要因素之一,常由种植体周围菌群失调导致。因此研究不同健康状况下牙种植体的微生物特性具有一定临床意义。故本研究基于种植体周围病治疗的决策树,采用种植体健康情况分级[4,5]进行分组,从临床角度出发,研究种植体周围组织不同健康状况下龈沟液微生物特性。
Alpha 多样性中的Shannon 指数综合考虑了群落的丰富度和均匀度,其值越大,表示群落的多样性越高。三组样本Shannon 指数显示状况良好组最大,状况一般组次之,成功组最小。这说明状况良好组微生物多样性最大,状况一般组次之,成功组最小。目前主流观点[8,9]认为种植体周围有炎症存在时,其微生物多样性降低。本研究中状况一般组比状况良好组微生物多样性低也证明了这一观点。但对于状况良好组比成功组微生物多样性高这一结果,我们认为是种植体周围菌群平衡被破坏所致。当种植体周围有益菌和有害菌处于平衡时,种植体不易患病。一旦种植体周围健康状态受到威胁,平衡被打破导致微生态失衡,致病菌增加,即微生物多样性增加。当种植体周围健康状态破坏到一定程度,种植体周围形成以致病菌为主的生境,即种植体周围微生物多样性减少。
在细菌属水平,本研究发现产线菌属作为牙周炎重要致病菌,同样是种植体状况良好和状况一般的致病菌属,可见牙周炎和种植体状况良好及状况一般的致病菌属相似,但本研究也发现一些特殊致病菌属(如Lentimicrobium)。种植体周围健康程度与产线菌属和Lentimicrobium 的相对丰度成负相关。产线菌属可定植并侵袭牙周组织,对牙周微生物菌群产生显著影响。当患者牙周组织有炎症时产线菌属的发生率会增加,产线菌属在炎症发展中具有重要作用[10]。Tamura 等[11]也认同这一观点,他们发现产线菌属与种植体周围炎有关。更有学者认为[12],产线菌属与牙周脓肿的形成有关。Lentimicrobium 是一种发酵菌,可通过发酵复杂有机物产生H2/CO2,易被微生物利用生成乙酸、乙醇和丁酸等,导致pH 值下降[13]。严重酸性条件和过度机械应力对种植体表面涂层产生永久性破坏,导致金属碎片溶解[14,15],最后影响种植体周围健康。成功组中链球菌属、雷尔氏菌属、奈瑟菌属、鞘氨醇单胞菌属、丛毛单胞菌属和棒状杆菌属的物种相对丰度显著增加。多项研究均表明[16-18],健康种植体周围的链球菌属、奈瑟氏菌属、棒状杆菌属含量较高。奈瑟菌属是革兰阴性需氧或兼性厌氧球菌,对口腔内菌斑形成起重要作用。一定条件下,奈瑟菌属可降解菌斑内乳酸成分,转化为酸性物质。雷尔氏菌属、鞘氨醇单胞菌属和丛毛单胞菌属均是具有抗逆功能的内生细菌,无特殊情况不会产生负面特征的菌落[19]。短波单胞菌属(Brevundimonas)是革兰阴性杆菌,大量存在于种植体状况良好组。其毒力较低,感染风险不高,但一定条件下仍会引起潜在感染,甚至导致死亡[20]。
综上所述,种植体周围健康状况由良好发展到一般时,种植体周围炎症由轻到重,微生物多样性由高到低。这表明龈沟液微生物菌落在种植体周围健康状态中具有潜在作用。种植体周围组织处于成功或状况良好时,棒状杆菌属相对丰度较高,氨基酸代谢和能量代谢通路富集,这些途径可能有助于细菌的定殖和繁殖。种植体周围健康状况一般时,微生物致病菌产线菌属和Lentimicrobium相对丰度较高,免疫系统、糖的合成和代谢以及内分泌系统通路更加活跃。后续我们可以尝试研究种植体周围龈沟液菌群对宿主机体信号通路的调控。本研究为种植体周围健康状态的维护提供了理论依据和基础。
