丁酸梭菌清液发酵高密度培养工艺研究
2021-06-26邹孟琳高麒笙薛梦涵胡远亮
■邹孟琳 高麒笙 薛梦涵 程 娜 付 彪 夏 险, 胡远亮,*
(1.湖北师范大学生命科学学院,食用野生植物保育与利用湖北省重点实验室,湖北黄石435002;2.华中农业大学农业微生物学国家重点实验室,湖北武汉430070)
丁酸梭菌是一种革兰氏阳性、产芽孢的专性厌氧杆菌,广泛存在于奶酪、肠道和土壤等环境中[1-2],是人和动物肠道内的正常菌群,能够抑制肠道中某些有害微生物的生长,同时产生益生物质,在增强机体免疫力和调节肠道微生态平衡等方面发挥作用[3-5]。丁酸梭菌发酵产物以丁酸和乳酸为主,也可以产生淀粉酶、糖苷酶、蛋白酶、酯酶、纤维素酶和半纤维素酶等多种酶类,能够提高机体对营养物质的消化吸收和抗氧化能力,改善肠道屏障功能[6-7]。可应用在食品、工业、医学等多个领域[8]。
我国对丁酸梭菌的研究起步较晚。目前,国内丁酸梭菌制剂产量不足、价格昂贵、活菌数低、保质期短,难以满足市场对丁酸梭菌的需求。这些问题主要是由于丁酸梭菌培养难度大、高密度培养技术不成熟和发酵设备不先进等原因造成[9-10]。因此,丁酸梭菌规模化生产发酵技术的优化在应用市场上拥有较好的研究前景。
丁酸梭菌活菌在最终得到的商品化菌剂中大都以芽孢的形式存在[11],已有研究表明优化培养基及培养条件可以直接影响菌体的繁殖[12-13]。本研究采用单因素试验和正交试验在摇瓶中对丁酸梭菌培养基的碳源、氮源以及培养条件进行优化,并通过5 L发酵罐进一步优化接种量、温度等培养条件,以提高单位体积的丁酸梭菌芽孢数量,为丁酸梭菌制剂产业化提供依据。
1 材料与方法
1.1 菌株
丁酸梭菌(Clostridium butyricum)M1来自华中农业大学农业微生物国家重点实验室。
1.2 培养基
丁酸梭菌增殖半固体培养基:酵母浸膏3 g、牛肉浸膏10 g、胰蛋白胨10 g、葡萄糖5 g、可溶性淀粉1 g、NaCl 5 g、CH3COONa·3H2O 3 g、半胱氨酸盐酸盐0.5 g、0.5%美蓝0.2 mL、琼脂6 g,加蒸馏水溶解至1 000 mL,调节pH至(7.1±0.1),115℃灭菌20 min,备用。
基础培养基(W/V):葡萄糖(2%)、酵母浸粉(4.5%)、胰蛋白胨(1.5%)、大豆蛋白胨(1.3%)、(NH4)2SO4(0.1%)、NaHCO3(0.124%)、玉米浆粉(0.7%)、MnSO4·H2O(0.05%)、MgSO4·7H2O(0.05%)、CaCl2(0.1%),初始pH为7.5。
1.3 碳氮源优化
碳源优化。在基础培养基中,分别以1%(W/V)添加可溶性淀粉、葡萄糖、蔗糖、乳糖、果糖等小分子糖为碳源,其他成分保持不变。培养基装于250 mL三角瓶中,上覆2 cm液体石蜡,以1%接种丁酸梭菌培养液,每组3个重复。37℃培养24 h,测定OD650,确定最佳碳源。培养基其他成分保持不变,最佳碳源的添加量分别设置为1%、2%、3%、4%和5%,接种量和培养条件如1.3所述,检测OD650,优化碳源添加量。
氮源优化。以优化的碳源培养基为基础,分别以1%(W/V)添加牛肉浸粉、蛋白胨、胰蛋白胨、酵母浸粉、大豆蛋白胨为有机氮源,接种量和培养条件如1.3所述,测定OD650,优化有机氮源。此外,分别以1%(W/V)添加尿素、硫酸铵、硝酸钾、硝酸铵为无机氮源。接种量和培养条件如1.3所述,测定OD650,优化无机氮源。
有机氮源添加量优化。根据上述单因素试验氮源优化的结果,选取对丁酸梭菌生长影响最显著的3种有机氮源(酵母浸粉、胰蛋白胨和牛肉浸粉),分别设置为1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%(W/V)添加至培养基中(其他成分保持不变),接种量和培养条件如1.3所述,测定OD650,优化氮源添加量。
根据试验结果,设计3因素3水平的正交试验配制不同培养基(表1),其他成分保持不变,接种量和培养条件如1.3所述,检测OD650,优化复合有机氮源添加量。

表1 正交试验设计
1.4 接种量和温度优化
接种量。种子液分别以1%、2%、3%、4%、5%的接种量添加到优化的灭菌培养基中,每组3个重复,在37℃下恒温培养24 h取样,检测OD650,比较不同接种量得到的最终菌体生物量,优化接种量。
温度。以接种量1%添加到优化的灭菌培养基中,分别于34、37、40、43℃恒温培养,每组3个重复,对应温度下培养24 h取样,检测OD650,优化培养温度。
1.5 发酵罐培养工艺研究
厌氧培养方式。在5 L自控发酵罐中装入优化的培养基,装液系数75%。将培养好的三角瓶一级种子培养基接入灭菌后冷却的发酵罐中(37℃左右),接种量3%,控温37℃培养。分别采取在发酵罐上层覆盖2 cm的石蜡油或连续通入氮气以维持厌氧或低氧状态。培养30 h,每隔2 h取样镜检,观察芽孢形成情况,若芽孢形成率在90%以上,终止发酵。并进行芽孢计数,确定最佳厌氧培养方式。
控制pH。在发酵罐上层覆盖2 cm的石蜡油,接种方式、接种量和培养温度如1.5所述。采取自然pH发酵,或补碱分别控制pH在6.0、6.5、7.0、7.5条件下培养,发酵过程及采样方式如1.5所述。发酵结束进行芽孢计数,分析控制不同pH条件下的发酵效果,确定最佳pH。
中和剂。石蜡油密封,接种方式、接种量和培养温度如1.5所述。分别采用1 mol/L的氢氧化钠(NaOH)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)和氨水(NH3·H2O)溶液流加以控制最适pH 6.5。发酵过程及采样方式如1.5所述,发酵结束进行芽孢计数,确定最佳中和剂。
流加补料。采用碳酸氢钠(1 mol/L)流加控制最适pH 6.5,培养12 h,流加3%葡萄糖(W/V),以未补料发酵组作为对照,其他条件如1.5所述。发酵结束进行芽孢计数,分析补料对丁酸梭菌葡萄糖代谢与生长曲线的影响。
1.6 芽孢计数方法
取18 mm×180 mm的试管,装入梭菌增殖半固体培养基(0.6%)15 mL,调节pH至7.1±0.1,115℃,20 min灭菌,其上覆盖约2~3 mL无菌石蜡油密封。使用前将半固体培养基沸水浴30 min去除氧分,冷却至50℃左右接种。取混合均匀的发酵液2~3 mL,65℃水浴10 min,杀死营养体,准确吸取1 mL,用无菌生理盐水进行梯度稀释至适宜浓度,选择连续3个浓度梯度,各取200μL添加至试管培养基中,轻轻振荡均匀,每个梯度3个重复组,37℃培养16 h,肉眼观察计数。
1.7 统计分析
碳氮源、正交试验、接种量和温度优化,每组3个摇瓶重复。发酵罐培养工艺优化,每次采样3次,求平均值。运用SPSS 22.0统计软件对数据进行分析,误差线用SD表示,各组之间的差异采用Tukey’s HSD检验,以P<0.05为显著差异,统计数据可视化采用Excel 2019处理。
2 结果与分析
2.1 碳源优化(见图1)

图1 不同碳源(A)和葡萄糖浓度(B)对丁酸梭菌生长的影响
从图1A可以看出,该菌株可利用的最佳碳源为葡萄糖。微生物在生长过程中,需要一定量的碳源作为营养物质,碳源含量过低微生物缺少营养,导致其生长受到限制;过高促使培养基渗透压升高,导致微生物细胞内部水分不足,生长受阻甚至死亡。确定最佳碳源为葡萄糖,进一步优化其添加量,结果表明最适添加量为3%(图1B)。
2.2 氮源优化(见图2)
从图2A可以看出,在有机氮源中,该菌株对酵母浸粉、胰蛋白胨和牛肉浸粉的利用效果最好;在无机氮源中,该菌株对硫酸铵的利用效果最好。考虑到迟效、速效氮源相结合能达到更好的效果[14],因此选择酵母浸粉、胰蛋白胨和牛肉浸粉,分别与硫酸铵(0.1%)作为复合氮源。结果表明,酵母浸粉、胰蛋白胨和牛肉浸粉的最适添加量分别为2.5%、3.0%和3.0%(图2B~图2D)。

图2 不同氮源对丁酸梭菌生长的影响
根据单因素氮源试验,酵母浸粉、胰蛋白胨和牛肉浸粉对丁酸梭菌的生长影响最为显著。以这3个因素设计正交试验研究复合氮源对丁酸梭菌M1生长的影响,确定最佳的氮源组合。综合表2和表3的极差、方差分析可知,极差顺序为:RA>RB>RC,方差检验显著性为A>B>C。由此得出这3个因素对该菌株生长影响大小依次为:酵母浸粉>胰蛋白胨>牛肉浸粉,各因素方差P均大于0.05,证明该水平试验中3个因素均对结果不显著(P>0.05)。由此确定正交试验的理论最优组合为A2B2C3,该组合正好在9组试验中,最佳有机碳源组合为:酵母浸粉1.5%,胰蛋白胨2%,牛肉浸粉2.0%和3.0%。

表2 正交试验结果
综上对碳氮源优化试验结果进行统计,得出优化培养基为:葡萄糖3%,酵母浸粉1.5%,胰蛋白胨2.0%,牛肉浸粉3.0%,(NH4)2SO40.1%,NaHCO30.124%,玉米浆粉0.7%,MnSO4·H2O 0.05%,MgSO4·7H2O 0.05%,CaCl20.1%,初始pH 7.5。
2.3 接种量和温度优化(见图3)
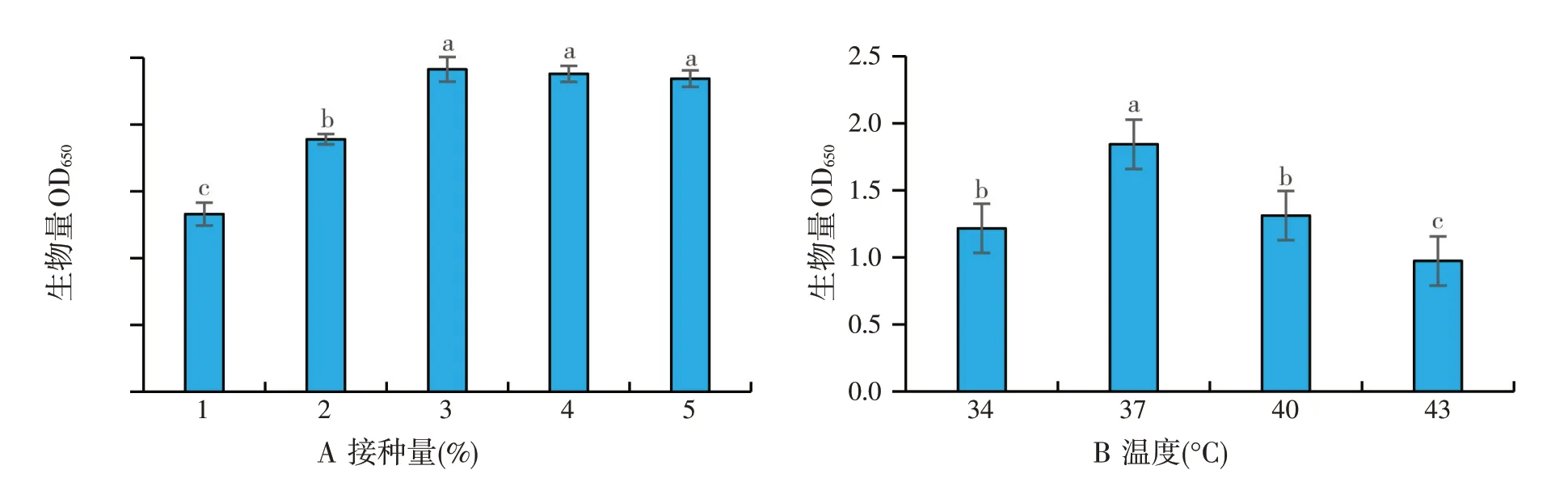
图3 不同接种量(A)和温度(B)对丁酸梭菌生长的影响
从图3可以看出,优化后培养基最适接种量3%,最适培养温度37℃。
2.4 发酵罐培养工艺研究
厌氧培养方式对丁酸梭菌生长的影响结果表明,添加石蜡油菌体生长更好,结束时发酵液芽孢数为3.1×108CFU/mL(图4A);控制pH发酵影响丁酸梭菌生长,补碱控制pH发酵条件下的芽孢数明显高于自然pH条件下发酵。丁酸梭菌在生长代谢过程中产生丁酸、乙酸等酸性物质,这些物质使得培养基的pH迅速降低,抑制了丁酸梭菌的生长[15],补碱控制pH能解除这种抑制,促进丁酸梭菌生长,符合王勇等[16]研究出的人为补碱可以提高丁酸梭状芽孢杆菌作用发酵能力的结论。其中,将pH控制在6.5时丁酸梭菌发酵效果最好,最终发酵液芽孢数为3.8×108CFU/mL(图4B);中和剂对丁酸梭菌生长的影响表明,以NaHCO3为中和剂将pH控制在6.5时发酵效果最好,最终发酵液芽孢数为4.6×108CFU/mL(图4C)。
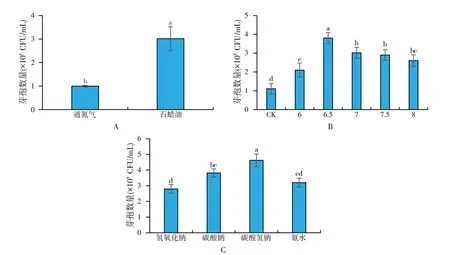
图4 厌氧培养方式(A)、pH控制(B)和中和剂(C)对丁酸梭菌芽孢数的影响
丁酸梭菌发酵罐培养检测表明,发酵液中葡萄糖的含量在4 h起迅速下降,在12 h含量几乎为0,丁酸梭菌芽孢数量在20 h达到稳定期,维持在6.0×108CFU/mL左右(图5A)。这说明从12 h开始,发酵液中葡萄糖含量不能满足丁酸梭菌快速生长的需要。因此,设计在第12 h流加3%的葡萄糖溶液(W/V)进行补料发酵,并绘制葡萄糖含量与芽孢数量变化曲线(图5B)。可以看出,丁酸梭菌生长稳定期延迟,芽孢数量提高,培养24 h,发酵液的丁酸梭菌芽孢数量提高至1.19×109CFU/mL,培养36 h达1.32×109CFU/mL。

图5 补料对丁酸梭菌葡萄糖代谢与生长曲线的影响
3 讨论
2006年,欧盟全面禁止在饲料中添加抗生素。紧随其后,许多国家制定了相关的畜产品药物残留标准,限制或禁止在动物饲料中添加抗生素[17],2009年7月,农业农村部批准了丁酸梭菌为新饲料添加剂[18]。目前,不少研究证实微生物饲料添加剂代替饲用抗生素能够取得较好的效果[19-20]。丁酸梭菌作为新饲料添加剂,具有较强的抗生素耐受性,与抗生素联用时受影响较小[21],在抑制动物腹泻、增强动物免疫能力等方面展现出积极作用[22-23]。此外,丁酸梭菌在治疗骨质疏松、肥胖症和高尿酸血症等人体健康方面取得了较好的成效[24-26]。
丁酸梭菌生产有厌氧液态发酵、厌氧固态发酵和厌氧混菌发酵3种主要方式[27]。通常,工业上生产采用的液态培养基中,添加了大豆饼粉等缓冲能力较强的营养物质,而清液发酵培养基不宜采用大豆饼粉,因此缓冲能力较差。但清液发酵后期菌体收集更加简便,生产成本更为低廉[28]。本研究中,采用单因素试验对丁酸梭菌初始培养基的碳氮源进行筛选和浓度优化,结果表明最佳碳源为葡萄糖,有机氮源为酵母浸粉,无机氮源为硫酸铵。最佳碳源与戚薇等[29]优化碳源结果基本一致,与刘磊等[9]研究结果最佳碳源为葡萄糖、有机氮源为蛋白胨、无机氮源为硫酸铵的结果大致相符合。
丁酸梭菌发酵过程中有机酸的产生与积累是引起发酵液pH值下降的主要原因。根据丁酸梭菌发酵液pH变化曲线和菌体生长曲线特性显示,菌体生长速度和pH值变化密切相关。为了维持菌体生长速度,后续采用碳酸氢钠作为中和剂,结果显示控制pH 6.5,丁酸梭菌生长最佳;樊晓璐等[30]发现丁酸梭菌在pH值6~7范围内生长良好,而邱权等[11]研究则表明丁酸梭菌在中性或偏碱的环境中生长更好,其结果的差异可能与丁酸梭菌菌株特性及培养方式有关。丁酸梭菌发酵过程中存在碳溢流代谢现象并会出现碳源供应不足的问题[31]。本试验中优化后培养基在发酵12 h后葡萄糖含量几乎为0,在流加控制pH的基础上,第12 h流加补料3%葡萄糖,可使丁酸梭菌发酵稳定期延迟。
通常情况下,丁酸梭菌的发酵水平在数量级109以下,个别生产厂商经过喷雾干燥工艺制得的粉状产品有效活菌数可达1×1010CFU/g。本研究在单因素试验优化培养基碳氮源基础上,通过正交试验进一步优化培养基碳氮源组合。发酵罐优化过程中,采用碳酸氢钠溶液流加控制pH和葡萄糖补料的方式,解决了发酵过程中pH不稳定和碳溢流代谢等问题,最终使得优化的丁酸梭菌发酵液的芽孢数量大幅提高,培养36 h,芽孢数量达1.32×109CFU/mL。
4 结论
通过单因素试验和正交试验,优化的培养基及培养条件:葡萄糖3%、酵母浸粉1.5%、胰蛋白胨2.0%、牛肉浸粉3.0%、(NH4)2SO40.1%、NaHCO30.124%、玉米浆粉0.7%、MnSO4·H2O 0.05%、MgSO4·7H2O 0.05%、CaCl20.1%,初始pH 7.5,培养温度37℃,接种量3%。在发酵罐培养中,采用碳酸氢钠控制pH 6.5,第12 h流加补料3%的葡萄糖,发酵液芽孢含量大幅度提高。本研究为丁酸梭菌实验室培养及产业化提供依据。
