植物激素处理对翅碱蓬种子萌发的影响
2021-06-25陈佳勃王艳杰
向 亮,陈佳勃*,王艳杰*,赵 迎
(1.辽宁石油化工大学环境与安全工程学院,辽宁 抚顺 113001;2.辽宁石油化工大学石油化工学院,辽宁 抚顺 113001)
翅碱蓬(Suaedasalsa)作为藜科碱蓬属一年草本植物,广泛分布于滨海潮滩湿地[1-3],在土壤降盐[2- 3]、改善理化性质[4-6]、修复重金属[7-8]与石油烃[9-10]污染和维持湿地生态系统正常演替[11-12]等方面发挥重要作用。近十几年来,随着人类活动影响逐渐加剧,辽河口湿地翅碱蓬出现严重退化现象,导致湿地面积大幅度减少,造成湿地生态功能明显降低、生物多样性锐减[13-16]。保护和恢复辽河口湿地生态系统的完整性和稳定性,特别是开展翅碱蓬等典型湿地植物的保护与恢复,对保障辽河口湿地的生态安全、提高湿地的生物多样性具有十分重要的意义。
翅碱蓬在种子萌发期对土壤中盐度[17]、水分[18]、重金属[19]和多环芳烃[20]等污染物较为敏感,极大地限制了翅碱蓬湿地的生态恢复与重建。种子萌发是植物有性繁殖的重要表现,适宜的种子预处理方式可以提高种子发芽率,加速种子萌发,缩短萌发期种子在污染环境条件下的滞留时间,进而提高退化湿地生态恢复与重建的效率[21]。
促进种子萌发的预处理方法一般分为物理法和化学法。物理方法如机械破坏种皮、低温层积、沙藏和光照等,虽然能够在一定程度上促进种子的萌发,但存在工作量大、处理时间过长和作用不明显等缺陷[22-24]。化学方法是利用化学药剂对种皮破坏或改变种子内部生理活动,从而促进种子萌发。传统的化学药剂虽然能明显促进种子萌发,但仍存在对不同种子促进程度差异大和过量使用污染环境等问题[21, 25-26]。而植物激素作为植物体内的信号分子,对植物的生理周期起到调节和稳定的作用,尤其是赤霉素(GA)、吲哚乙酸(IAA)和激动素(KT)等植物生长促进型激素在植物萌芽期对种子的萌发和种胚的发育具有显著促进作用[27-30]。此外,与物理、化学方法相比,植物激素处理具有操作方便和无环境污染的优点,从而引起国内外学者广泛关注,而用其处理翅碱蓬种子未见报道。本研究通过水培实验分析了GA、IAA和KT 3种植物激素对翅碱蓬种子萌发的影响,旨在探究翅碱蓬种子快速萌发和提高发芽率的方法,为辽河口翅碱蓬湿地退化区的恢复与重建提供科技支撑。
1 材料与方法
1.1 实验材料与药剂
翅碱蓬种子采自辽河口翅碱蓬湿地,挑选成熟饱满的种子供本实验所用。采用的赤霉素(GA 96%)、吲哚乙酸(IAA 98%)和激动素(KT 99%)均为上海麦克林生化科技有限公司生产生物技术级试剂,纯水由实验室纯水机制备。
1.2 研究方法
1.2.1翅碱蓬种子形态特征及主要生理指标的测定
种子的千粒重测定:随机取翅碱蓬种子1 000粒称重,重复8次,取平均值为千粒重,计算标准差和变异系数[23]。种子的吸水率测定:随机称取3份一定量的翅碱蓬种子加入纯水室温浸泡,0—2 h时间内每0.5 h取一次,2—6 h时间内每2 h取一次,6 h以后每6 h取一次,从培养箱中取出种子并用滤纸吸干表面水分,测定种子质量,直至种子质量不再发生变化即得种子吸水率。种子的活力测定:采用氯化三苯基四氮唑(TTC)染色法[31]。
1.2.2实验步骤
配制50、100、150和200 mg/L GA溶液,1.0、1.5、2.0和2.5 mg/L IAA溶液,5、10、15和20 mg/L KT溶液为翅碱蓬种子浸种处理液,并以纯水作为对照。取20粒翅碱蓬种子于烧杯,分别加入配制的处理液,室温浸种处理12、24、36、48 h,每组设3个重复。将浸种处理后的种子取出用纯水反复淋洗,并参照文献进行水培萌发实验[19, 20]。
各处理组的种子放入垫有双层滤纸的90 mm培养皿中,加入纯水以保持滤纸湿润,置于植物培养箱(PRX-450A,江苏天翎仪器有限公司)中进行萌发实验。培养条件为光照12 h,光强3 000 lx,温度(25±1) ℃;黑暗12 h,温度(20±1) ℃;相对湿度统一为75%。每天定时记录各处理组种子发芽个数,以黑色种子破皮作为发芽标准。实验期间适时向培养皿定量添加纯水以保持滤纸湿润。
1.2.3萌发指标的测定
翅碱蓬种子的萌发指标有发芽率和萌发速率[21],公式如下:

(1)
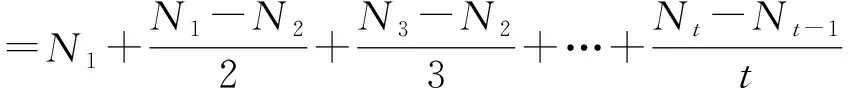
(2)
式中Nt——t日翅碱蓬种子发芽的百分率。
1.2.4统计分析与作图
数据统计分析与绘图分别采用SPSS22.0软件和EXECL2010软件,数据以均值±标准误表示;采用单因素方差分析(One-way ANOVA)进行差异显著性分析,并用Duncan法于0.05显著度水平进行多重比较。
2 结果与分析
2.1 翅碱蓬种子形态特征及主要生理指标
翅碱蓬种子外观呈黑色,近似球型,粒径较小。种子千粒重为0.240 2±0.007 3 g,变异系数为3.0(小于4.0),符合实验要求。种子含水率对种子萌发意义重大,含水率达到一定程度,种子内部原生质转化为溶胶状态,且种子的呼吸作用显著增强,打破种子的休眠状态[32]。吸水实验表明,翅碱蓬种子吸水率呈先快后慢,而后稳定的增长趋势;0—6 h内吸水率快速升高,于6 h时达到28.54%;6 h以后,种子吸水率增速明显减缓,于18 h吸水率稳定,为34.60%;说明翅碱蓬种子的种皮不存在阻水作用。种子活力测定表明,翅碱蓬种子染色率能达98%以上,说明种子活力高。
2.2 不同植物激素处理对翅碱蓬种子发芽率的影响
对实验数据进行分析处理,由图1可知,3种植物激素处理翅碱蓬种子的发芽率随浓度和时间总体均呈先上升后下降的趋势。与对照处理相比,适宜浓度的GA、IAA和KT溶液处理的发芽率在12 h处理时间下分别增长17.65%、17.65%和9.80%,在24 h处理时间下分别增长15.38%、15.38%和3.84%,在36 h处理时间下分别增长20.00%、20.00%和2.00%,在48 h处理时间下分别增长22.44%、22.44%和20.33%。
由图1a可知,除50 mg/L GA溶液在12、36 h处理时间外,其余各浓度下不同处理时间的发芽率均无显著差异(P>0.05),说明GA处理方法的不同处理时间对发芽率无明显作用;在4种处理时间条件下,100 mg/L GA溶液相比于对照处理发芽率均有显著差异(P<0.05)。由图1b可知,除2.5 mg/L IAA溶液在12、24 h处理时间外,其余各浓度下不同处理时间的发芽率均无显著差异(P>0.05),说明IAA处理方法的不同浸种时间对发芽率无明显作用;在4种处理时间条件下,1.5 mg/L IAA溶液相比于对照处理发芽率均有显著差异(P<0.05)。由图1c可知,各浓度KT溶液在不同处理时间的发芽率均无显著差异(P>0.05),说明KT处理方法的不同处理时间对发芽率无明显作用;仅在12 h处理时间下,10 mg/L KT溶液相比于对照处理发芽率有显著差异(P<0.05)。
结果表明(图1),100 mg/L GA溶液、1.5 mg/L IAA溶液和10 mg/L KT溶液处理的发芽率相比于对照处理有显著差异,为最佳浸种浓度;3种植物激素在最佳浓度下不同浸种时间对翅碱蓬种子发芽率均无明显作用。
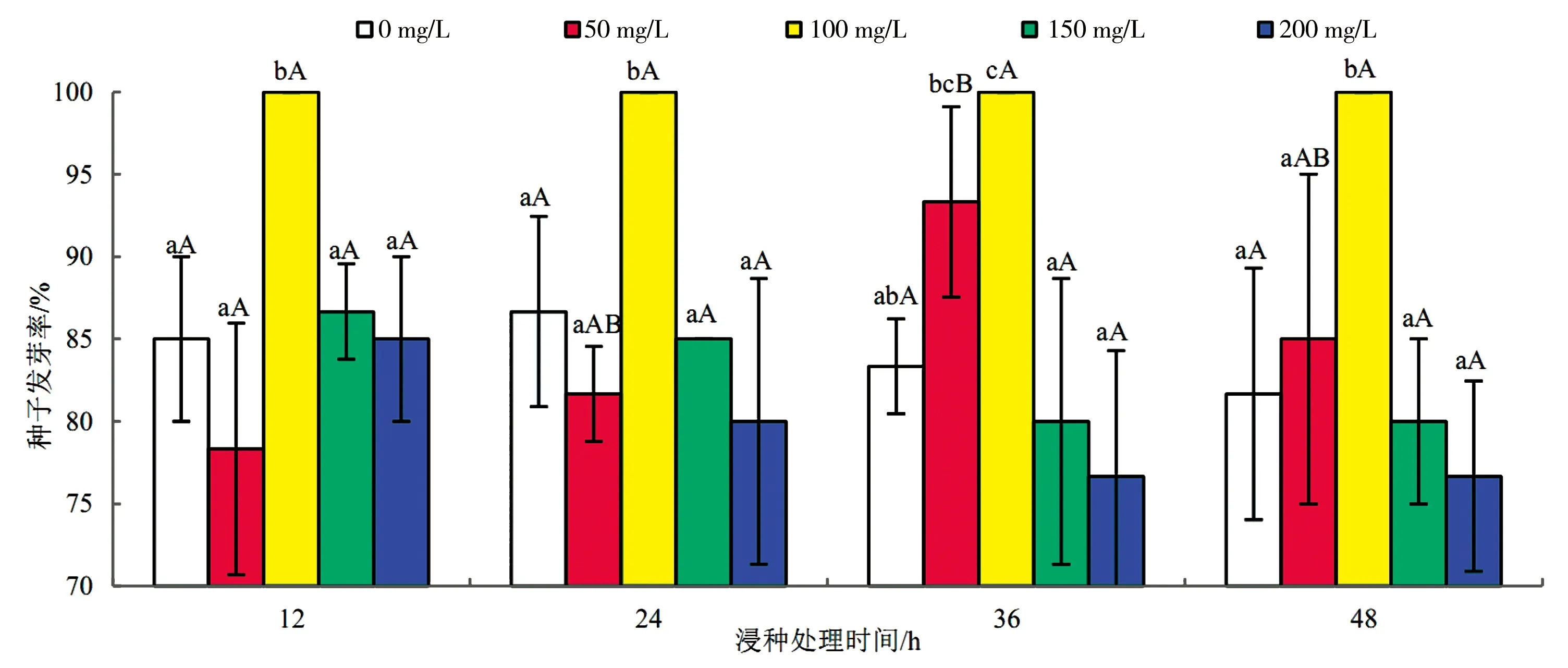
a)GA浸种处理
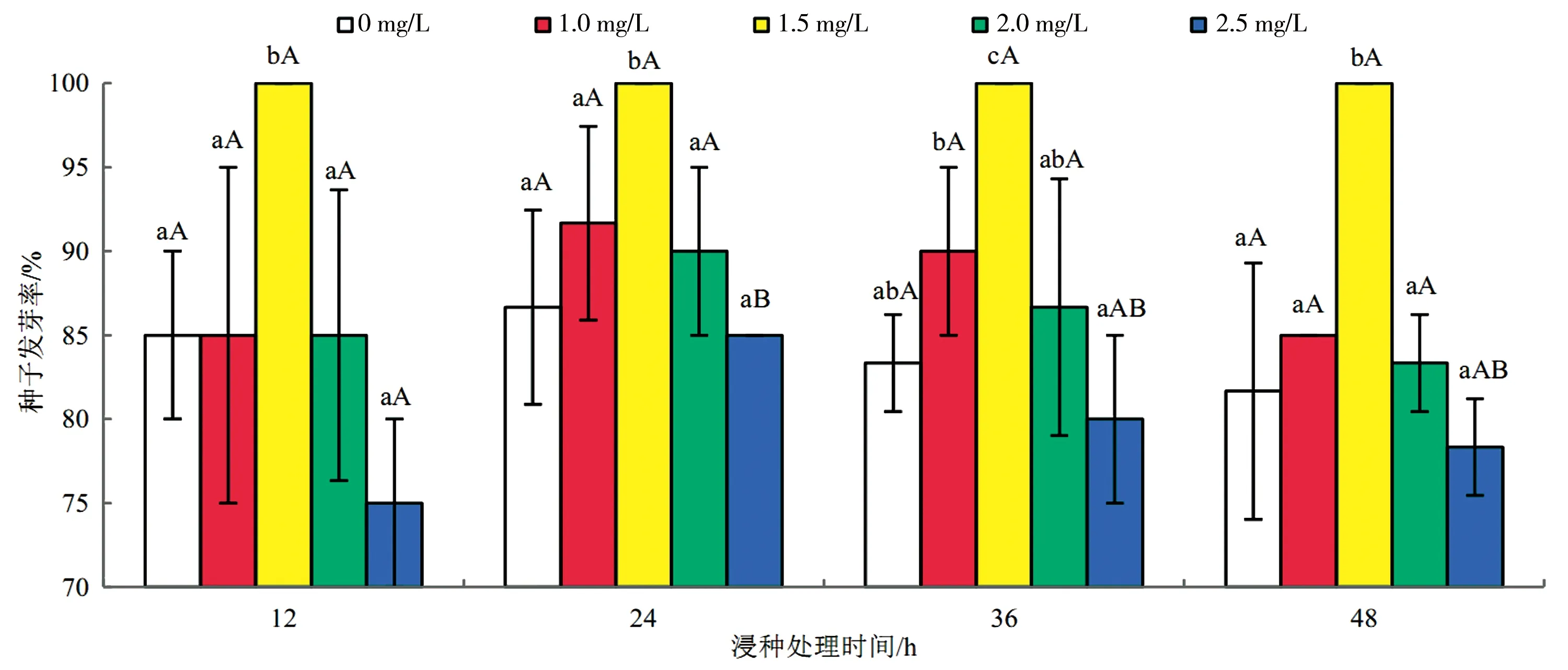
b)IAA浸种处理

c) KT浸种处理
2.3 不同植物激素处理对翅碱蓬种子萌发速率的影响
对实验数据进行分析处理,由图2a可知,翅碱蓬种子萌发速率随GA溶液的浓度增加呈先上升后下降趋势,在不同处理时间条件下均于100 mg/L GA溶液浓度时萌发速率达到最大值,且与对照处理相比明显增加(P<0.05);在不同浓度的GA溶液处理条件下萌发速率随浸种时间呈先升后降趋势,100 mg/L GA溶液浸种36 h与12、24、48 h相比明显增加(P<0.05)。由图2b可知,IAA处理翅碱蓬种子萌发速率随浓度和时间变化与GA处理一致,在不同处理时间条件下均于1.5 mg/L IAA溶液浓度时萌发速率达到最大值,且与对照处理相比均有明显增加(P<0.05);1.5 mg/L IAA溶液浓度下各浸种时间的萌发速率无显著差异(P>0.05),虽然24 h处理时间下萌发速率达到最大值,但相比于对照处理仅增加95.63%,低于12 h浸种时间下涨幅136.84%。由图2c可知,12、24 h处理时间下萌发速率随KT溶液的浓度增加呈先上升后下降趋势,36、48 h处理时间条件下萌发速率随KT溶液的浓度增加呈下降趋势;在10 mg/L KT溶液浸种24 h处理条件下萌发速率达到最大值,相比于对照处理增加23.20%,与10 mg/L KT溶液浸种12 h处理条件无显著差异(P>0.05),但10 mg/L KT 浸种12 h处理条件与对照处理相比增加55.79%。
结果表明(图2),GA处理在低浓度下处理时间对翅碱蓬种子萌发速率有明显作用,高浓度无明显作用;IAA处理则与GA处理结果相反;KT处理浸种时间对翅碱蓬种子萌发速率有明显作用,且随着浸种时间延长,浓度越高促进作用降低越明显,甚至降低萌发速率。3种植物激素处理翅碱蓬种子的萌发速率最佳条件分别为:100 mg/L GA溶液处理36 h,1.5 mg/L IAA溶液处理12 h,10 mg/L KT溶液处理12 h。

a)GA浸种处理

b)IAA浸种处理
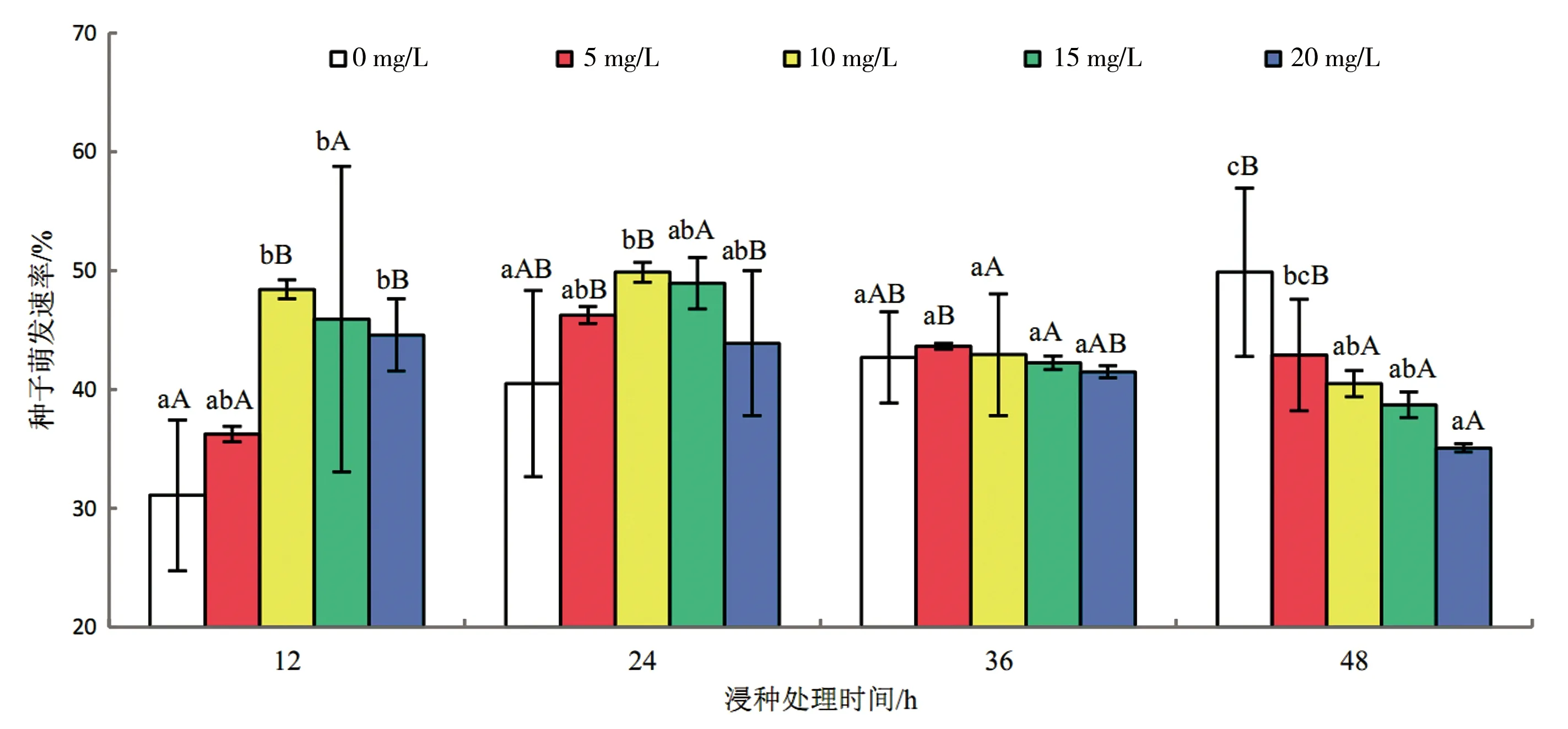
c)KT浸种处理
3 讨论
图1和2显示,低浓度GA处理下浸种时间对翅碱蓬种子发芽率和萌发速率均有影响,这由于GA溶液的浓度过低不足以短时间内促进翅碱蓬种子的萌发;高浓度的IAA处理下浸种时间对翅碱蓬种子发芽率和萌发速率均有影响,这由于IAA溶液浓度过高导致对翅碱蓬种子萌发的促进作用下降;KT处理下浸种时间对翅碱蓬种子发芽率无明显差异,仅对萌发速率有明显的促进作用,并随着浸种时间延长浓度越高促进作用下降越明显,说明KT处理对翅碱蓬种子萌发促进作用较小。
GA主要作用是促进细胞的伸长与分裂,可打破植物种子的休眠,催化种子内部贮藏物质降解,以供胚的生长发育[33-34]。结果表明,GA处理对翅碱蓬种子的发芽率和萌发速率起到显著的促进作用,100 mg/L GA溶液处理36 h条件下发芽率和萌发速率均达到最大值,相比于对照处理分别提高20.00%和79.60%。这由于翅碱蓬种子属于浅度生理休眠,种皮保持良好的透水性,GA通过种皮进入种子内部参与生理活动,进而促进种子的萌发。IAA是一类含有一个不饱和芳香族环和一个乙酸侧链的内源激素,具有调节生长速率、抑制侧芽、促进生根等作用[35]。结果表明,适宜浓度的IAA溶液处理翅碱蓬种子能够对种子萌发起到显著的促进作用,1.5 mg/L IAA溶液处理12 h条件下翅碱蓬种子萌发效果最佳,与对照相比发芽率和萌发速率分别提高17.65%和136.84%,2.0、2.5 mg/L IAA处理的发芽率和萌发速率则下降明显,这与刘伟等[35]、宋科等[36]等人研究结果相似。这说明高浓度IAA影响种子内部生理活动,从而对种子的萌发促进作用逐渐减弱,甚至产生抑制作用。与对照处理相比,最佳条件下IAA处理的翅碱蓬种子的发芽率涨幅虽然略低于GA处理,但两者的发芽率相同,说明纯水浸种时间不同发芽率略有差异。KT是一种内源的细胞分裂素,除具有促进细胞分裂的作用外还具有延缓离体叶片和切花衰老、诱导芽分化和发育及增加气孔开度的作用[37]。结果表明,适宜条件的KT处理可以明显促进翅碱蓬种子的萌发,10 mg/L KT溶液处理12 h条件下翅碱蓬种子萌发效果最佳,与对照相比发芽率和萌发速率分别提高9.80%和55.79%,在36和48 h处理时间下10、15和20 mg/L浓度出现抑制作用,这与施和平等[38]的研究结果相似。这说明低浓度KT处理对翅碱蓬种子萌发起一定促进作用,小于GA和IAA处理,并在高浓度下对种子萌发起抑制作用。
4 结论
a)低浓度GA处理条件和高浓度IAA处理条件下,浸种时间对翅碱蓬种子萌发有显著作用;KT处理浸种时间对翅碱蓬种子发芽率无明显作用,对萌发速率有明显作用。
b)3种植物激素在适宜条件下对翅碱蓬种子萌发有显著影响,最佳的条件分别为:100 mg/L GA溶液处理36 h,1.5 mg/L IAA溶液处理12 h,10 mg/L KT溶液处理12 h。与对照相比,3种激素在最佳条件下翅碱蓬种子发芽率和萌发速率分别提高20.00%和79.60%,17.65%和136.84%,9.80%和55.79%。
c)适宜条件的GA、IAA和KT溶液处理能明显提高翅碱蓬种子的发芽率和萌发速率。
