腹腔镜胃癌根治术后胰瘘发生率及其影响因素
2021-06-25塔斯肯巴合提李树春何子锐薛佩马君俊臧潞郑民华
塔斯肯·巴合提,李树春,何子锐,薛佩,马君俊,臧潞,郑民华
上海交通大学医学院附属瑞金医院普通外科 上海市微创外科临床医学中心,上海 200025
胃癌是中国常见的恶性肿瘤之一,在我国恶性肿瘤死因中排第3位[1]。目前D2淋巴结清扫是胃癌的标准治疗方式,手术方式有开放式和腹腔镜手术,其中对于中下部早期和进展期胃癌行腹腔镜远端胃癌根治术已被证实是安全可行的[2-3]。近年来,腹腔镜胃癌根治术后并发症如术后出血、吻合口漏、吻合口狭窄等发生率均较低,但术后胰瘘发生率仍较高[4]。胃癌术后胰瘘常发生于术中清扫胰周淋巴结时误伤胰腺、钝性分离胰腺包膜损伤胰腺或腹腔镜器械钳夹和长时间压迫胰腺等情况[5]。由于胰液的消化作用,严重的胰瘘常继发腹腔感染、术后出血、吻合口漏等严重并发症,甚至危及生命[6]。因此早期发现胃癌根治术后胰瘘的发生,加强围术期监护至关重要。本文旨在研究腹腔镜胃癌根治术后胰瘘的发生率及其危险因素,为识别术后胰瘘发生的高危病例提供依据。
资料与方法
一、研究对象及纳入排除标准
采用回顾性分析的方法,选取2018年1月至2020年11月于我院行腹腔镜胃癌根治术的290例病人。纳入标准:(1)术前电子胃镜活检病理证实为胃腺癌;(2)术前评估排除远处转移;(3)行腹腔镜胃癌根治术。排除标准:(1)术中发现转移行探查或姑息治疗;(2)腹腔镜手术中转开腹;(3)残胃癌;(4)行胰腺或脾脏联合切除;(5)急诊手术。
二、研究方法
(一)围手术期处理
1.术前处理 所有病人经过术前评估,完善术前全血细胞计数,血生化,凝血功能,消化道肿瘤指标,心电图,高龄病人完善心脏超声及肺功能。常规行胃癌术前分期CT检查评估胃癌肿瘤部位、淋巴结转移、周围侵犯及排除远处转移。
2.手术方式 手术方式分为腹腔镜辅助胃癌根治术和全腹腔镜胃癌根治术,胃切除范围分为全胃切除和远端胃大部切除,根据术前辅助检查和术中探查所见决定手术方式和切除范围。淋巴结清扫范围均为D2淋巴结清扫。本研究的手术均由高年资医生主刀,可保证手术质量同质性。
(二)术后引流液淀粉酶测定
测定术后第1天、术后第3天、术后第5天的引流液淀粉酶,多根引流管淀粉酶测定选取最高值。
(三)研究指标
记录纳入分析的病人临床病理信息及术中情况,如年龄、性别、腹部手术史、新辅助治疗情况、手术时间、手术切除范围、分化类型和淋巴结清扫数目等。
(四)胰瘘评价标准
胰瘘诊断主要依据国际胰腺外科研究组(ISGPS)最新发布的2016版术后胰瘘的定义和分级系统[7],分为生化瘘、B级术后胰瘘和C级术后胰瘘。生化瘘:引流液中淀粉酶浓度>血清淀粉酶浓度正常值上限3倍,无需额外治疗;B级术后胰瘘:引流液中淀粉酶浓度>血清淀粉酶浓度正常值上限3倍,引流管放置时间>3周,需经皮或经内镜穿刺引流,需血管造影介入检查或治疗术后出血,有术后胰瘘相关感染征象,无器官衰竭;C级术后胰瘘:B级胰瘘基础上需再次手术,出现器官衰竭或死亡。
三、统计学方法

结 果
一、临床病理信息
研究共纳入290例腹腔镜胃癌根治术病人,无胰瘘者224例,胰瘘66例,胰瘘总发生率为22.8%(66/290),其中生化瘘发生率为21.4%(62/290),B级胰瘘发生率为1.4%(4/290),无C级胰瘘病例。
无胰瘘、生化瘘、B级胰瘘三组病例在年龄、性别、组织学分化类型、TNM分期及淋巴结清扫数目方面差异均无统计学意义(均P>0.05);但三组病例在体质量指数(BMI)、腹部手术史、新辅助化疗、阳性淋巴结数目和引流液淀粉酶浓度方面的差异均有统计学意义(均P<0.05),见表1。组间分析提示B级胰瘘组病例的BMI、新辅助化疗比例、腹部手术史比例、清扫淋巴结阳性数显著高于无胰瘘及生化瘘组病例(P<0.05)。
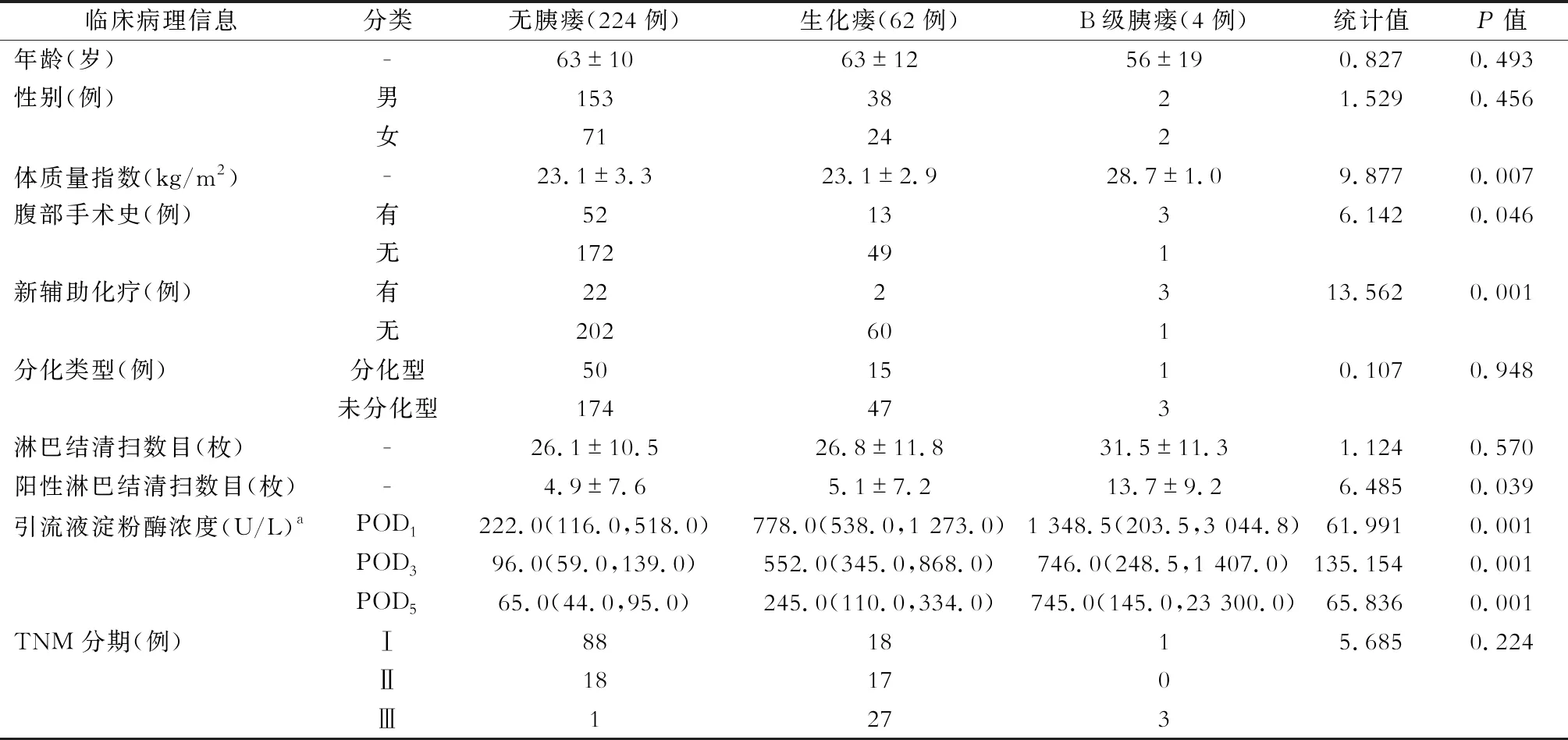
表1 三组病例临床病理信息对比
二、手术相关信息
三组病例的手术方式、胃切除范围、联合脏器切除及术中出血量差异均无统计学意义(均P>0.05)。三组病例的手术时间差异有统计学意义(P<0.05),组间分析提示B级胰瘘组病例的手术时间显著高于无胰瘘及生化瘘组病例(P<0.05)。见表2。
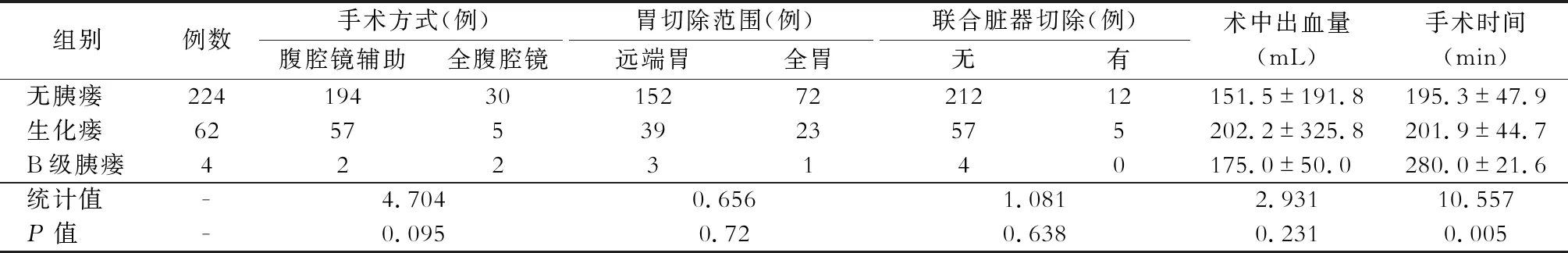
表2 三组病例手术相关信息对比
讨 论
已有多个临床研究证实了腹腔镜胃癌根治术的围术期安全性和远期生存率非劣于开放手术[2-3]。术后胰瘘是胃癌根治术后的并发症之一。根据ISGPS于2016年发布的术后胰瘘的诊断和分级标准,术后胰瘘分为生化瘘、B级胰瘘和C级胰瘘[7],生化瘘代替了以前评为A级术后胰瘘,生化瘘不再被认为是真正的胰瘘或术后并发症,因为引流液淀粉酶含量达到诊断标准而未影响临床治疗过程和预后。既往报道胃癌术后胰瘘的发生率显示生化瘘、B级胰瘘和C级胰瘘发生率分别为19.6%、1.1%~5.4%和0.4%~6.5%[8-11]。其中腹腔镜胃癌根治术后B级胰瘘发生率为1%左右[12-13]。我国开展的胰瘘多中心研究[8]提示腹腔镜手术可以降低术后胰瘘的发生,腹腔镜对手术视野有放大作用,提高了解剖的精细程度,减少胰腺损伤的可能性。本研究提示腹腔镜胃癌根治术后胰瘘总发生率为22.8%,生化瘘发生率为21.4%,B级胰瘘发生率为1.4%,无C级胰瘘病例,与既往报道相似。术后胰瘘可导致胰液流入游离腹腔,胰液具有腐蚀性,被激活后腐蚀周围的组织或者血管,可以导致严重的腹腔感染、吻合口漏或者腹腔大出血,延长病人的住院时间、增加病人经济负担甚至导致死亡。所以降低胃癌根治术后胰瘘的发生,一直是国内外临床研究的热点之一。生化瘘仅有引流液淀粉酶浓度升高,并未改变治疗决策,也不影响病人术后恢复。本研究中B级胰瘘病人经给予生长抑素及其类似抑酶药物、延长引流管留置时间及营养支持等治疗后均治愈。
日本学者Tanaka等[14]对肥胖病人的胃癌术后胰瘘发生率研究提示:高内脏脂肪面积(VFA)是胃癌根治术后胰瘘发生的独立危险因素。Nobuoka等[15]对740例行全胃切除术的病人进行分析,结果提示高三酰甘油为胃癌术后发生胰瘘的危险因素。本文中B级胰瘘组病人的BMI显著高于无胰瘘和生化瘘组病人(P<0.05)。高BMI病人内脏脂肪多,胰腺组织与脂肪常常分界不清,清扫No.6淋巴结时可能会误将胰腺组织视为脂肪组织切除从而导致术后胰瘘的发生。本文病例中既往有腹部手术史的病人B级胰瘘发生率较高,既往腹部手术可致腹腔内脏器产生粘连,导致解剖层次不清,增加胰腺损伤的可能性,从而发生术后胰瘘。
美国麻省总医院回顾性分析了1995至2014年收治的453例食管胃结合部肿瘤病人[16],结果显示,与单纯手术相比,新辅助化疗并未显著增加术中并发症与术后死亡的风险。唐兆庆等[8]对2 089例行胃癌根治术的病例进行分析,结果提示新辅助化疗不是胃癌术后B级胰瘘的危险因素。本研究中B级胰瘘组的新辅助化疗比例高于生化瘘和无胰瘘组(P<0.05),新辅助化疗后可导致术区组织水肿,解剖难度增加,胰腺损伤和胰瘘发生的可能性增加。本研究中B级胰瘘组的阳性淋巴结数显著高于生化瘘和无胰瘘组(P<0.05)。胃周淋巴结转移,尤其是幽门下区淋巴结和胰腺上缘淋巴结转移,会增大淋巴结的清扫难度。转移的淋巴结可能与胰腺粘连紧密,清扫淋巴结时增加胰腺损伤的可能性,增加胰瘘的发生率。
手术时间对胃癌根治术后胰瘘的发生有明显影响,Jiang等[11]对798例行腹腔镜辅助胃癌根治术病人的资料进行分析, 结果提示术后发生胰瘘组的手术时间较未发生胰瘘组明显延长[(251.3±46.7) min比(229.7±53.9) min,P=0.022]。本研究中B级胰瘘组手术时间显著延长,与既往研究相同。Ida等[5]研究发现腹腔镜手术时,腔镜钳长时间压迫胰腺可以导致腹腔引流液淀粉酶浓度显著升高,提示术中腹腔镜器械不当压迫胰腺可能会促进胰瘘的发生。B级胰瘘组病人的手术时间延长可能会导致腹腔镜器械压迫胰腺的时间延长,从而导致胰瘘的发生。
综上所述,腹腔镜胃癌根治术后B级和C级胰瘘发生率较低,但对BMI高、有腹部手术史、有新辅助化疗史、阳性淋巴结数目多和手术时间长的病例,仍应警惕B级胰瘘的发生。
