大柴胡汤及其“方剂要素”对NAFLD模型大鼠“肠-肝轴”作用的相关分析
2021-06-24王敏周璐孙燕陈琳吴梦瑶张鑫蕾张淑静高誉珊杨佳敏郑丰杰李宇航
王敏 周璐 孙燕 陈琳 吴梦瑶 张鑫蕾 张淑静 高誉珊 杨佳敏 郑丰杰 李宇航

摘要 目的:對大柴胡汤及其“方剂要素”对NAFLD模型大鼠“肠-肝轴”作用机制进行相关分析,揭示大柴胡汤的配伍规律。方法:105只大鼠分为正常组、模型组、盐酸吡格列酮组、疏肝利胆组、健脾化痰组、通腑泄浊组、大柴胡汤组,按照方法造模及给药,检测“肝轴”及“肠轴”相关指标,采用Critic法进行综合评价。结果:与正常组比较,模型组“肝轴”以及“肠轴”各个指标权重之和Z总1、Z总2差异均有统计学意义(P<0.05);与模型组比较,盐酸吡格列酮组、疏肝利胆组、通腑泄浊组以及大柴胡汤组“肝轴”各个指标权重之和Z总1差异均有统计学意义(P<0.05),盐酸吡格列酮组、健脾化痰组、通腑泄浊组以及大柴胡汤组“肠轴”各个指标权重之和Z总2差异有统计学意义(P<0.05)。肠道菌群分析显示,通腑泄浊方剂要素对改善NAFLD模型大鼠肠道菌群优势显著,能提高NAFLD大鼠肠道菌群中拟杆菌属、萨特氏菌属、假丁酸弧菌属细菌和Akkermansia muciniphila等有益菌的相对丰度。结论:大柴胡汤中疏肝利胆方剂要素主要通过疏利肝胆作用显著调节肝脏脂质代谢以及肝脏免疫功能,即调节“肝轴”;大柴胡汤中健脾化痰方剂要素主要通过健运脾胃、化痰作用改善肠黏膜屏障功能,即调节“肠轴”;大柴胡汤中通腑泄浊方剂要素主要调节肠道菌群;大柴胡汤全方则可同时作用于“肝轴”和“肠轴”,对NAFLD模型大鼠起治疗作用。
关键词 非酒精性脂肪性肝病;大柴胡汤;方剂要素;疏肝利胆;健脾化痰;通腑泄浊;肠-肝轴;CRITIC法;综合评价
Relevant Analysis of Dachaihu Decoction and its “Formula Elements” on the “Intesine-liver axis” in the NAFLD Model
WANG Min,ZHOU Lu,SUN Yan,CHEN Lin,WU Mengyao,ZHANG Xinlei,ZHANG Shujing,GAO Yushan,YANG Jiamin,ZHENG Fengjie,LI Yuhang
(School of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100029,China)
Abstract Objective:To observe the effects of Dachaihu Decoction and various “formula-factors” on action mechanism of “Intestine-liver axis” of NAFLD model and to reveal the compatibility rule of Dachaihu Decoction.Methods:A total of 105 rats were divided into a normal group,a model group,a Western medicine group,a Shugan Lidan Decoction group,a Jianpi Huatan group,a Tongfu Xiezhuo group and a Dachaihu decoction group.According to the method of modeling and administration,the relevant indexes of“liver axis”and“gut axis”were detected,and the comprehensive evaluation was carried out by the Critic method.Results:Compared with the normal group,in the model group,Z总1 、Z总2 of the sum of the weights of each index of“liver axis”and“gut axis”is statistically significant(P<0.05).Compared with the model group,there were significant differences in the sum weight of Z总1 in liver axis in the Pioglitazone hydrochloride group,dispersing stagnated liver qi for promoting bile flow group,catharis and dispel turbidity group and the Dachaihu Decoction group.And there were significant differences in the sum weight of Z总2 in the Pioglitazone hydrochloride group,dispersing stagnated liver qi for promoting bile flow group,Catharis and dispel turbidity group and the Dachaihu Decoction group.The analysis of intestinal flora showed that Tongfu Xiezhuo Formula have significant advantages in improving intestinal flora of NAFLD model rats.It can increase the relative abundance of beneficial bacteria in intestinal flora of NAFLD rats,such as Bacteroides,Sartoria,Vibrio pseudobutyricum and Akkermansia muciniphila.Conclusion:Formula factors of“Shugan Lidan formula”mainly regulate lipid metabolism of liver and liver immune function,namely,regulating“liver axis”.The Jianpi Huatan Formula factors of the prescription mainly improves intestinal mucosal barrier function-that is,regulating the“intestinal axis”.The Tongfu Xiezhuo formula factors of the Dachaihu Decoction can regulate intestinal flora; Dachaihu Decoction can act on both“liver axis”and“intestinal axis”at the same time,and has therapeutic effects on NAFLD model rats.
Keywords Nonalcoholic fatty liver disease; Dachaihu Decoction; Formula factors; Dispersing stagnated liver qi for promoting bile flow; Invigorate the spleen and dissapte phlegm; Catharis and dispel turbidity; Intestinal-liver shaft; CRITIC method; Comprehensive evaluation
中图分类号:R242文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.03.012
非酒精性脂肪性肝病(Nonalcoholic Fatty Liver Disease,NAFLD)是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝脏损伤,其病理学改变与酒精性肝病(ALD)相似,但患者无过量饮酒史,疾病谱包括非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及其相关肝硬化和肝细胞癌[1]。随着人们生活方式和饮食结构的改变,NAFLD的患病率呈现逐年上升趋势,全球NAFLD患病率约为25.24%。其中北美洲24.1%、欧洲23.7%、亚洲27.4%、中东31.8%、非洲13.5%、南美洲30.5%[2]。虽然NAFLD由单纯脂肪肝发展为非酒精性脂肪性肝炎、肝硬化的时限很长,但由于其代谢紊乱、血脂升高,与心脑血管疾病的发展密切相关,对人类健康构成严重威胁,现在也越来越引起人们的重视,成为21世纪我国乃至全球重要的公共健康问题之一。
NAFLD在单纯脂肪肝或肝炎早期多无明显症状,现代临床多采用调节生活节奏,调整饮食习惯以及加强锻炼等方式加以干预,中医药在其治疗上有明显优势。大柴胡汤是《伤寒论》经典方剂,具有和解少阳、内泻热结之功效,符合临床上大多数NAFLD患者肝胆气机不利,脾虚痰湿中阻,阳明浊气不降的证候特点,而广泛应用于临床治疗NAFLD,疗效确切。
现代临床上应用大柴胡汤治疗NAFLD的效应研究较多,但其作用机制及作用靶点的基础研究甚少,药理机制不能用线性逻辑关系去推理,影响了该方临床治疗NAFLD疗效的进一步提高及化裁应用。证候要素、方剂要素的提出以及对中医复方靶点认识的不断加深为我们提供了一个研究思路[3],“方-证要素对应”不仅用来研究中医方剂的组方原理[4-9],也越来越多被用来研究中药方治疗疾病的现代作用机制[10]。基于“方-证要素对应”的关系,我们从大柴胡汤方剂要素的角度出发,以肠-肝轴为切入点,研究大柴胡汤及其拆方—即各个”方剂要素”對NAFLD模型大鼠肠-肝轴上多靶点的作用,从而为中药复方治疗疾病的多靶点作用机制研究提供一种方法。
1 材料与方法
1.1 材料
1.1.1 动物
SPF级健康SD大鼠,雄性,56只,体质量(180±20)g,购于斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。大鼠于SPF级动物房内饲养,室温为22 ℃,湿度为50%。适应性喂养7 d以后开始造模,整个过程中自由进食、饮水。
1.1.2 药物
盐酸吡格列酮片(杭州中美华东制药有限公司,生产批号:170102)。疏肝利胆药物组成:柴胡15 g、黄芩9 g、白芍9 g;健脾化痰药物组成:法半夏9 g、生姜15 g、大枣12 g;通腑泄浊药物组成:生大黄6 g、烫枳实9 g;大柴胡汤药物组成:柴胡15 g、黄芩9 g、白芍9 g、法半夏9 g、生姜15 g、大枣12 g、生大黄6 g、烫枳实9 g。以上中药饮片均购自北京同仁堂药房。
1.1.3 试剂与仪器
大鼠TNF-α Elisa试剂盒(欣博盛生物科技有限公司,货号:ERC102a.96);大鼠TGF-β1Elisa试剂盒(欣博盛生物科技有限公司,货号:ERC107B.96);大鼠TLR4 Elisa试剂盒(武汉优尔生科技股份有限公司,货号:SEB824Ra);大鼠NF-кB Elisa试剂盒(武汉优尔生科技股份有限公司,货号:SEA753Ra);BCA法蛋白定量试剂盒(北京普利莱基因技术有限公司,货号:P1511);Occludin抗体(英国abcam公司,货号:ab167161);ZO-1抗体(美国proteintech公司,货号:21773-1-AP-50);引物[英潍捷基(上海)贸易有限公司,订单号:4378367];大鼠sIgA试剂盒(欣博盛生物科技有限公司,货号:ERC015)。
全自动生化分析仪(美国贝克曼库尔特有限公司,美国,型号:au5800);小型台式高速冷冻离心机[德国艾本德股份公司(Eppendorf AG),德国,型号:5417R];台式恒温振荡器(太仓实验设备厂,型号:THZ-D);超声波细胞粉碎机(宁波新芝生物科技股份有限公司,型号:JY96-IIN);电泳仪(美国BIO-RAD公司,美国,型号:Mini-PROTEAN);脱色摇床(太仓实验设备厂,型号:TS-1);生物分子成像仪(美国BIO-RAD公司,美国,型号:LAS-4000MINI);紫外可见分光光度计(尤尼柯(上海)有限公司,型号:UV-2600型);MyCyclerPCR仪(美国BIO-RAD公司,美国,型号:T100);荧光定量PCR仪(美国应用生物系统(ABI)公司,美国,型号:stepone-plus);全波长酶标仪(美国赛默飞世尔科技公司,美国,型号:MultiskanMK3)。
1.2 方法
1.2.1 分组与模型制备
105只大鼠按随机数字表法分为正常组、模型组、盐酸吡格列酮组、疏肝利胆组、健脾化痰组、通腑泄浊组、大柴胡汤组,其中每组7只用于电镜取材,其余8只大鼠血清、肝、肠组织用于指标检测。
参照文献[11]选高脂高糖饲料配方,通过预实验验证后选定高脂高糖饲料配方为:52.5%维持饲料+30%蔗糖+10%猪油+2%胆固醇+5%蛋黄粉+0.5%胆酸钠。所有大鼠适应性喂养7 d以后,除正常组大鼠外均给予高脂高糖饲料喂养16周建立NAFLD模型,正常组给予维持饲料喂养。所有组大鼠均自由饮食、饮水。
1.2.2 给药方法
实验用阳性对照药选取盐酸吡格列酮片,所用药物购自京东大药房(中美华东制药,批号:170102)。药物剂量参照文献[12]为10 mg/(kg·d),按大鼠体质量折算,将片剂研为粉末,溶于蒸馏水做成悬浊剂放入4 ℃冰箱备用。
实验用方大柴胡汤为《伤寒论》经典原方,所用中药全部购自于北京同仁堂药房,经北京中医药大学中医药基础理论与关键技术研究中心鉴定为正品。生药剂量比例参《方剂学》[13]大柴胡汤全方(柴胡15 g、黄芩9 g、白芍9 g、法半夏9 g、生姜15 g、大枣12 g、生大黄6 g、烫枳实9 g),按照体表面积法[14]换算求得大鼠单位体质量生药量8.64 g/kg。疏肝利胆药物组成为柴胡15 g、黄芩9 g、白芍9 g,由体表面积法算得大鼠单位体质量生药量为3.39 g/kg;健脾化痰药物组成为法半夏9 g、生姜15 g、大枣12 g,由体表面积法算得大鼠单位体质量生药量,并扩大10倍后为3.70 g/kg;通腑泄浊药物组成为生大黄6 g、烫枳实9 g,由体表面积法算得大鼠单位体质量生药量为1.54 g/kg。用蒸馏水将药物浸泡30 min,武火煮沸后文火煎煮30 min,倒出,加蒸馏水再煎取一遍,将两次所得煎液合并,用双层纱布过滤,水浴蒸发浓缩,分别标记后贮存于冰箱备用。
第13~16周,分别给盐酸吡格列酮组、疏肝利胆组、健脾化痰组、通腑泄浊组、大柴胡汤组大鼠灌胃相应药液,3 mL/只,1次/d,正常组及模型组于相同时间给予同等剂量蒸馏水灌胃。
1.2.3 检测指标与方法
实验第16周,末次灌胃给药后12 h(禁食水12 h),称量大鼠体质量,详细记录一般情况,后采用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉各组大鼠,仰位固定,开胸,腹主动脉取血,采集肝脏、回肠组织冻存备用。同时,剖开大肠,取粪便分装于事前高压灭菌过的无菌冻存管,液氮冻存后转移至-80 ℃冰箱待送深圳华大基因科技服务有限公司进行检测。整个操作过程严格按照无菌操作进行,避免样本污染,避免反复冻融。
本动物实验过程均遵守美国国立卫生院倡导的实验动物关怀、使用指导原则,及以减少、替代和优化为核心的动物实验“3R”原则。本研究通过了北京中医药大学医学与实验动物伦理委员会的批准(编号:BUCM-1-2017051030-2030)。
血清三酰甘油(Triacylglycerol,TG)、總胆固醇(Total Cholesterol,TC)、高密度脂蛋白(High-density Lipoprotein,HDL),低密度脂蛋白(Low-density Lipoprotein,LDL)及谷丙转氨酶(Alanine Aminotransferase,ALT)、谷草转氨酶(Aspartate Aminotransferase,AST)由全自动生化仪(北京中医药大学科研中心)测定。Elisa法测定大鼠肝组织中TNF-α、TLR4、NF-кB、TGF-β以及肠组织sIgA含量。Western Blot法测定大鼠肠组织Occludin、ZO-1蛋白表达。RT-qPCR法测定大鼠肠组织Occludin mRNA、ZO-1 mRNA表达。
1.3 统计学方法
1.3.1 无量纲化处理
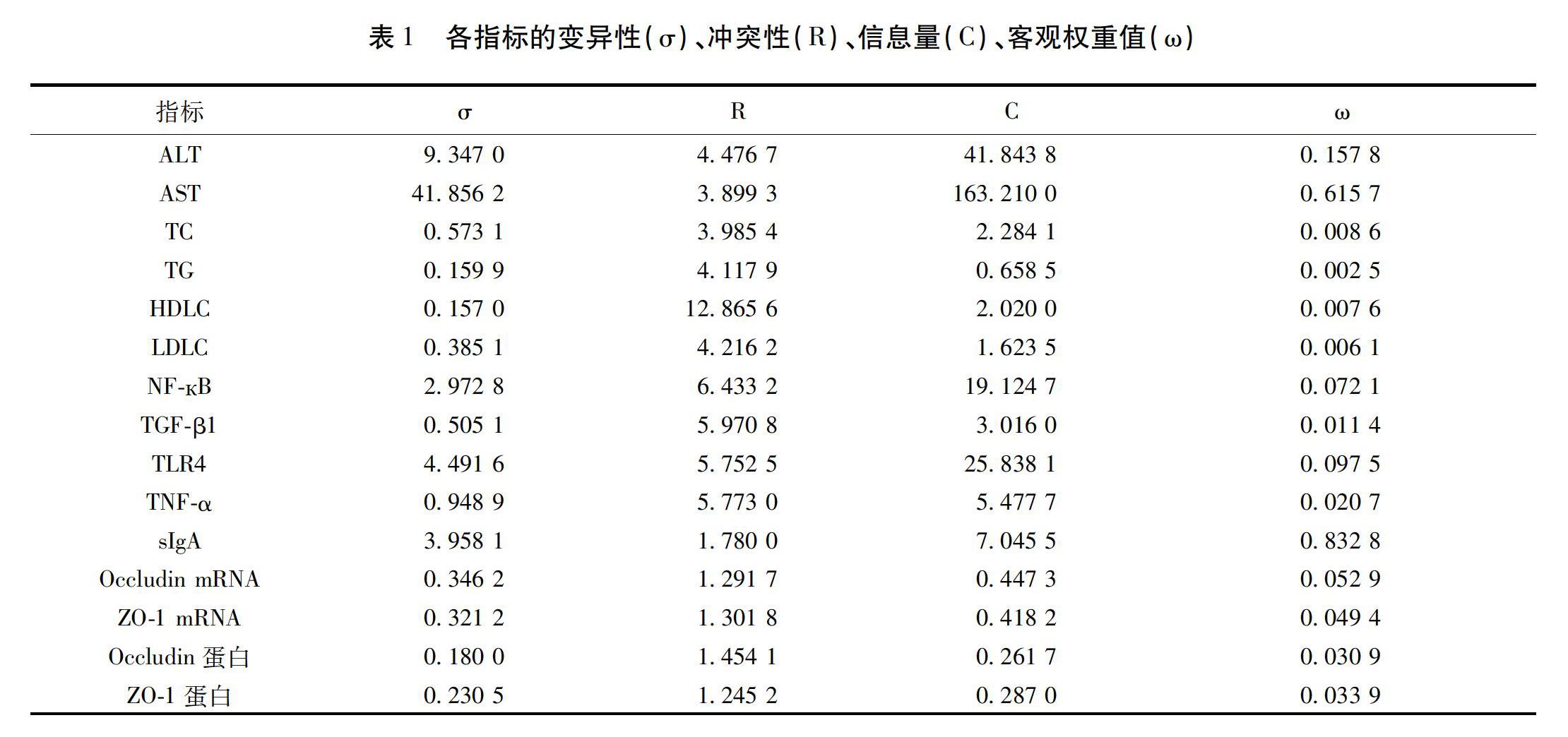
在运用Critic法对肠-肝轴指标进行分析时,由于指标间的单位不同,需进行无量纲化处理,消除单位不同的影响。同时,由于指标中存在高优指标(指标值越高则结果越优:HDL-C,sIgA,Occludin mRNA,ZO-1 mRNA,Occludin蛋白,ZO-1蛋白)与低优指标(指标值越低则结果越优:ALT,AST,TC,TG,LDL-C,NF-кB,TGF-b1,TLR4,TNF-α),因此需分别进行无量纲化处理,公式如下:
高优指标无量纲化处理:Zij=xijmax(xij)
低优指标无量纲化处理:Zij=max(xij)xij
1.3.2 计算指标间的相关性与冲突系数
利用pearson相关系数,对无量纲化后的指标计算指标间的相关性,公式如下:
rij=Cov(Zi,Zj)D(Zi)D(Zj)
冲突性系数与指标的相关性相反,相关性越高则冲突性越低,其公式如下:
Rj=i=1(1-rij)
以上公式中Cov(Zi,Zj)为Zi,Zj的协方差,D(Zi)、D(Zj)分别为Zi、Zj的方差。rij代表第i个指标与第j个指标的相关性。Rj表示第j个指标的冲突性。
1.3.3 计算客观权重
指标的客观权重通过如下公式进行求解:
Cj=σjRj
wj=Cjj=1Cj
公式中σj代表第j个指标的标准差即冲突性。Cj为指标j的信息量。
2 结果
2.1 各指标的变异性、冲突性、信息量、客观权重值见表1。
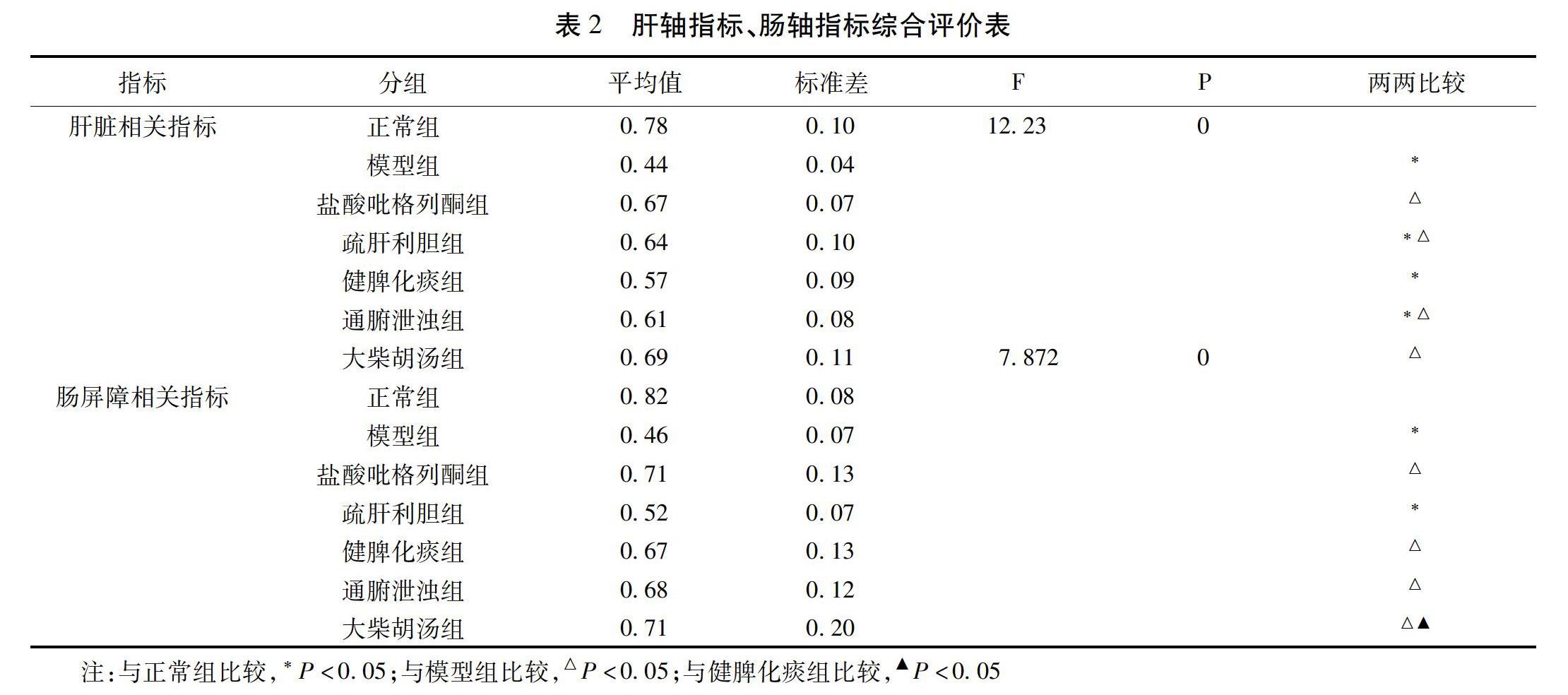
2.2 肝轴指标、肠轴指标综合评价 见表2。
2.3 各组肠道菌群中起重要作用的微生物 见表3。
3 讨论
NAFLD是指除外一些明确损肝因素所导致的主要以肝细胞内脂肪过度沉积为特征的临床病理综合征,属于中医学“胁痛”“痞满”“肝胀”“肝痞”“肝癖”“肝着”“积聚”“痰证”“痰浊”“湿阻”“瘀证”“肥气”“积证”等疾病范畴。NAFLD的发病机制并不十分明确,对其的研究大多处于假说阶段,“二次打击”学说占据主导地位,随着1998年Marshall正式提出“肠-肝轴”概念,肠道因素在疾病发生发展中的作用越来越引起人们的重视。
肠-肝轴的“肝轴”主要包括脂质代谢以及氧化应激反应。肝脏为脂质代谢中心,脂质代谢过程中任何一个小环节异常均会改变正常情况下的动态平衡[15],从而导致肝脏内脂肪堆积等一系列变化[16]。TC、TG、HDL、LDL反应脂质代谢情况,而ALT、AST反映肝细胞炎性反应、受损以及肝脏损害程度的指标。胰岛素抵抗、脂质过氧化反应是NAFLD发病的重要环节,TNF-α通过降低胰岛素受体-酪氨酸激酶的活性[17]、介导肝脏损伤的重要炎性反应因子[18]、减弱线粒体的呼吸功能[19]等参与NAFLD的发生发展。NF-кB作为一种核转录因子,在肝细胞凋亡的中心环节-线粒体损伤中发挥重要作用,NF-кB活化后作用于TNF-α,产生大量炎性递质,激活bax等线粒体上的促凋亡蛋白,导致肝细胞凋亡,参与NAFLD发展进程[20],TNFα/NF-κB信号通路在各种信号刺激的条件下促进了NAFLD的发展[21]。TGF-β1通过诱导肝细胞凋亡和激活肝星状细胞促进细胞外基质的形成,孙丹莉等人研究发现,TGF-β1随脂肪肝程度加重而升高,并且与肝活检所见肝组织炎性反应改变密切相关[22]。TLR4信号途径的激活,还可通过促进促炎性反应细胞因子的合成与释放,增强胰岛素受体底物(IRS)中丝氨酸发生磷酸化,进一步调控下游酪氨酸激酶的活性下调,并且能够阻断下游胰岛素信号的递增传递。同时,TLR4信号途径的激活,还可以通过抑制胰岛素受体有效结合IRS-1,进一步诱发机体内部葡萄糖转运体(Glucose-transporter,GLUT)4的表达水平降低,最终诱发肝脏胰岛素抵抗的发生[23]。TLR4作为Toll样受体家族中的重要环节,在各种肝脏细胞中广泛表达,其介导的信号通路参与胰岛素抵抗,引起氧化应激,诱发炎性反应[24]。总而言之,TNF-α、NF-кB、TGF-β1和TLR4在NAFLD的发病机制中发挥作用,TC、TG、HDL、LDL、TNF-α、NF-кB、TGF-β1和TLR4是反应NAFLD发生发展在肠-肝轴中“肝轴”的体现。
肠道黏膜不仅承担着消化、吸收营养物质的功能,同时也是机体最大的储存细菌器官和阻挡毒素、病原微生物侵入的主要门户[25],肠道黏膜屏障包括生物屏障、机械屏障、免疫屏障和化学屏障,肠道黏膜屏障功能在NAFLD发病中占有重要作用[26]。肠黏膜通透性主要与机械屏障相关,肠黏膜机械屏障主要由肠顶端膜肠上皮细胞(Intestinal Epithelial Cells,IECs)和上皮紧密连接蛋白(Tight Junction Protein,TJP)与菌膜三者组成,紧密连接作为肠黏膜机械屏障最重要的连接方式,由Occludin蛋白、Claudin蛋白、ZOs等结构蛋白及各类连接蛋白分子共同组成[27]。“肠-肝轴”与NAFLD发生密切相关,NAFLD发生时肠黏膜机械屏障破坏,通透性增加。Xin D[28]通过对28名转氨酶升高的NAFLD患者、30名转氨酶正常的NAFLD患者以及34名健康志愿者进行研究发现,在NAFLD患者中,ZO-1和Occludin表达水平与转氨酶水平呈负相关,说明了肠上皮细胞紧密连接蛋白的表达与NAFLD发生密切相关。肠黏膜的屏障作用还包括免疫屏障,在肠黏膜免疫屏障中起主导作用的是以sIgA为主的体液免疫,防御病原菌在肠黏膜黏附和定植[29]。最主要的体液免疫防御因子sIgA,通过包裹、封闭外来的病菌与IEC的特异结合位点,能够让其丧失黏附IEC的能力。此外,sIgA不仅能够阻止肠黏膜上皮细胞识别及摄取细菌、毒素和其他有害分子,依靠肠道机械蠕动对病原体和毒素的清除,而且能够减弱外部抗原刺激所引起的免疫耐受的形成,阻止肠道共栖的有益菌群对肠黏膜免疫屏障系统产生的免疫应答[30]。李生[31]通过动物实验研究发现,非酒精性脂肪性肝炎形成過程中小肠分泌液中sIgA含量显著降低,说明肠道免疫屏障受到损害,并且其损害可能与肠道脂质过氧化增强相关。总言之,Occludin、ZO-1、sIgA是评价肠黏膜屏障功能的重要指标,是反应NAFLD发生发展在肠-肝轴中“肠轴”的体现。
Critic赋权法结合了无量纲化与协方差矩阵统一度量以借助比较评价确定客观权重,具体到本研究,权重值的大小则表示其对疾病的贡献度大小。实验结果显示,与正常组比较,模型组“肝轴”以及“肠轴”各个指标权重之和Z总1、Z总2比较差异均有统计学意义(P<0.05),说明NAFLD模型大鼠出现了肝脏以及肠黏膜屏障的病理变化。与模型组比较,盐酸吡格列酮组、疏肝利胆组、通腑泄浊组以及大柴胡汤组“肝轴”各个指标权重之和Z总1比较差异有统计学意义(P<0.05),说明盐酸吡格列酮、疏肝利胆方剂要素、通腑泄浊方剂要素以及大柴胡汤可以显著调节NAFLD模型大鼠的肝脏脂质代谢以及肝脏免疫,而健脾化痰方剂要素调节“肝轴”效应不显著。盐酸吡格列酮组、健脾化痰组、通腑泄浊组以及大柴胡汤组“肠轴”各个指标权重之和Z总2比较差异有统计学意义(P<0.05),说明盐酸吡格列酮、健脾化痰方剂要素、通腑泄浊方剂要素以及大柴胡汤可以显著调节NAFLD模型大鼠肠黏膜屏障功能,而疏肝利胆方剂要素调节“肠轴”的效应不显著。
肠道菌群由大约1 014种微生物构成,共同参与宿主的代谢和免疫,可以应对机体受外部刺激所产生的各种适应性反应[32-35]。肝脏和胃肠道在解剖、功能上关系密切,近些年国外研究[36-37]显示,肝脏疾病的发生、发展与机体肠道微生态变化密切相关,肠道菌群失调及内源性内毒素血症在NAFLD发病过程中发挥重要作用[38-40],通过调节肠道菌群,恢复肠道微生态平衡,对延缓乃至阻止NAFLD的进展可能有重要的作用,成为预防及治疗该病的新方法[41]。本实验结果显示通腑泄浊方剂要素对改善NAFLD模型大鼠肠道菌群优势显著,其通过提高NAFLD大鼠肠道菌群中拟杆菌属、萨特氏菌属、假丁酸弧菌属细菌和Akkermansia muciniphila等有益菌的相对丰度,改善NAFLD大鼠的糖脂质代谢,减少肝脏中脂肪沉积,抑制肠道内炎性反应,维持肠黏膜屏障的完整性。
中医学中,肝脾密切相关,尤其在病理方面,肝病传脾,脾病及肝。《素问·玉机真脏论》云:“肝受气于心,传之于脾”,《素问·宝命全形论》云:“土得木而达”。《难经·七十七难》说:“所谓治未病者,见肝之病,则知肝当传之于脾,故先实脾气,无令得受肝之邪”。《金匮要略》更是说:“夫治未病者,见肝之病,知肝传脾,当先实脾,四季脾旺不受邪,即勿补之;中工不晓其传,见肝之病,不解实脾,惟治肝也”。NAFLD为中医肝、脾同病之典范,其中医病机为肝胆气机不利,脾虚痰湿中阻,阳明浊气不降,大柴胡汤通过将有疏利肝胆作用的药物—柴胡、黄芩、白芍,有健脾化痰作用的药物—半夏、生姜、大枣以及具有通腑泄浊作用的药物—大黄、枳实配伍,达到肝、脾、大肠同治的作用,并且通过与NAFLD西医学病理机制进行研究,发现方中各方剂要素与“肠-肝轴”病机轴上靶点的对应关系,体现了大柴胡汤配伍的科学性。
中医复方治病具有多种配伍组合形式及“多靶点”的特点,采用证候靶点与疾病靶点(作用环节)相结合的研究模式,将是破解中医复方配伍规律的重要途径之一。本实验研究即是采用此种研究模式,证实了大柴胡汤及其各方剂要素在治疗高脂高糖饲料喂养的NAFLD模型大鼠中,对应“肝胆气机不利”证候的方剂要素—疏肝利胆方剂要素主要对应西医学中“肠-肝轴”作用机制中的“肝轴”,而对应“脾虚痰湿中阻”证候的方剂要素—健脾化痰方剂要素主要对应“肠-肝轴”作用机制中的“肠轴”,对应“阳明浊气不降”证候的方剂要素—通腑泄浊方剂要素,主要调节肠道菌群,而同时也对肝脏脂质代谢、肝脏免疫以及肠黏膜屏障有调节作用。通过各方剂要素配合,全方大柴胡汤亦对应西医“肠-肝轴”中的“肝轴”和“肠轴”。本研究证实了大柴胡汤配伍方法的西医病理机制规律,为开展中药复方的靶点作用机制研究提供了思路和方法。
参考文献
[1]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中国医学前沿杂志,2012,4(7):4-10.
[2]展玉涛,李贝,张川.非酒精性脂肪性肝病的流行病学与自然史[J].现代医药卫生,2017,33(5):645-646.
[3]李宇航.谈“证候要素”与“方剂要素”[J].中华中医药杂志,2009,24(2):117-121.
[4]郭梦莹,张鑫蕾,孙燕.从“方-证要素对应”探讨栀子豉汤及其衍化方的演化规律[J].世界中医药,2019,14(6):1590-1593,1597.
[5]张鑫蕾,王町囡,孙燕.泻心汤类方及其衍化方演化规律中的“方-证要素对应”思想探究[J].世界中医药,2018,13(3):754-758.
[6]王敏,李宇航.基于“方-证要素对应”的甘麦大枣汤治疗脏躁机制分析[J].北京中医药大学学报,2017,40(5):366-370.
[7]王町囡,郑丰杰,孙燕.苓桂剂“方-证要素对应”解析[J].世界中医药,2017,12(3):689-693.
[8]郑丰杰.从方证相应与方-证要素对应谈经方临床应用[J].北京中医药大学学报,2015,38(10):653-657.
[9]刘艳红,李宇航.从“方-证要素对应”角度探讨三承气汤及其衍化方演化规律[J].辽宁中医药大学学报,2015,17(4):154-157.
[10]张川锋,王振兴,杨昆,等.依据“方-证要素对应”分析补阳还五汤治疗肺纤维化疾病机制[J].时珍国医国药,2018,29(6):1406-1408.
[11]李莹,岳维芸,沈天白.益气清化方对非酒精性脂肪性肝病模型大鼠肠道菌群的影响[J].上海中醫药杂志,2015,49(8):79-83.
[12]黄志磊,黄晓君,黄小利,等.双醋瑞因对2型糖尿病大鼠炎性因子和脂代谢的影响及脂肪组织chemerin的表达变化[J].西安交通大学学报:医学版,2017,38(5):693-698.
[13]邓中甲.方剂学[M].北京:中国中医药出版社,2003:78.
[14]陈奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:1090,375.
[15]Marchesini G,Bugianesi E,Forlani C,et al.Nonalcoholic fatty liver,steatohepatitis and the metabolic syndrome[J].Hepatology,2003,38(2):536.
[16]Poniachik J,Mantilla C,Contreras J,et al.Obesity:risk factor for steatohepatitis and hepatic fibrosis[J].Rev Med Chil,2002,130(7):731-736.
[17]张进军,陈晓雯,李居一,等.复方健胰胶囊对非酒精性脂肪肝病患者血清超敏C-反应蛋白、肿瘤坏死因子-α和白介素-18的影响[J].安徽中医药大学学报,2014,33(1):24-27.
[18]魏永杰.细胞因子在非酒精性脂肪性肝炎发病机制中的作用[J].国际消化病杂志,2006,26(1):14-16.
[19]程勇,赵亚敏,苏剑,等.非酒精性脂肪性肝病患者血清白介素-18、白介素-8、肿瘤坏死因子-α水平变化的临床意义[J].医学研究与教育,2009,26(3):18-20.
[20]石海燕.BBCL-2,NF-кB,血管紧张素Ⅱ-Ⅰ受体在大鼠非酒精性脂肪肝病中的作用及其机制研究[D],泸州:泸州医学院,2013.
[21]孙婷婷,李京涛,魏海梁,等.TNFα/NF-κB信号通路调控非酒精性脂肪性肝病的研究现状[J].临床肝胆病杂志,2019,35(9):2095-2098.
[22]孙丹莉,张予蜀,张振玉,等.非酒精性脂肪性肝病患者血清转化生长因子-β1与血脂和肝脏酶学变化的临床意义[J].中华消化杂志,2006,26(5):348-349.
[23]殷小磊.布拉氏酵母菌对实验性大鼠非酒精性脂肪性肝炎的疗效及其作用机制的研究[D].石家庄:河北医科大学,2013.
[24]廖媛,池晓玲,杨以琳,等.脂必泰对非酒精性脂肪肝病大鼠肝组织ERK和TLR4表达的影响[J].中药药理与临床,2019,35(6):130-134.
[25]黎介寿.肠衰竭概念:营养支持与肠黏膜屏障维护[J].肠外与肠内营养,2004,11(2):65-67.
[26]张媛媛,李晶,迟毓婧,等.肠道黏膜屏障在非酒精性脂肪性肝病发生发展中的作用[J].临床肝胆病杂志,2016,32(12):2391-2394.
[27]叶艳伟,庄丽维,薄挽澜.非酒精性脂肪性肝病患者肠黏膜肌球蛋白轻链激酶与紧密连接蛋白Occludin的变化[J].哈尔滨医科大学学报,2019,53(4):342-346.
[28]Xin D,Zong-Shun L,Bang-Mao W,et al.Expression of intestinal tight junction proteins in patients with non-alcoholic fatty liver disease[J].Hepatogastroenterology,2014,61(129):136-140.
[29]ITO H,TAKEMURA N,SONOYAMA K,et al.Degree of polymerization of inulin-type fructans differentially affects number of lactic acid bacteria,intestinal immune functions,and immunoglobulin a secretion in the rat cecum[J].Journal of Agricultural and Food Chenmistry,2011,59(10):5771-5778.
[30]BRANDT E R,HAYMAN W A,CURRIE B,et al.Functional analysis of IgA antibodies specific for a conserved epitope within the M protein of group A streptococci from Australian aboriginal endemic communities[J].International Immunology,1999,11(4):569-576.
[31]李生,楊勇,丁百静,等.非酒精性脂肪性肝炎大鼠肠道分泌液sIgA的变化[J].胃肠病学和肝病学杂志,2011,20(2):124-127.
[32]Fukuda S,Ohno H.Gut microbiome and metabolic diseases[J].Semin Immunopathol,2014,36(1):103-114.
[33]Ramakrishna BS.Role of the gut microbiota in human nutrition and metabolism[J].Journal of Gastroenterology and Hepatology,2013,28(S4):9-17.
[34]Goel A,Gupta M,Aggarwal R.Gut microbiota and liver disease[J].J Gastroen Hepatol,2014,29(6):1139-1148.
[35]Geurts L,Neyrinck AM,Delzenne NM,et al.Gut microbiota controls adipose tissue expansion,gut barrier and glucose metabolism:novel insights into molecular targets and interventions using prebiotics[J].Benef Microbes,2014,5(1):3-17.
[36]Schnabl B,Brenner DA.Interactions between the intestinal microbiome and liver disease[J].Gastroenterology,2014,146(6):1513-1524.
[37]Biedermann L,Rogler G.The intestinal microbiota:its role in health and disease[J].Eur J Pediatr,2015,174(2):151-167.
[38]Tremaroli V,Bckhed F.Functiona interactions between the gut microbiota and host metabolism[J].Nature,2012,489(7415):242-249.
[39]Mouzaki M,Comelli EM,Arendt BM,et al.Intestinal microbiota in patients with non-alcoholic fatty liver disease[J].Hepatology,2013,58(1):120-127.
[40]杨林辉,蔡俊,陈东风.非酒精性脂肪性肝炎患者肠道菌群的变化及意义[J].临床肝胆病杂志,2012,28(2):124-126.
[41]刘嘉琪,周少明.非酒精性脂肪性肝病肠道菌群的研究进展[J].临床肝胆病杂志,2017,33(12):2453-2456.
(2019-07-09收稿 责任编辑:徐颖)
