利用荧光探针检测谷胱甘肽的实验设计
2021-06-24陈黎艳
陈黎艳, 程 莹, 费 峥
(华中师范大学化学学院,武汉 430079)
0 引 言
高等院校在国家创新体系中担负着教学创新、科研创新、教育创新等职能,是国家培养创新人才的重要基地,因此,利用现有的各类教学资源和科研平台为社会培养富有创新精神和创新能力的现代化人才是当代高等院校的重要责任[1-4]。化学专业是一门以实践为主的学科,化学实验教学巧妙地融合了实验理论与实践指导是培养学生科学探索的意识和创新精神的重要途径。相较于以操作技能培养和理论验证为目的的传统基础化学实验,综合设计性实验要求学生系统地完成基础知识学习、文献调研、数据分析和结果讨论这样一个完整的研究过程,这无疑对学生科学研究兴趣和创造性思维的培养提供有力的帮助[5]。
荧光探针是一种利用光谱学变化对特定目标分析物进行识别的高效探测器[6-7],本文依托于纵向科研项目,借助紫外可见分光光度计和荧光分光光度计研究了荧光探针分子对生物活性物种谷胱甘肽(GSH)的识别性能[8]。在实验过程中学生的文献阅读、有机合成、仪器操作等技能得到了训练,创新思维和合作精神也得到了进一步的培养。
1 实验内容设计
荧光探针技术可将分子间的相互作用转化为易于监测的吸收光谱和荧光发射光谱的变化,与传统的高效液相色谱法、质谱法、电化学检测法等检测方法相比,大大提高了灵敏度和准确度。GSH是生物体内具有生物活性的小分子生物硫醇,在细胞中参与基因调控、细胞内信号转导和自由基清除等生理过程。然而,一旦GSH的含量超出细胞的正常水平,则会造成生物体氧化还原反应失衡并对肝脏和肾脏代谢造成负担。因此,GSH的定量和定性检测对于生命科学和临床诊断均具有重要意义[9-10]。罗丹明类荧光团具有摩尔消光系数大、量子产率高、水溶性好等优点,因此在各类探针分子的设计中应用广泛[11]。GSH中巯基的亲核能力较强,可以与卤素原子(如Cl,Br)发生亲核取代反应,因此碳卤键成为GSH常见的识别集团[12]。本文将α-溴代酰胺连接至罗丹明荧光团,设计合成了新型的识别GSH的荧光探针RHO(见图1)。在探针与GSH反应之前,罗丹明螺环关闭,氧杂蒽结构处于非共轭体系,因此探针本身无荧光发射且体系无颜色。当GSH进攻α-溴代酰胺结构之后,在氢键的作用下罗丹明的罗内酰胺结构开环,氧杂蒽结构转化为共轭体系,因此探针的荧光被打开,体系也随之转换成为肉眼可见的红色(见图1)。
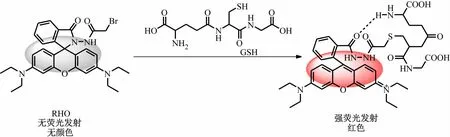
图1 荧光探针检测GSH反应机理
2 实验仪器与试剂
(1)实验仪器。电子分析天平(LE104E,梅特勒托利多),恒温磁力搅拌器(MYP19-2,上海梅颖浦仪器仪表有限公司),旋转蒸发仪(Hei-VAP Core ML/G3,德国海道夫公司),核磁共振波谱仪(Bruker Mercury Plus 400 MHz,美国布鲁克公司),手提式紫外灯(ZF-5,上海嘉鹏科技有限公司),荧光分光光度计(Cary Eclipse,安捷伦科技有限公司),紫外可见分光光度计(Cary 60,安捷伦科技有限公司)。
(2)主要试剂。罗丹明B酰肼(95%~98%,天津希恩思生化科技有限公司),溴代乙酰溴(≥98%,Sigma-Aldrich),无水碳酸钾(化学纯,国药集团化学试剂有限公司),氘代二甲基亚砜-d6(≥99%,Sigma-Aldrich)。
3 实验操作
(1)探针RHO的合成。将溴乙酰溴(3.0 mmol,606 mg)和无水碳酸钾(3.0 mmol,414 mg)溶解于10 mL无水二氯甲烷中。将罗丹明B酰肼(2.0 mmol,912 mg)溶解于10 mL二氯甲烷并放置于恒压低液漏斗,以15~20滴/min的速度滴加到反应体系中。反应2 h,用薄层析法监测反应进程直至原料消耗完全。将50 mL碳酸氢钠溶液加入反应体系中,再用二氯甲烷萃取3次。合并有机相,用柱层析纯化即可得到纯净的探针RHO(见图2)。
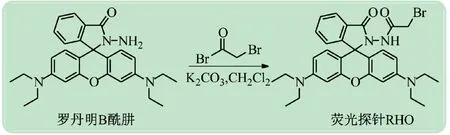
图2 荧光探针RHO的合成路线
(2)核磁共振波谱仪检测。称取8 mg探针粉末溶于5 mL氘代二甲亚砜中,用玻璃滴管转移至干净的核磁管内,用核磁共振波谱仪进行检测。
(3)检测溶液的制备。探针储备溶液:称取5.8 mg探针粉末溶于10 mL N,N-二甲基甲酰胺配制成为10 mmol/mL的探针储备溶液。
被检测物储备溶液:分别称取适量的谷胱甘肽、同型半胱氨酸、半胱氨酸、丙氨酸、酪氨酸、赖氨酸、谷氨酸和组氨酸溶于PBS缓冲溶液中配制成为浓度为10 mmol/mL的被检测物储备溶液。
待测液配制方法:①空白溶液。将300μL的无水DMF溶液与2.70 mL的PBS缓冲溶液混合。②探针参比溶液。在270μL的无水DMF溶液与2.70 mL的PBS缓冲溶液的混合溶液中加入30μL的探针储备溶液。③实验组待测溶液。270μL的无水DMF溶液与2.64 mL的PBS缓冲溶液的混合溶液中加入30 μL的探针储备溶液,混合均匀后,分别加入60μL不同种类的被检测物储备溶液。
(4)紫外-可见光谱测试参数。使用安捷伦Carry 60紫外-可见吸收光谱仪,1 cm吸收池,选择吸收波长为500~650 nm。
(5)荧光光谱测试参数。使用安捷伦Cary Elipse荧光分光光度计,1 cm石英池测定。激发波长为555 nm,发射波长为580 nm,狭缝为5/10 nm,电压500 V,测试温度25℃。
4 结果与讨论
4.1 探针的核磁结构表征
探针RHO的1H表征数据:9.94(1 H,s),7.82(1 H,m),7.64~7.41(2 H,m),7.12~6.92(1 H,m),6.58~6.42(2 H,m),6.33(4 H,d,J=2.1),3.76(2 H,s),3.39~3.30(8 H,m),1.12~1.06(12 H,t,J=6.9)。如该化合物的1H谱图3所示,在(1.12~1.06)×10-6范围内出现的三重峰为4个甲基上的12个H(Ha);在3.30~3.39×10-6出现的四重峰可以归属为4个亚甲基的8个氢(Hb),3.76×10-6处出现的明显的单峰为溴代酰胺α位置的2个氢(Hc);在9.94×10-6的位置能够观察到一个矮宽峰为亚氨基氢的特征峰型(Hd)。除此之外,谱图6.0~8.0×10-6的范围中可以观察到5组氢分别对应了探针芳基上的10个氢原子(HAr)。
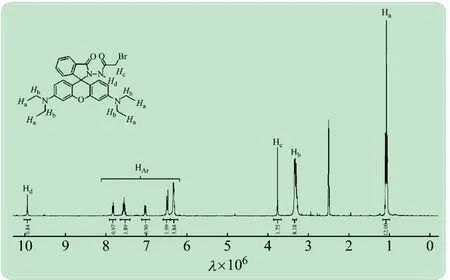
图3 探针RHO的1 H NMR谱图
4.2 探针对谷胱甘肽的检测性能
分别将3 mL空白溶液、参比溶液和加入了谷胱甘肽的被检测液放入1 cm的石英池中,在紫外分光光度计的作用下对500~650 nm范围的紫外可见吸收进行检测。如图4(a)所示,空白溶液及只加入了探针的参比溶液在此范围内均没有发现明显的紫外可见吸收峰;而当加入了谷胱甘肽的被检测液放入紫外分光光度计下进行检测时可观测到在575 nm处出现了明显的吸收峰。同样地,将空白溶液、参比溶液及谷胱甘肽的待测溶液分别放入荧光分光光度计下用555 nm的激发波长,在565~650 nm的波长范围内进行扫描可得如图4(b)所示的结果:只有在谷胱甘肽加入的情况下才能观测到明显的荧光发射峰,空白和参比溶液均无法引起明显的荧光发射光谱。
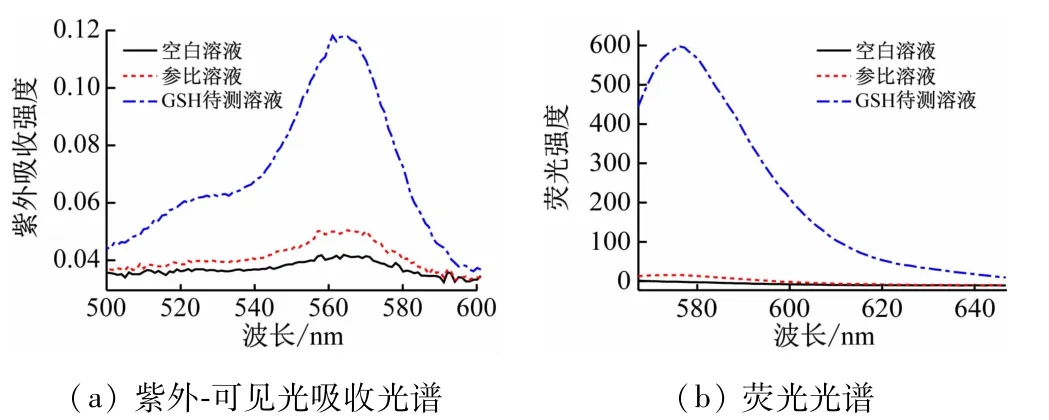
图4 空白溶液、探针参比溶液及探针RHO与谷胱甘肽作用的光谱图
4.3 检测谷胱甘肽的特异性
为了证明探针RHO对谷胱甘肽的检测性能具有特异选择性,需要在相同条件下检测该探针对相似结构氨基酸的检测性能。因此,配制含有不同种类氨基酸(同型半胱氨酸、半胱氨酸、丙氨酸、酪氨酸、赖氨酸、谷氨酸和组氨酸)的待测溶液,并在同等检测条件下观测到的紫外吸收光谱及荧光发射光谱的变化。如图5所示,将参比溶液以及加入不同种类氨基酸的待测溶液在紫外分光光度计和荧光分光光度计中扫描,可以发现只有谷胱甘肽加入的情况下可以观测到575 nm的吸收峰以及在580 nm处出现的明显发射峰,其他种类的氨基酸并未引起明显的光谱变化,这说明探针RHO对谷胱甘肽的检测能力具有特异选择性。
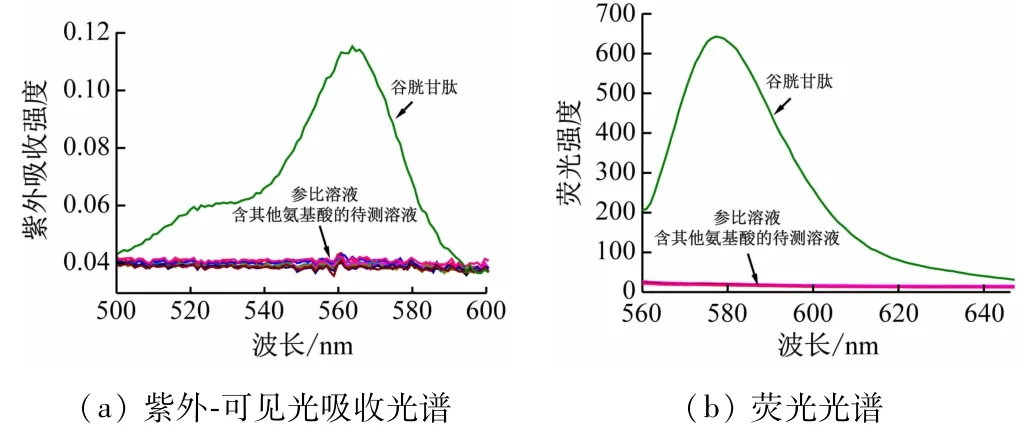
图5 探针RHO与谷胱甘肽和其他氨基酸作用的光谱图
5 结 语
本设计性实验验证了荧光探针分子RHO对生物活性小分子物种谷胱甘肽的特异性识别性能。学生需要完成一步条件温和、污染性小且难度适中的有机合成反应并借助紫外可见光谱仪、荧光分光光度计完成探针RHO的性质验证。此外,学生将在教师的辅助下学习用核磁共振波谱仪对有机化合物的结构进行验证,并将通过直接动手操作荧光分光光度计和紫外可见光分光光度计学习光谱特征在化合物性能验证中的重要作用[13-16]。该设计性实验包含了前沿文献阅读、相关文献查阅、有机合成、结构解析及化合物性质验证等过程,学生在设计性实验的过程中得到了系统且全面的训练,有助于培养学生的科学研究兴趣以及独立思考解决问题的能力。
