粮油作物中玉米赤霉烯酮检测方法研究进展
2021-06-24张晋欣刘沙沙
刘 梅,张晋欣,刘沙沙,马 玥
(陕西师范大学 食品工程与营养科学学院,陕西 西安710119)
玉米赤霉烯酮(Zearalenone,ZEN),又称F-2毒素,是由镰刀菌属真菌(禾谷镰刀菌、青枯病镰刀菌、赤霉病镰刀菌和半裂镰刀菌等)产生的一种次级代谢产物,即类雌激素真菌毒素[1]。玉米赤霉烯酮是Stob等[2]于1962年从发霉玉米的真菌中分离到的一种代谢产物。ZEN具有类雌激素作用,对动物有许多不良影响,不仅会影响动物生殖机能,还会产生免疫毒性、细胞毒性和遗传毒性,损伤肝、肾等器官,甚至可能导致急性死亡。ZEN可与雌激素受体结合,激活其在体内的反应,从而引发一系列类雌激素效应[3]。妊娠期大鼠在产前暴露于ZEN作用下,会对母体及发育中的胎儿产生影响,并可能导致子一代成年雌性的长期生殖损伤[4]。ZEN还会引起不同程度的男性生殖器官损伤,最终导致性功能下降,影响其生殖功能[5]。ZEN单独存在或与其他霉菌毒素结合会对MA-10鼠间质细胞系的体外细胞产生毒性[6]。在极低浓度下,ZEN能促进细胞增殖、菌落形成和细胞迁移,且ZEN可导致DNA损伤[7]。
玉米赤霉烯酮主要分布于中国、日本、韩国、北欧、中欧等国家或地区,存在于玉米、大米、小麦、豆类等粮油作物中[8]。玉米赤霉烯酮污染范围广、程度深、危害大,在世界各地的食品原料、饲料中均广泛存在,此问题急需得到妥善控制与解决。
毒素的污染与毒性是各个国家制定限量标准的重要依据,针对不同对象严格制订相应的限量标准,有利于保障食品安全,使人民吃得放心、吃得安心。我国也提出了相应的限量标准,《GB 2761-2017食品安全国家标准 食品中真菌毒素限量》[9]中规定:食品中谷物及其制品,包括小麦和小麦粉、玉米和玉米面(渣、片),ZEN的最高限量为60μg/kg。参照食品中玉米赤霉烯酮的限量标准,国家也制定了粮油作物中玉米赤霉烯酮的检测标准,现行的检测标准如表1所示。

表1 食品中玉米赤霉烯酮检测方法标准Table 1 Standards for ZEN detection methods in food
谭新柳等[12]概述了色谱法、胶体金法、生物传感器法等多种检测方法对样品中ZEN的检测;谭红霞等[13]则只从生物传感器检测技术方面对ZEN的检测进行论述。基于前人报告,作者主要介绍了玉米赤霉烯酮常见检测技术的原理及优缺点,为后续研究提供基础。
1 色谱检测法
色谱是利用不同组分在固定相和流动相之间的分配系数或溶解度不同的原理对各组分进行分离纯化,最终检测物质含量的一种方法。色谱分析法是小分子物质检测最常用的一类检测手段,包括薄层色谱法(TLC)、高效液相色谱法(HPLC)、气相色谱法(GC)和质谱法(MS)等[14-17]。
薄层色谱法是早期应用于检测的一种方法,是对混合样品进行分离、鉴定和定量的一种层析分离技术[18]。Schaafsma等[19]采用了不同种方法检测谷物中ZEN含量,结果表明TLC法成本最低、耗时短,且对设备和人员要求不高,但存在操作过程复杂、专一性差、灵敏度低、重复性差的缺点[20],而且实验员需接触大量有毒有害试剂,因此逐渐停止使用。现在最常用的检测方法是液相色谱、气相色谱和质谱。这些方法一般需应用大型仪器,分析比较迅速、灵敏度高、检测限低,但前处理复杂、成本高,且大型仪器需专业人员操作[21-22],检测要求较高。现阶段色谱法检测主要用于多种真菌毒素的同时检测,如黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮、呕吐毒素等。液相或气相色谱与质谱联用适合对多种待测物质同时进行定量检测,且灵敏度较高。Kafouris等[23]用乙腈/水混合物单步萃取ZEN,再用超高效液相色谱串联质谱法进行分析,该方法无须任何清洗步骤,灵敏度高。Wang等[24]采用涡流辅助离子-液基分散液-液微萃取相结合的方法,对玉米制品中的ZEN进行高效液相色谱分离和荧光检测。该方法前处理简单、净化效果好、灵敏度高、检测速度快,适用于ZEN残留的分离和定量检测。可见,联用技术在ZEN检测方面有着广大的应用前景(表2)。

表2 色谱法检测ZEN的线性范围及检测限Table 2 Linear range and detection limit of ZEN by chromatography
2 免疫分析法
免疫分析法是利用目标分子和抗原竞争并与抗体结合的原理,检测真菌毒素的一种方法,常采用与荧光标记相结合的策略追踪目标物。常见的免疫分析法包括酶联免疫分析法(ELISA)、免疫亲和柱-荧光光度法和胶体金免疫分析法等[25-27]。
因为抗体-抗原的特异性结合具有较高的亲和性,免疫分析法一般都具有专一性高、特异性强的优点,酶联免疫法和侧流试纸条法在ZEN检测方面应用十分广泛。ELISA分析法在实际应用中常被制成试剂盒,操作简单、灵敏度高。胶体金免疫层析法也具有检测速度快、检测限低的优点。但是,抗体和抗原制备较困难且不易保存,成本高、重复性差等缺点常限制其应用[28-30]。Hendrickson等[31]建立了一种基于磁性铁纳米颗粒(MNPs)的酶联免疫吸附法(ELISA)测定ZEN,如图1所示。该方法以高度分散的MNPs为载体固定抗体,基于MNP的免疫吸附剂与大体积样品中游离的ZEN相互作用,并将其转移到较小体积(分析物的初始浓度),然后与ZEN-光氧化物酶复合物结合;未反应组分中的MNP-抗体-ZEN/ZEN-辣根过氧化物酶(HRP)复合物经过磁性分离后,体系中再加入化学发光底物与HRP反应,进行测定。该方法对ZEN的检测限达4 pg/mL。但由于抗体的加入使成本较高,不易控制。且实际检测中可能出现重复性差、假阳性率高等情况,样品中的氧化酶、蛋白酶等也可能对检测结果造成影响。为获得更稳定的检测方法,Duan等[32]以QBs作为新型荧光探针,建立了侧向免疫层析法,用于谷物中ZEN含量的定量检测,如图2所示,其荧光强度约为相应QDs的2 800倍。首先采用微乳液法制备有机可溶性CdSe/ZnSQDs胶囊,获得强荧光QBs;接下来合成QB-mAbs探针,并将样品与探针预混合,加入样品垫;QB-mAbs与ZEN的免疫复合物同IgG发生反应,在检测线(T线)上形成荧光带;多余的QB-mAbs被控制线(C线)捕获结合,在C线上形成荧光带,样品中ZEN含量越多,测试线上荧光强度越低。得到ZEN的线性范围为0.125~10 ng/mL,检测限为0.0625 ng/mL。

图1 磁吸附-酶联免疫吸附法测定ZEN原理图[31]Fig.1 Schematic presentation of ZEN determination by MNPs-ELISA
与光度法相比,荧光分析法通过监测体系荧光信号前后变化对结果进行测定,灵敏度较高,可检测微量或超微量样品。Zhan等[33]建立了一种直接竞争荧光酶联免疫吸附法,如图3所示。该方法将易受H2O2影响的CdTe QDs(MPA-QDs)作为荧光信号输出;ZEN与过氧化氢酶(CAT)结合,代替HRP标记的ZEN作为竞争抗原。在没有ZEN时,竞争抗原(ZEN-CAT偶联物)表面ZEN被微板上的ZEN单抗捕获。CAT消耗了H2O2,MPA-QDs的荧光存在橙色荧光。存在ZEN时,ZEN与ZEN单克隆抗体发生竞争性反应,与ZEN单抗结合的CAT降低,未被消耗的H2O2抑制MPA-QDs的荧光,导致荧光信号较低。此法中ZEN定量线性范围为2.4 pg/mL~1.25 ng/mL,检测限为4.1 pg/mL。
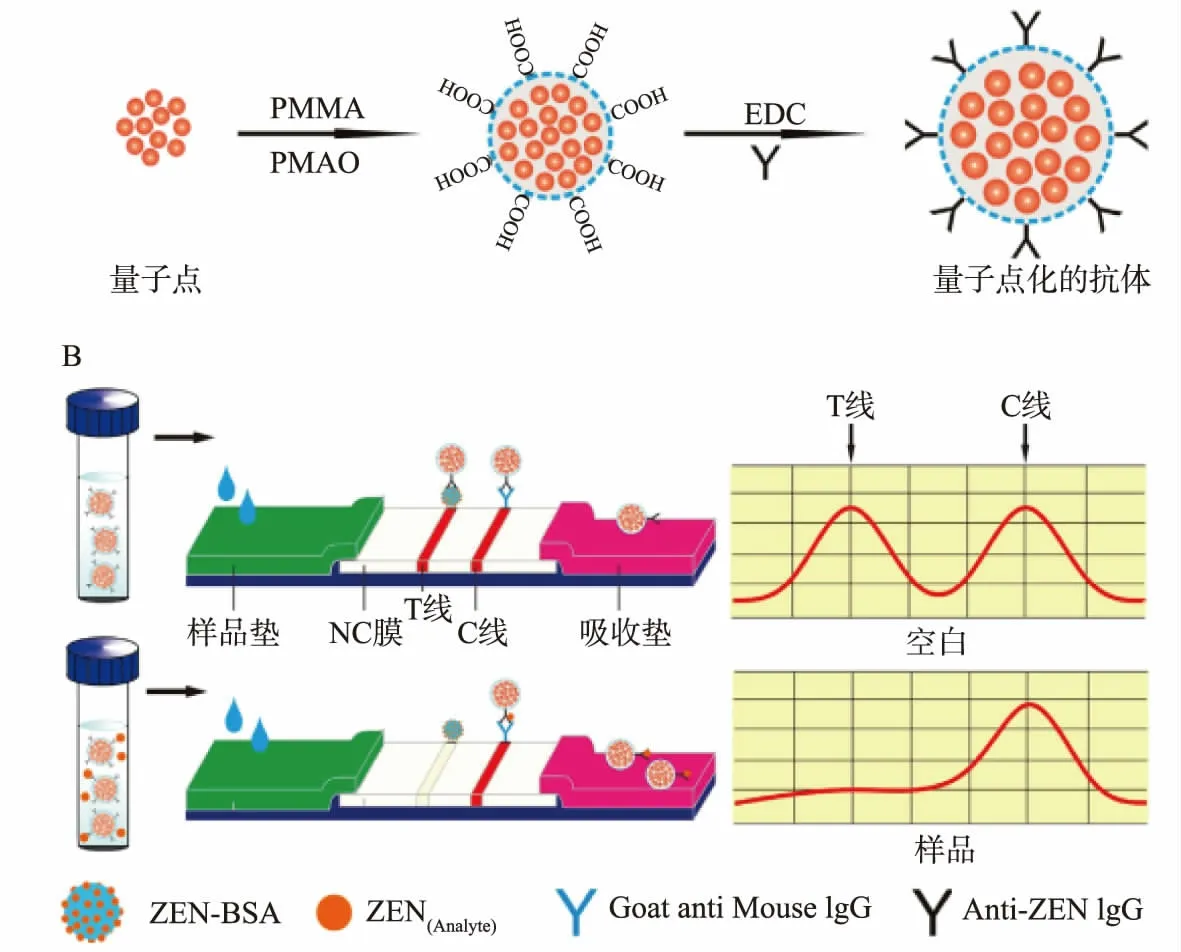
图2 QBs-侧向流动免疫荧光试纸条测定ZEN原理图[32]Fig.2 Schematic presentation of ZEN determination with QBs-lateral flow immunofluorescence strip

图3 荧光酶联免疫吸附法测定ZEN原理图[33]Fig.3 Schematic presentation of the determination of ZEN by fluorescence-linked immunosorbent assay
基于现场检测的要求,Li等[34]建立了一种横向流动免疫色谱法测定谷物中ZEN的方法,如图4所示。银纳米粒子(AgNPs)的吸收峰在430 nm处,对碳点(CD)在459 nm处的发射峰有强猝灭作用。CD与卵蛋白(OVA)结合形成CD-OVA,作为供体信号探针;AgNP-Ab作为受体信号探针。样品和AgNPAb信号探针在样品垫处预混合。不存在样品时,AgNP-Ab与ZEN-OVA(T线)结合并使CD-OVA(C线)荧光猝灭,Ab被C线捕获,T线无荧光、有AgNP紫外吸收,C线有蓝色荧光、有AgNP紫外吸收;存在样品时,T线与ZEN竞争结合AgNP-Ab,T线荧光不完全猝灭,Ab被C线捕获;T线有蓝色微弱荧光、无AgNP紫外吸收,C线有荧光、有AgNP紫外吸收。谷物样品中ZEN检测线性范围为1~2.5μg/kg,检测限为0.1μg/L。此法在检测性能改善的基础上实现了大通量检测。免疫色谱分析法将免疫分析方法的快速、特异性与仪器分析方法的精确性等优点结合起来,比HPLC更稳定、可靠,已成为ZEN定量检测的重要方法。表3列举了免疫分析法检测ZEN的线性范围和检测限。
3 生物传感器法
生物传感器是利用酶、抗体、抗原、微生物、组织、核酸、细胞器、全细胞等生物识别元件,将相互作用转化为可测信号的一类化学物质检测装置[35]。一般以光学、电化学等为输出信号。根据传感器的类型,生物传感器主要分为四种类型:电化学生物传感器、光学生物传感器、测温生物传感器和压电生物传感器[36]。均具有选择性好、灵敏度高、分析速度快、成本低、可应用于现场即时检测等特点[37]。
随着光学技术的进步与发展,光学生物传感器的发展十分迅速,它能够在复杂样品中检测目标而不需要复杂的预处理,在食品安全控制中有重要的应用前景。干扰小、噪音低、灵敏度高等优点使其成为检测食品小分子污染物的理想选择。

图4 横向流动免疫色谱法测定谷物中的ZEN原理图[34]Fig.4 Schematic presentation of ZEN determination in the grain by transverse flow immunochromatography
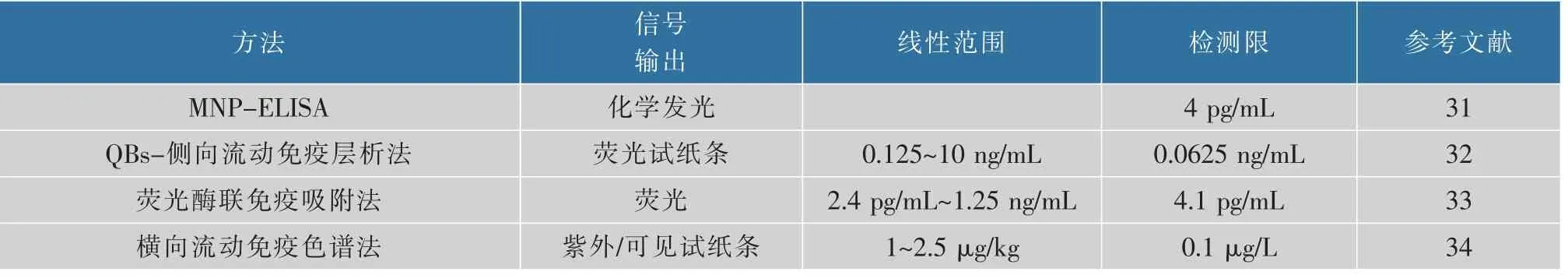
表3 免疫分析法检测ZEN的线性范围和检测限Table 3 Linear range and detection limit of ZEN detected by immunoassay
Wu等[38]建立了一种利用金纳米颗粒(AuNPs)结合适配体探针来检测粮食中的ZEN的侧向流动试纸条法,如图5所示。此法基于DNA1(在T线上)与样品ZEN对AuNPs-Apt的竞争结合。没有ZEN时,AuNPs-Apt与DNA1通过碱基互补配对结合形成AuNPs-Apt-DNA1(T线),AuNPs-Apt与DNA2通过碱基互补配对结合形成AuNPs-Apt-DNA2(C线),此时试纸条上有两条线;存在ZEN时,AuNPs-Apt与ZEN结合,减弱AuNPs-Apt与DNA1的结合,T线的颜色变浅,T线的深浅取决于溶液中的ZEN浓度,而AuNPs-Apt与DNA2的结合不受ZEN的影响,C线颜色不变。此法中,ZEN定量检测的线性范围为5~200 ng/mL,检测限为20 ng/mL。此法克服了适配体的局限性:无须在实验室中开展,可用肉眼观察实验结果。作为一种产品使用,可以为众多食品污染物和样品提供快速、简单、灵敏的检测方法。
Goud等[39]采用高水分散性的去角质功能化氧化石墨烯(FGO)作为FAM荧光的猝灭剂,FAM-apt为荧光基团,定量检测ZEN,如图6所示。无目标时,FGO与FAM-适配体之间π堆叠形成复杂结构,导致FAM-适配体荧光猝灭;有目标时,目标与适配体特异性结合,减弱FGO与FAM-适配体相互作用,荧光恢复。ZEN检测线性范围0.5~64 ng/mL,检测限0.5 ng/mL。此法中,FGO的作用是:降低背景信号,提高信噪比。大多数常用荧光团标记物的荧光寿命较短,且需要特定的存储条件来稳定其荧光响应,导致荧光法测定成本较高。在此背景下,未来的工作方向可以通过整合荧光纳米颗粒作为适配体标签研究如何进一步提高检测性能。大多数纳米材料粒子能抑制过氧化物酶活性,这种抑制作用同样会影响过氧化物模拟酶的活性。Sun等[40]研制了一种AuNPs比色适配体传感器用以检测ZEN,如图7所示。金纳米粒子(AuNPs)具有类似过氧化物酶的活性,而ZEN适配体可抑制其活性。无ZEN时,适配体被静电吸附在AuNPs表面,抑制AuNPs催化H2O2氧化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB),形成AuNPs表面屏蔽现象;有ZEN时,适配体与ZEN特异性结合,适配体结构改变,不能与AuNPs表面形成静电吸附,AuNPs催化H2O2氧化TMB,使无色的TMB转变成蓝色的oxTMB,吸光结果在630 nm处测定。ZEN检测线性范围为10~250 ng/mL,检测限为10 ng/mL。此法不是基于未加控制的聚合,而是基于模拟酶活性,故灵敏度高。在实际样品分析中,此法的高特异性和可行性说明其在ZEN检测方面有巨大潜力。此法只是一项利用过氧化物酶样活性进行比色分析的初步试验,后续可考虑结合AuNP等纳米材料或信号放大策略,提高灵敏度,拓宽分析范围。
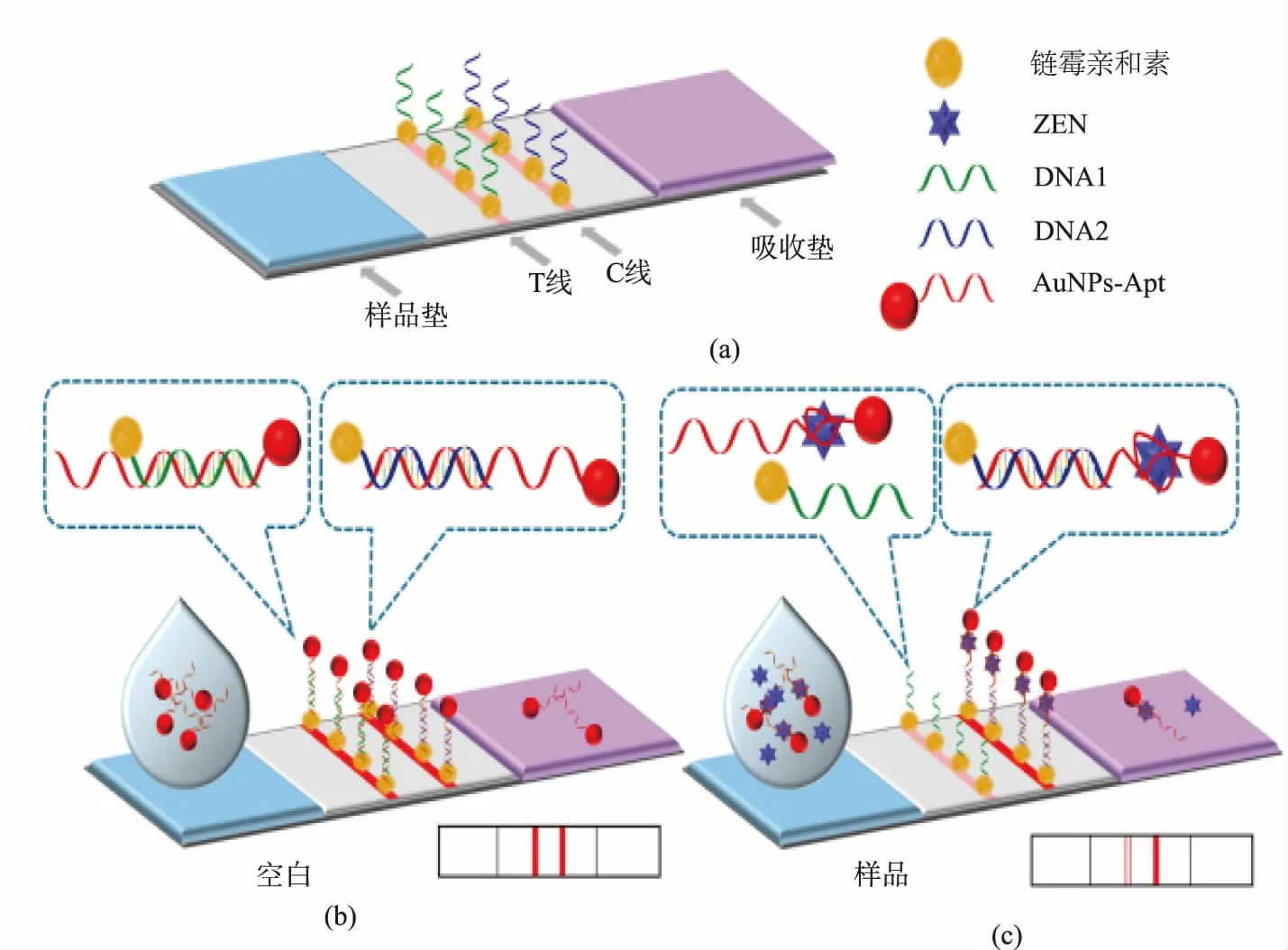
图5 适配体侧向流动试纸条检测ZEN原理图[38]Fig.5 Schematic presentation of ZEN detection for aptamer-based lateral flow strip
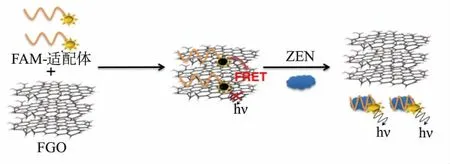
图6 FGO荧光猝灭传感器测定ZEN原理图[39]Fig.6 Schematic presentation of ZEN detection by FGOfluorescence quenching sensor

图7 AuNPs比色适配体传感器检测ZEN原理图[40]Fig.7 Schematic presentation of ZEN detection byAuNPs colorimetric aptamer sensor
Taghdisi等[41]以核酸适配体、金纳米颗粒及基于核酸外切酶辅助的循环放大建立非靶向核酸适配体传感器,对ZEN进行比色检测,如图8所示。
适配体和cDNA分别被固定在AuNPs表面(Apt-AuNPs和cDNA-AuNPs);适配体DNA和cDNA在AuNPs表面距离靠得很近,会引起碱基互补配对杂交,此时加入核酸外切酶Ⅲ(ExoⅢ),会作用于双链DNA的3′末端,使cDNA从3′端消解,使得AuNPs表面裸露出来,再加入4-甲基苯酚,其到达AuNPs表面并被还原为4-氨基苯酚,环境颜色由黄色变为无色;而在ZEN存在的情况下,适配体DNA与ZEN特异性结合,cDNA以单链状态存在,对ExoⅢ消化有抗性,AuNPs表面空间位阻大,直径大,到达AuNPs表面的4-甲基苯酚较少,环境颜色保持黄色不变,此时测定其吸光值。这种方法的线性范围为20~8 000 ng/L,检测限达到10 ng/L。ExoⅢ辅助信号的放大产生了优异的传感性能,在样品中的应用进一步证明了其可靠性,表明所设计的适配体传感器是一种很有前途的ZEN检测分析技术(表4)。

图8 Walker循环放大比色适配体传感器检测ZEN原理图[41]Fig.8 Schematic presentation of ZEN detected by the Walker loop magnification colorimetric aptamer sensor

表4 生物传感器法检测ZEN的线性范围和检测限Table 4 Linear range and detection limit of ZEN detected by biosensor
4 展望
近年来,食品和饲料中ZEN的全球性污染严重威胁生态环境安全和人类健康。因此,建立和完善相应的检测技术是分析检测工作的重要方向。早期的薄层色谱法成本低,操作简便,但耗时长,精确度低;高效液相色谱法提高了检测的精确度,但操作烦琐,成本偏高;随着检测技术的发展,联用技术实现了多种毒素同时检测,且进一步提高了检测灵敏度和结果稳定性,但使用的仪器过于昂贵。适配体生物传感器的方法弥补了传统检测方法的诸多不足,但这种方法还有待进一步发展与探究。若要实现对食品安全的监管,今后应从以下几个方面展开研究:(1)满足快检要求。借助比色等检测技术,建立可视化分析方法,满足日常监管需要。(2)高灵敏度和特异性。将各种方法结合使用,进一步提高检测方法的灵敏度和特异性。(3)多种毒素同时检测。日常食品检测大多需要多毒素同时分析,多种毒素同时检测的方法可以节省时间和成本。
综上所述,建立快速、准确、高灵敏度、低成本的ZEN检测方法仍是食品安全领域的研究方向。
