硅胶吸附-交联脂肪酶的研究
2021-06-24韩生华王利刚
徐 然,韩生华,王利刚
(山西大同大学化学与化工学院,山西大同 037009)
脂肪酶(Lipase) 是重要的生物酶催化剂,也是重要的工业酶制剂,可参与催化含酯基结构物质的水解、合成以及交换等[1]。脂肪酶具有高效催化效率、温和反应条件、高度特异性以及较少副产物等诸多优点[2],越来越广泛地被应用到能源、食品、医药以及日化等领域[3]。然而,游离状态脂肪酶在催化过程中所存在的不稳定性、不能分离与不能再利用等缺点,阻碍了脂肪酶的进一步发展与应用[4]。脂肪酶固定化技术解决了这些不足,正被越来越多的学者所研究[5]。
固定化脂肪酶技术是指采用某种物理或者化学的方法使脂肪酶被限制在专属的区域内发生催化反应的技术[6]。常用的脂肪酶固定技术大致分为吸附法、包埋法、交联法和共价结合法[7]。吸附法是由离子键、范德华力或者氢键等分子间力将脂肪酶吸附到相应载体上,酶分子的活性结构不易被改变,因此能保留较高的活性[8]。但脂肪酶在载体上吸附得不太牢固,在催化使用中容易脱离载体[9-10]。交联法是指通过脂肪酶与载体或者脂肪酶与脂肪酶的中间形成共价键从而交织成一个结实三维网状结构来进行固定化[11],交联法固定的酶稳定性高。一般来说,交联法都是与其它方法一起使用,如吸附加交联等,从而形成双重固定化,使得酶活较高的同时也增加了稳定性[12]。
本文考察了3 种固定方式对脂肪酶固定效果的影响,并对最优固定方式中的关键条件进行了优化,以期为脂肪酶今后进一步的应用提供参考。
1 实验部分
1.1 实验试剂与仪器
脂肪酶(酶活力:6.08×104μmol/g,实验室自制);硅胶,青岛海洋化工有限公司;橄榄油为化学纯,无水乙醇、氢氧化钠、磷酸氢二钠、50%戊二醛、磷酸二氢钠、邻苯二甲酸氢钾、聚乙烯醇均为分析纯,购自天津康科德有限公司。
DF-101S 集热式恒温磁力搅拌器、SHZ-D 循环水式真空泵,常州市国华仪器有限责任公司;HH-2两孔水浴锅、KDM 电热套,南京市桑力设备厂;SB-5200DTDN 超声清洗机,泰州市力航实验设备公司;MA200 电子天平,上海志荣科技有限公司;101AB-1电热鼓风干燥箱,苏州纳美瑞电子有限公司。
1.2 载体处理
称量硅胶20 g,加入60 mL 的18.5%的盐酸水溶液,于60 ℃的水浴中回流6 h,之后抽真空过滤。滤得的固体使用去离子水清洗多次直至中性,然后110 ℃条件下干燥12 h,即为活化的硅胶。
1.3 固定方法的选择
(1)单吸附8 h:称取活化硅胶0.5 g,分别加入0.1 mol/L 的pH 为7.5 的磷酸缓冲液5 mL,及浓度为3 mg/mL 的脂肪酶溶液5 mL,于室温下反应8 h 后抽真空过滤,分别收集并测定游离酶、滤液和回收的固定酶的酶活,计算酶活回收率。
(2)吸附6 h后加戊二醛交联2 h:上述(1)中室温吸附6 h之后继续加入适宜浓度的戊二醛搅拌2 h,之后抽真空过滤,分别收集并测定滤液和固定酶的酶活,计算酶活回收率。
(3)吸附交联8 h:上述(1)中在加入磷酸缓冲液和酶液后直接加入戊二醛交联剂室温搅拌8 h,计算酶活回收率。

1.4 脂肪酶活力测定方法
采用橄榄油乳化法测定。酶活:在40 ℃、pH 为8.0磷酸溶液环境中,每克脂肪酶每1 min催化乳化剂所生成的脂肪酸的量(μmol)。
分别取pH 为8.0 的0.1 mol/L 磷酸缓冲液4.0 mL和乳化剂5.0 mL 加入到标签为样品a、样品b 和空白c 3 个瓶子内,于40 ℃保温5.0 min 后,将1.0 mL 待测酶溶液加入到样品a、b瓶内催化10.0 min。之后同时向a、b、c 中各加入20.0 mL 无水乙醇终止反应。分别滴加几滴酚酞,用NaOH 滴定水解出来的脂肪酸,当反应体系变微红时,记录反应的NaOH的量。
脂肪酶活力=[ (a+b)÷2-c ]×N×F÷t
式中:a、b—样品a、b 分别反应的NaOH 体积量,c—空白c 反应的NaOH 体积量,N—NaOH 浓度,F—稀释倍数,t—时间(min)。
2 结果与讨论
2.1 固定方法的选择
3种方法的固定结果对比见表1。
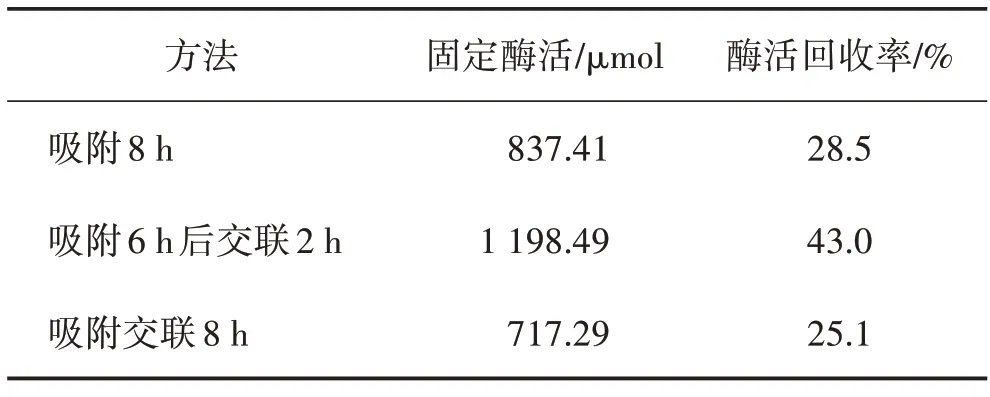
表1 固定方法的选择
由表1 可以看出最佳的固定方法为:吸附6 h 后加戊二醛交联2 h。这种方法是先通过吸附法将脂肪酶吸附固定在已活化的硅胶载体上,进而通过交联法在吸附了脂肪酶的硅胶外围进行交联,即进行双重的固定,因此具有较好的酶活回收率。仅仅使用吸附法固定后的脂肪酶较不稳固,在反应中较易脱落。而吸附交联法同时进行,可能又使得脂肪酶分子与分子之间相互缠绕交联,影响其在硅胶载体上的充分固定。因此选取先吸附再交联的方式对目标酶进行固定。
2.2 优化脂肪酶的固定条件
2.2.1 优化给酶量
用pH 为7.5的0.1 mol/L 磷酸缓冲液配制浓度分别为1、3、5、7、9 mg/mL 的脂肪酶液,并以此进行给酶量优化。给酶量影响固定反应的结果见图1。

图1 给酶量的优化
当体系中加入1 mg/mL 给酶量,此时酶活回收率处于较低值。当体系中加入3 mg/mL 给酶量,酶活回收率达到最高,达19.0%。继续增大给酶量,酶活回收率显现降落趋势。可能是因为活化的硅胶载体的量是一定的,其所能固定的脂肪酶的量也是一定的。当固定到载体上的脂肪酶达最大状态后,再增加脂肪酶则不会提高最终产物的量,反而会因为酶与酶之间发生团聚影响最终固定产物的活性,所以图中曲线先升后降最后趋近平缓。
2.2.2 优化固定温度
在3 mg/mL 给酶量下,将反应体系分别放到0、10、20、30、40、50 ℃的水浴中进行固定温度的优化。温度影响固定反应的结果如图2。
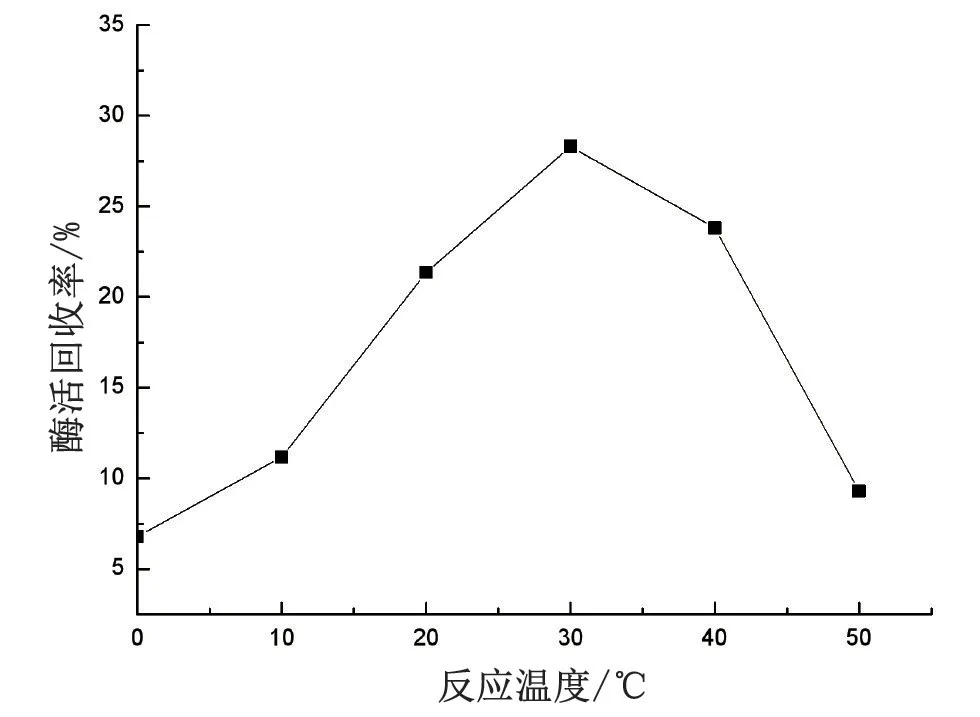
图2 优化固定温度
随着固定温度的增高,酶活回收率也在慢慢增大,当固定温度控制在30 ℃时,其回收率最高,达28.3%。继续增高温度,酶活回收率呈现下降现象。其原因是,脂肪酶的本质是蛋白质,温度对蛋白质的影响极为重要,温度过高会使蛋白质活性发生改变,而温度太低则抑制反应速度。因此过高或者过低的温度都会影响其最终的回收率。
2.2.3 优化固定时间
在3 mg/mL给酶量以及30 ℃下,选择1、2、4、6以及8 h进行固定反应中吸附反应时间的优化,见图3。
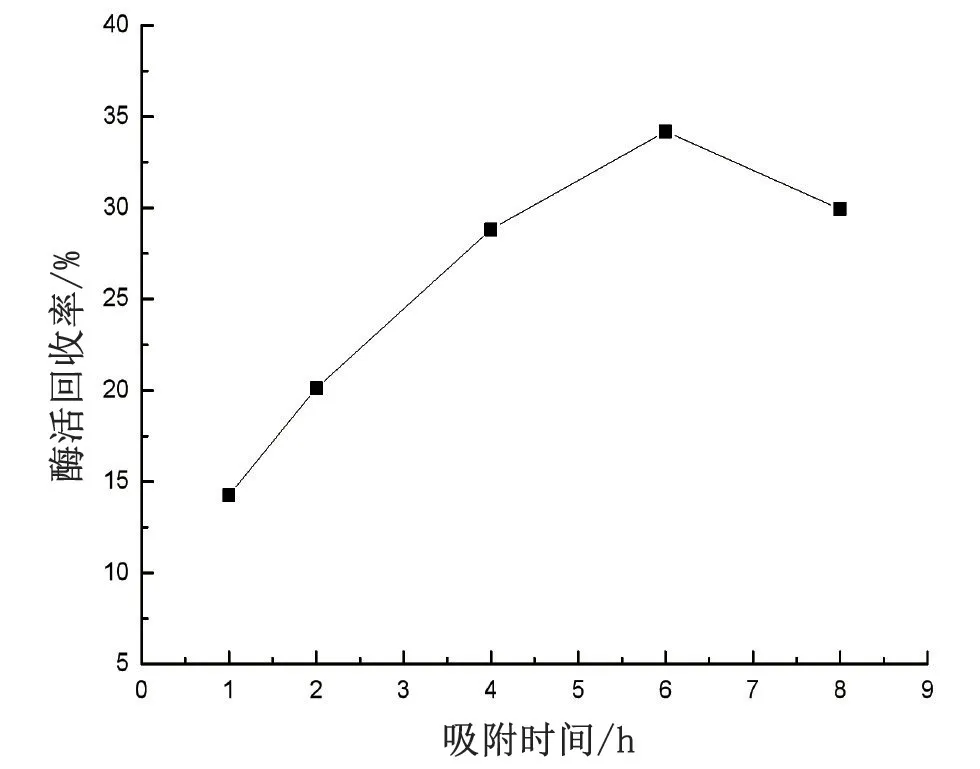
图3 优化吸附时间
吸附反应时间为6 h 时,得到的回收率为34.2%,到达最高。进一步延长吸附时间,酶活回收率表现出下降的结果。吸附反应时间如果太短,脂肪酶分子还未在硅胶载体上彻底吸附。而随着吸附时间的加长,曲线呈下降趋势,是因为固定过程中进行的吸附过程主要是靠分子间作用力来完成的,随着时间的增加吸附在载体上的脂肪酶在不断搅拌过程中可能会出现脱落的现象,因此脂肪酶的固定量减少了。而且长时间的搅拌也会造成脂肪酶分子的部分失活,酶活回收率也因此降低。
2.2.4 优化固定pH值
在3 mg/mL 给酶量、30 ℃以及吸附6 h 条件下,配制pH 依次是5.5、6.5、7.0、7.5、8.0 以及8.5 的磷酸缓冲液,并以此进行酸碱度的优化,结果见图4。

图4 优化固定pH
在pH小于7.5时,增加pH值,其酶活的回收率也会随之变大。当pH 为7.5 时,酶活回收率最高达40.5%。进一步增大pH 值,则会降低酶活回收率。酸碱环境对该酶的影响极大,pH 值的不同会改变其微观结构,从而改变酶的特性,过酸或者过碱的环境都能使酶的微观结构产生变化,这样就会使脂肪酶发生活性的改变。pH值还可以改变脂肪酶所催化的底物的离解状态,进而改变脂肪酶与底物的相互接触和催化作用。因此,酶活回收率在过酸过碱条件下均会显示出大大降低的结果。
2.2.5 优化戊二醛的浓度
在3 mg/mL 给酶量、30 ℃、吸附6 h 以及pH 值为7.5 的条件下,配制浓度分别为0.05%、0.1%、0.25%、0.5%、1%的戊二醛水溶液,并以此进行戊二醛浓度的优化,结果见图5。
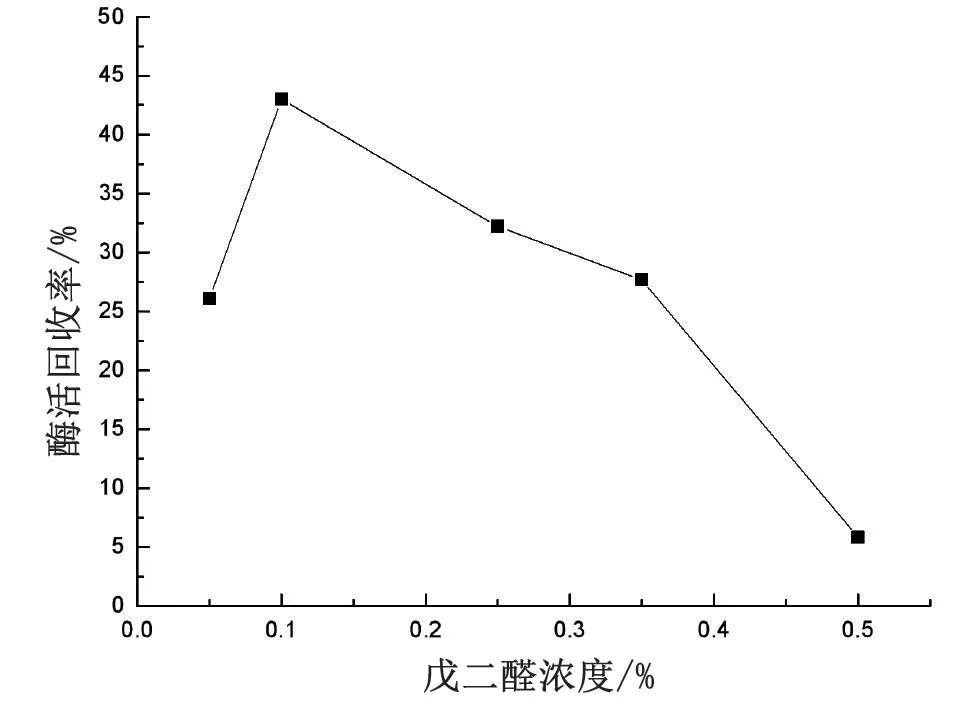
图5 优化戊二醛浓度
戊二醛的浓度为0.1%时,酶活回收率测得43%,为最高。当浓度低于0.1%时,由于其浓度太低,提供的固定位点较少,导致交联效果不好,因此脂肪酶的固定效果不佳。而当其浓度持续增大,酶活回收率却一直下降,这可能是由于随着浓度的增大,戊二醛除了会与载体上吸附的脂肪酶交联还会与反应体系中存在的游离脂肪酶交联,从而导致脂肪酶在载体上的固定量降低,并且戊二醛是有毒化学试剂,浓度太大会使得脂肪酶变性失活,从而大大影响酶活回收率。
2.3 酶学性质分析
2.3.1 重复使用性
分析游离状态的脂肪酶与固定后的脂肪酶的重复使用性,结果如图6。由于游离状态的脂肪酶分子粒径太小无法回收,因此无重复使用性。而固定之后的脂肪酶在进行6 次循环使用后,还有45.54 %的初始酶活。
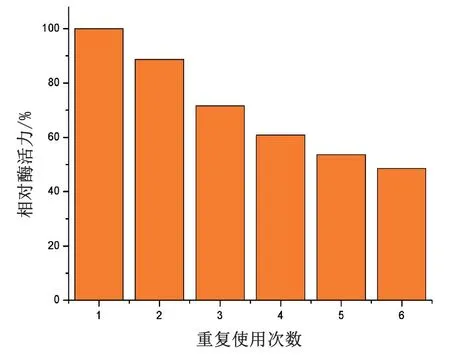
图6 固定化脂肪酶的重复使用性
2.3.2 室温保存性
在每天同一时间点分别测定游离状态和固定状态的脂肪酶室温下的酶活力。随着储存时间增加,酶活力都会慢慢降低。因此好的储存稳定性会增加其工业化应用价值。由图7可以看出,固定状态的脂肪酶比游离状态的具有更高的稳定性,10d后仍有33.12%的初始酶活。
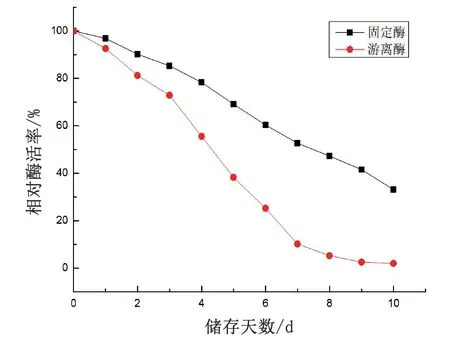
图7 脂肪酶的室温保存性
3 结论
利用活化处理后的硅胶作载体,实验室自制脂肪酶(脂肪酶活力:6.08×104μmol/g)为样品酶,通过3种方法进行脂肪酶的固定,得出先吸附后交联的方法固定脂肪酶的效果最好。进一步优化固定过程中的各个因素,最后得到其最优固定条件是:给酶量3 mg/mL,固定温度30 ℃,吸附反应时间6 h,pH 为7.5,戊二醛为0.1%。在该最优条件下所得到的固定酶活回收率为43%。且固定之后的脂肪酶获得了重复使用性及较好的室温保存性。将脂肪酶进行固定后,不仅降低了游离脂肪酶的使用成本,而且扩宽了其今后工业化应用的道路。
