奈达铂-半乳糖基化壳聚糖微球的制备及其与热疗联合对非小细胞肺癌细胞的作用
2021-06-24孔忆寒庞静静赵丽玲母心灵
孔忆寒,庞静静,赵丽玲,母心灵,刘 伟
( 1. 郑州市第一人民医院,河南 郑州 450004;2. 郑州大学药学院,河南 郑州 450001;3. 河南省胸科医院,河南 郑州 450003)
非小细胞肺癌占全球新诊断肺癌病例的80%~85%,并且非小细胞肺癌在所有肺癌中的治愈率较低,死亡率最高[1-6]。奈达铂(NDP)是第2代基于铂的治疗药物[7-9]。与顺铂相比,NDP的水溶性要高10倍,并且毒理学特性得到改善。NDP的药代动力学特性与卡铂相似。然而,与顺铂和卡铂相比,其肾毒性有所降低[7-8,10]。但是NDP在治疗剂量下是有毒的,这限制了其临床应用。热疗(HT)相关的临床试验表明,其可以增强许多药物的抗肿瘤作用[11],并且HT和化疗的协同作用受所用温度的影响[12]。因此我们将具有靶向性的水溶性半乳糖基化壳聚糖(GC)作为载体制备奈达铂-半乳糖基化壳聚糖微球(NDP-GC MP),然后将其与HT联合作用于人肺鳞癌细胞系SK-MES-1,以初步探讨在非小细胞癌中的应用。
1 材料与方法
1.1 材料和仪器人肺鳞癌细胞系SK-MES-1购自中国科学院;最低必需培养基(MEM)购自北京索莱宝生物科技有限公司;细胞计数试剂盒8(CCK-8)购自郑州德雅生物科技有限公司;DHP-9032型电热恒温CO2培养箱,上海恒一科学仪器有限公司;Synergy H1型全功能酶标仪,美国BioTek仪器有限公司;SYQ-DSX-280B型自动电热压力蒸汽灭菌锅,上海申安医疗器械厂;ECLIPSE 80i型荧光显微镜,日本Nikon公司;BD FASS CantoⅡ型流式细胞仪,美国BD Biosciences公司。
1.2 实验方法
1.2.1 交联的NDP-GC微球的制备 准确量取液体石蜡22 mL,并向其加入分散剂span80 450 μL,于磁力搅拌器中搅拌(600 r/min)后超声去除气泡,静置作为油相;配置10 mg/mL的GC溶液并取3 mL超声去除气泡,静置作为水相,向水相中加入NDP 20 mg;将NDP-GC溶液滴加到油相中,以形成油包水乳液,继续磁力搅拌溶液2 h。将体积分数3%戊二醛作为交联剂添加到溶液中,并将溶液搅拌3 h。然后将得到的微粒悬浮液离心(3 000 r/min,20 min),最后用石油醚、乙醇和双蒸馏水洗涤。
1.2.2 微球的理化特性 将NDP-GC微球分散在乙醇中并将分散体滴在铝箔上,然后常压下干燥。将干燥的样品于真空下溅射到镀膜金上后用扫描电子显微镜(SEM)观察测量。
1.2.3 细胞培养 将SK-MES-1细胞在MEM中培养,并补充适量的100 mg/mL 链霉素、100 u/mL青霉素和质量分数1%丙酮酸钠,在体积分数5% CO2、37 ℃的潮湿环境中于孵育。
1.2.4 体外细胞毒性测定
1.2.4.1 不同温度对细胞毒性的影响 CCK-8测定法是用于检测细胞增殖、活力和毒性的一种常用检测方法。当细胞汇合达到80%~90%后,使用质量分数0.25%胰蛋白酶-EDTA将细胞从烧瓶中分离,离心(1 000 r/min,5 min)收集细胞沉淀,然后除去上清液。将细胞沉淀重悬于完全培养基中,并对细胞计数。将SK-MES-1细胞以每孔1×104个的密度接种到96孔板中,在体积分数5% CO2、37 ℃的条件下培养。24 h后,将细胞用不同浓度(0、1、2、4、8、16、32、64或128 μg/mL)的NDP处理。应用不同的温度来研究细胞对热损伤的敏感性。A组于体积分数5% CO2、37 ℃的培养箱中培养24或48 h。B组、C组和D组放入水浴中(温度分别为41 ℃、42 ℃和43 ℃)各保持1 h,然后将其转入培养箱中继续培养23或47 h,并在孵育24或48 h后检测。此后,每个孔中各加入CCK-8溶液10 μL,并将板温育4 h。使用自动酶标仪于450 nm波长下读取结果,并计算细胞抑制率。
1.2.4.2 不同HT处理时间对细胞毒性的影响 将SK-MES-1细胞以每孔1×104个细胞的密度接种到96孔板中,并在体积分数5% CO2、37 ℃的条件下培养24 h。用不同浓度(0、1、2、4、8、16、32、64或128 μg/mL)的NDP处理A~D组,然后将其置于43 ℃的水浴中分别保持0.5、1、1.5或2 h,在37 ℃条件下继续培养,然后在24或48 h检测。
相同的实验设计用于探讨NDP-GC MP对非小细胞肺癌的影响。将NDP-GC微球设置为不同的浓度(0、1、2、4、8、16、32、64或128 μg/mL)。将细胞用NDP-GC微球处理,置于43 ℃的水浴中2 h,于37 ℃回收,然后在24或48 h进行检测。
1.2.5 细胞周期和凋亡测定 为了阐明HT和NDP-GC MP的作用机制,我们使用流式细胞仪确定暴露于不同浓度的NDP/NDP-GC MP加热或不加热的SK-MES-1细胞的细胞周期分布和凋亡。将MEM培养基中的4×105SK-MES-1细胞接种到6孔板中,并在体积分数5% CO2、37 ℃的条件下生长。将细胞用32 μg/mL NDP/NDP-GC MP处理24 h,将未处理的细胞作为对照。A组板直接放入培养箱中于培养24 h,B组板首先在43 ℃的水浴中孵育2 h,然后将其转移至培养箱中继续培养22 h检测。通过胰蛋白酶消化和离心收集附着的细胞,收集的细胞先用PBS洗涤3次,然后在70 ℃的乙醇中于-20 ℃固定16~18 h。固定的细胞用预冷PBS洗涤2次,并用PI染色30 min。使用流式细胞仪分析染色的细胞。
1.2.6 Annexin V-FITC/PI细胞凋亡分析 将SK-MES-1细胞预先用0、32 μg/mL NDP/NDP-GC MP进行加热或不加热(43 ℃,2 h)处理,然后用PBS洗涤3次,收集并用膜联蛋白V-FITC细胞凋亡试剂盒染色。然后将5 μL PI加入到溶液中,在室温下培养15 min。使用流式细胞仪进行数据采集。

2 结果
2.1 NDP-GC微球的扫描电镜观察经乳化-化学交联法合成的NDP-GC微球外表光滑致密,少数出现外表不平整现象,可能是由于干燥过程中微球黏连现象造成的。
2.2 体外细胞毒性NDP的细胞毒性是具有时间和剂量依赖性的,并且其对细胞的抑制作用随温度的升高而增加。在不同温度下的实验表明,抑制率在43 ℃下持续48 h最高。培养24 h时在不同温度(37、41、42和43 ℃)下的半数抑制浓度(IC50)分别为80.22、53.15、42.12和35.78 μg/mL,培养48 h时分别为298.54、209.66、159.15和118.10 μg/mL。另外在43 ℃(0.5、1、1.5和2 h)的不同持续时间内测量了抑制率,结果表明随着加热持续时间的增加,NDP的细胞毒性也增加,当加热时间增加到2 h时,IC50值降低了大约1/6。NDP-GC MP对SK-MES-1细胞的抑制率比单独使用NDP时要高得多。GC微球对SK-MES-1细胞的细胞毒性<10%,这表明本研究中制备的载体材料相对安全,可用于后续实验研究。见图1~4。

图1 不同温度下SK-MES-1细胞对NDP的敏感性

图2 不同加热时间下SK-MES-1细胞对NDP的敏感性

图3 SK-MES-1细胞对NDP-GC MP的敏感性

图4 GC微球对SK-MES-1细胞的细胞毒性
2.3 细胞周期分析流式细胞仪用于测量细胞DNA含量以进行细胞周期分析。结果显示,单独NDP/NDP-GC MPs和单独HT与两者联合时存在显着差异。联合治疗后,G2/M期的细胞比例明显更高,使细胞停滞于G2/M期。见图5。
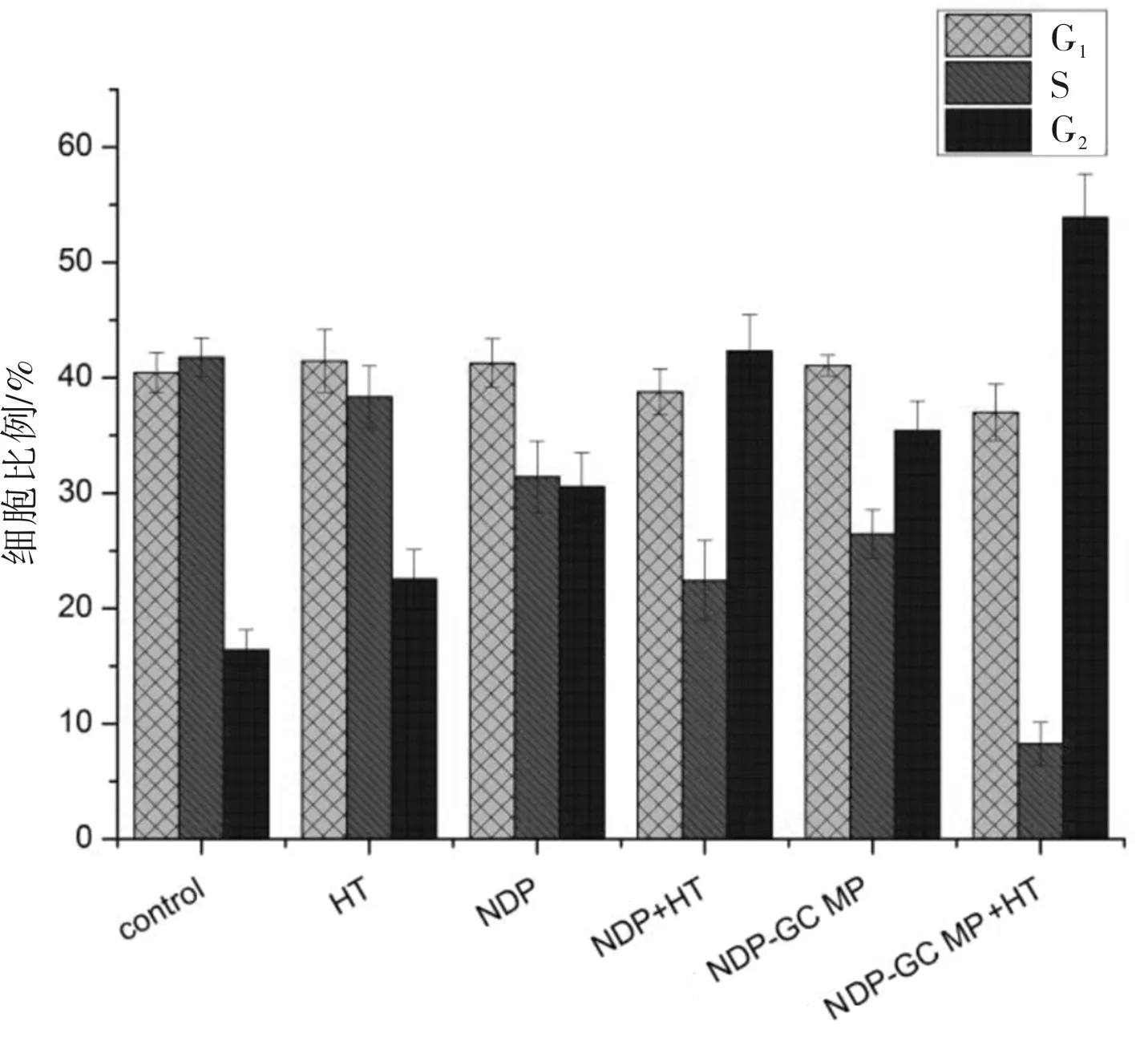
图5 不同条件处理后SK-MES-1细胞周期分布
2.4 细胞凋亡分析单独NDP/NDP-GC MP和单独HT与两者联合时都能诱导细胞凋亡,但是凋亡速率明显不同。HT、NDP、NDP-GC MP、NDP + HT和NDP-GC MP + HT凋亡率分别为(1.2±0.2)%、(25.0±1.2)%、(40.4±2.1)%、(46.0±2.7)%和(72.1±2.7)%。可见细胞凋亡率与HT有关,而且NDP-GC MP+ HT联合组的凋亡率明显高于其他组,约为NDP组的3倍。
3 讨论
本研究首先使用乳化-化学交联法将NDP与半乳糖基化壳聚糖组合为载体,制成NDP-GC微球,以增加NDP的靶向作用并降低其毒性。此外,SK-MES-1细胞可以高表达半乳糖凝集素[13],因此NDP-GC MP可以通过半乳糖受体介导内吞作用,靶向肺鳞状细胞癌,因此NDP-GC MP是在肺中具有双重靶标的微球。
此外,HT通常与常规抗肿瘤药物联合使用以增强药物敏感性和细胞毒性[14]。然而,由热引起的细胞毒性的类型和频率高度依赖于所达到的细胞类型和温度[15]。我们研究了NDP/NDP-GC MP和HT联合应用中的3个关键参数:温度、受热持续时间和NDP浓度。首先,我们比较了SK-MES-1细胞对NDP的敏感性,因为临床上已证明NDP具有抗非小细胞肺癌的活性,但尚无NDP/NDP-GC MP与HT联合用于治疗肺鳞癌的报道。细胞毒性结果表明,NDP/NDP-GC MP的抗肿瘤活性与剂量,温度和加热时间的增加呈正相关。
为了揭示NDP/NDP-GC MP和HT的结合在体外抑制SK-MES-1细胞的机制,我们通过流式细胞术进一步分析了细胞周期的改变。结果表明,仅NDP/NDP-GC MP组和NDP/NDP-GC MP+HT组会干扰细胞周期进程。NDP/NDP-GC MP和HT联合治疗可诱导G2/M期阻滞,从而明显增加了G2/M细胞的比例。将NDP/NDP-GC MP与HT联合以后,SK-MES-1细胞活力降低,从而产生了细胞抑制作用,即两者联合处理可诱导G2/M期阻滞促使细胞凋亡[16]。总之,HT与奈达铂联合可以有效抑制非小细胞肺癌细胞迁移,促进其凋亡,具有用于非小细胞肺癌治疗的潜力。
