火炬松HMGR基因的系统发育、分子进化和表达分析
2021-06-23毛积鹏杜澄举黄林旺刘天颐黄少伟
毛积鹏,杜澄举,黄林旺,刘天颐,黄少伟
(1.华南农业大学 林学与风景园林学院 广东省森林植物种质创新与利用重点实验室,广州 510642;2.台山市红岭种子园,台山 529223)
火炬松(PinustaedaL.)原产于美国东南部,20世纪30年代开始引入我国,具有适应能力强、产脂量高、木材和纤维产量高以及生长快等特点,是世界范围内重要的造林和工业用材树种之一[1-2]。此外火炬松各组织部位均含有松脂,其主要成分萜类化合物在植物与植物、植物与环境、植物与病原体等其他生物体的相互作用过程中具有至关重要的作用[3-4]。除此之外,萜类化合物还被广泛应用于食品、化妆品、医药、香料和工业化学品等行业[5-6]。萜类化合物在高等植物体中可以通过分别发生在细胞质和质体中的甲羟戊酸(MVA)和甲基赤藓糖醇-4-磷酸(MEP)两种途径合成。3-羟基-3-甲基戊二酰辅酶A还原酶(3-Hydroxy-3-methyl glutaryl coenzyme A reductase, HMGR)是一种高度保守的酶,在植物组织中催化3-羟基-3-甲基戊二酰辅酶A形成甲羟戊酸,是MVA途径的限速酶[8-10]。研究分别对HMGR基因在19种代表性植物中的系统发育、在火炬松进化枝中的分子进化特性及在火炬松不同组织部位的表达特征进行分析,旨在为以HMGR基因为靶点进行萜类化合物生物合成的分子调控研究及开展基于分子标记的高产脂火炬松优良品系的改良工作提供理论基础。
1 材料与方法
1.1 HMGR基因CDS序列获取
火炬松HMGR基因的编码序列(Coding sequence, CDS)来自火炬松基因组数据库(https://www.ncbi.nlm.nih.gov/genome/?term=txid3352)。提交火炬松HMGR基因的CDS序列到NCBI数据库进行BLAST比对,另选取18个具有代表性物种的HMGR基因CDS序列进行比对分析,同一物种有多条HMGR序列信息的选取和火炬松HMGR基因CDS同源性最高为代表。所选取的物种及其HMGR基因的CDS序列信息如表1所示。
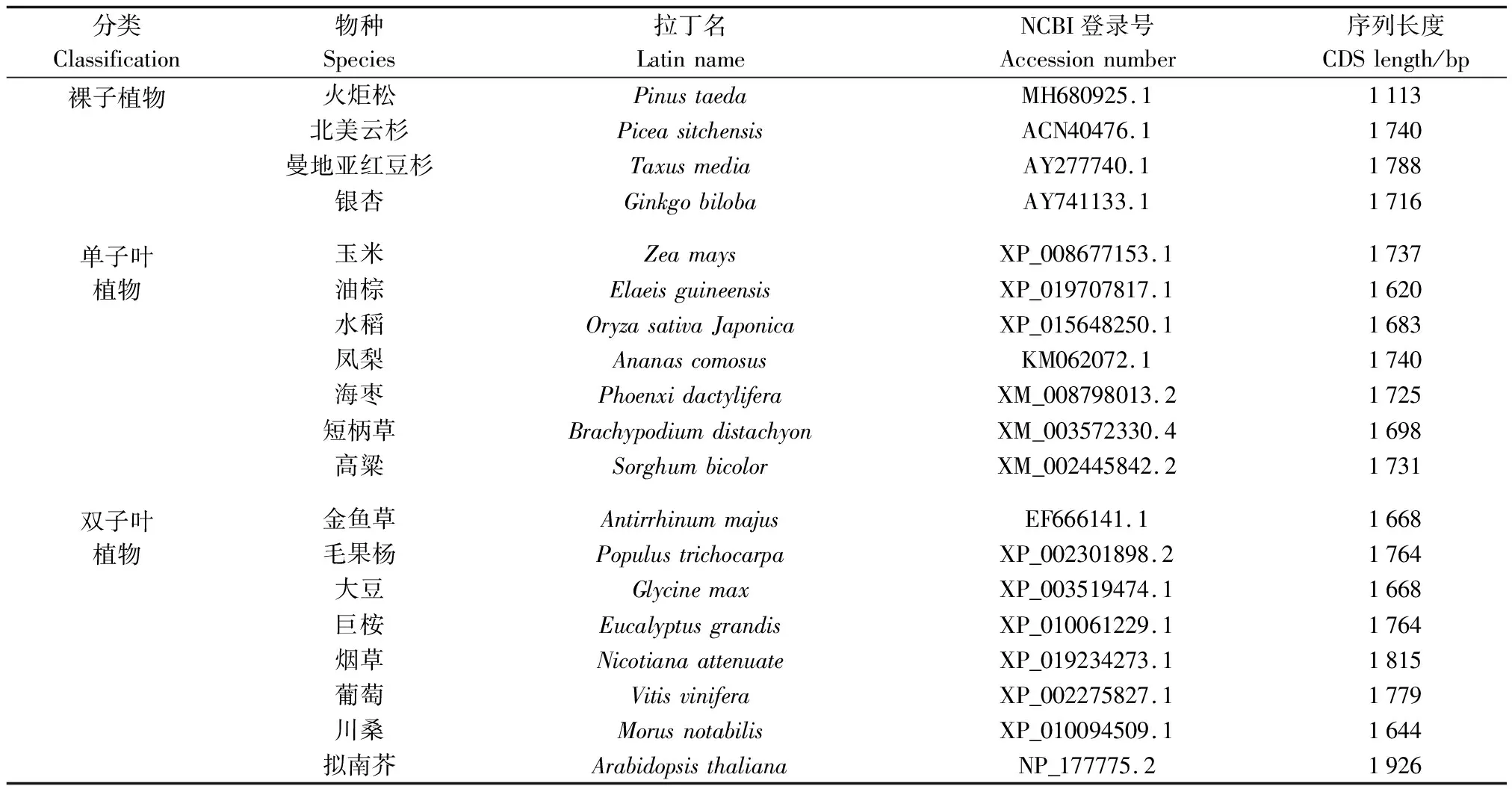
表1 19个物种及其HMGR基因的CDS序列信息
1.2 序列比对与系统发育分析
利用MEGA7.0软件[11]中的ClustalW程序对19个代表性物种HMGR基因的CDS序列进行Align Codons。比对后手动删除终止密码子且保证CDS序列的长度为3的倍数,序列的第一个碱基为密码子的第一位。序列比对结果修饰利用GeneDoc序列比对显示软件。利用DnaSP v5软件[12]进行序列间的平均遗传距离估算与多态性位点分析。利用DAMBE软件[13]对序列进行碱基替换饱和度检测和作图。利用MEGA7.0软件进行系统发育树的构建。
1.3 正向选择作用检测
利用PAML软件[14]的Codeml程序依赖于似然率检测(Likelihood ratio test, LRT)的单比率和二比率两种分枝模型,M0、M1a、M2a、M3、M7和M8等6种位点模型以及ModelA和ModelB两种分枝-位点模型来检测HMGR基因在进化过程中是否受到正向选择作用。利用非同义替换率(dN)和同义替换率(dS)的比值(ω=dN/dS)度量基因在进化过程中受到选择压的大小。ω值等于1表明受中性选择,ω值小于1表明受纯化选择作用,ω值大于1表明受正向选择作用[15-16]。
1.4 HMGR基因的表达分析
对火炬松的芽、嫩叶、成熟叶、树皮和根等5个组织部位进行总RNA的提取。利用反转录试剂盒PrimeScriptTM RT reagent kit(No:RR047A, TaKaRa)进行反转录。选取PtActin(F:5′-GAGCAAAGAGATCACTGCACTTG-3′; R:5′-CTCATATTCGGTCTTGGCAATCC-3′)作为内参基因,并利用Primer Premier 5.0软件对HMGR基因进行引物序列设计(F:5′-GTGAGGAG GAGGTCCTGGAGATG-3′ R:5′-ACAGGCAGTTCACAAGCATTGGC-3′)。实时荧光定量PCR反应根据试剂盒TB Green PremixExTaqII kit(Code No:RR820A, TaKaRa)的操作说明进行。实时荧光定量PCR按要求执行3个生物学重复和3个技术重复,相对表达量采用2-ΔΔCt法进行计算。
2 结果与分析
2.1 HMGR基因CDS序列分析
19个代表性物种HMGR基因CDS序列的平均遗传距离为0.323。多态性位点分析结果表明,在参与比对分析的891 bp长度的HMGR基因CDS序列中,保守位点276个,变异位点615个,其中单态变异位点110个,简约信息位点505个。表明HMGR基因在进化过程中相对保守。
2.2 碱基替换饱和度检验
利用DAMBE软件对19条HMGR基因的CDS序列进行碱基替换饱和度检测及遗传距离与转换和颠换值的作图分析。结果表明,19条CDS序列Iss值(0.409 5)极显著(P<0.000 1)小于其Iss.C值(0.750 9)。由图1可知,HMGR基因在F84替换模型下,绝大部分序列对之间的遗传距离均介于0.25至0.55之间。且所有序列对之间的遗传距离均大于其对应的转换和颠换值。综合表明,HMGR基因序列间的碱基替换未达到饱和,适合用于系统发育树的构建。
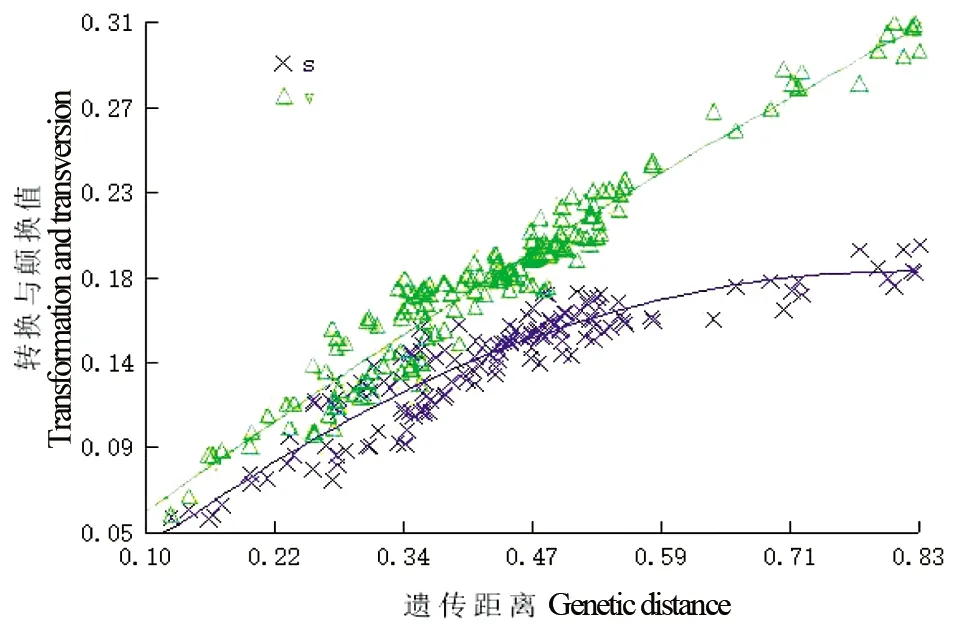
x轴:成对序列遗传距离;y轴:转换(S)和颠换(V)遗传距离
2.3 系统发育与多序列比对分析
利用MEGA7.0软件中的邻近法及程序的默认参数对19条HMGR基因的CDS序列进行系统发育分析(图2)。结果表明,所有的裸子植物、单子叶植物和双子叶植物的HMGR基因被分别聚类在3个不同的单系进化枝中。其中,火炬松与北美云杉两种松科植物及二穗短柄草、玉米、高粱和水稻等4种禾本科植物也分别被聚类在同一进化枝中。然而同为棕榈科的海枣和油棕的HMGR基因则分别被聚类在不同进化枝中。根据系统发育分析结果选取进化距离较远的5个物种的HMGR基因的蛋白序列进行多序列比对分析(图3),多序列比对分析的部分结果如图3所示。结果表明HMGR基因在进化距离相对较远的物种中同样表现出较高的同源性,且C-末端序列的保守性高于N-末端。此外,N-端含有两个高度保守基序,除火炬松外C-端也含有多个高度保守基序。
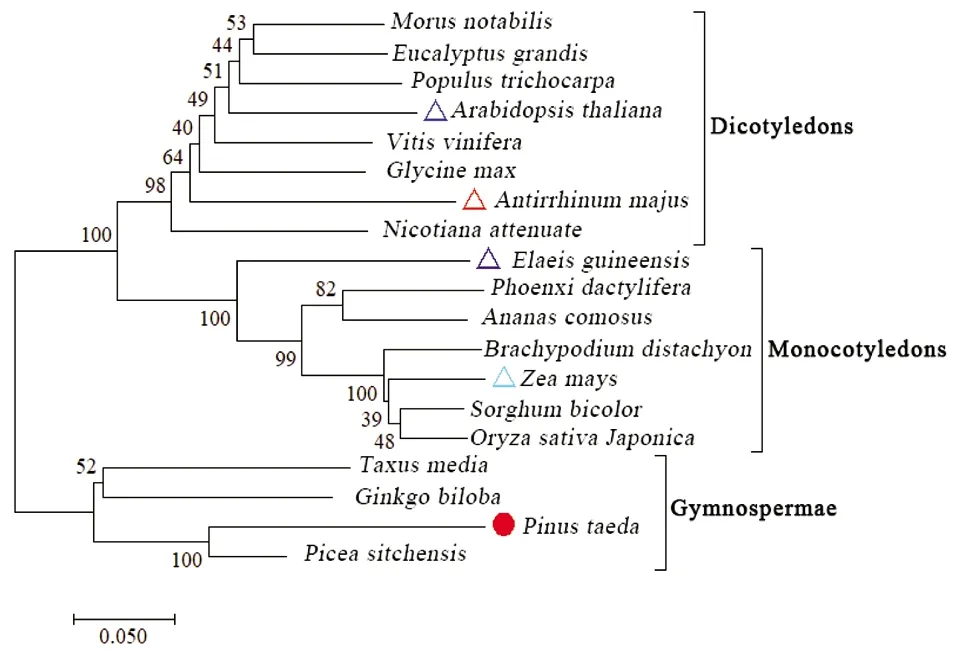
图2 HMGR基因的系统发育分析

不同背景颜色表示序列同源性大小:黑色100%,黄色80%,灰色60%;“-”表示氨基酸缺失
2.4 正向选择作用检测
研究分别利用2种分枝模型、6种位点模型和2种分枝-位点模型来检测HMGR基因在进化过程中受到的选择压大小以及是否受到正向选择作用。单比率分枝模型结果表明,HMGR基因在19个代表性物种的进化过程中受到的平均选择压大小为0.121 2。以火炬松进化枝为前景枝的二比率分枝模型结果表明,HMGR基因在火炬松的进化过程中受到选择压大小为0.429 3(表2)。此外,LRT结果表明以火炬松为前景枝的二比率模型极显著优于单比率模型(P<0.001),即HMGR基因在火炬松进化枝中受到的选择压显著高于背景枝。
位点模型分析结果表明,M0和M3模型对的LRT值小于0.001,即M3模型显著优于M0模型,HMGR基因在进化过程中各位点受到的选择压大小差异显著。M2a和M1a模型对的比较分析结果表明,HMGR基因在进化过程中79.85%的位点受纯化选择作用,19.15%的位点受中性选择作用,只有1%左右的位点在进化过程中受到正向选择作用(ω2=12.446 7)。正向选择作用位点贝叶斯与经验贝叶斯(Bayes and Empirical Bayes, BEB)的后验概率值均小于0.95,此外,LRT结果表明M2a模型并不显著优于M1a模型。M8和M7模型对的比较分析结果表明,HMGR基因在进化过程中93.09%的位点受中性选择或纯化选择作用,6.91%的位点受正向选择作用。LRT结果表明M8模型显著优于M7模型,然而各受正向选择作用位点的BEB后验概率值均只介于0.511和0.923之间(表2)。
以火炬松进化枝为前景枝的分枝-位点模型分析结果如表2所示。Model A模型分析结果表明,HMGR基因在火炬松进化过程中有76.89%的位点受纯化选择作用,10.98%的位点受中性选择作用,12.13%的位点被检测到正向选择作用,其中14个位点的BEB后验概率P>0.95。Model B模型分析结果表明,分别有62.77%、23.99%和13.24%的位点受纯化选择、中性选择和正向选择作用。在Model A中检测到的后验概率大于0.95的14个位点同样在Model B中被检测到。
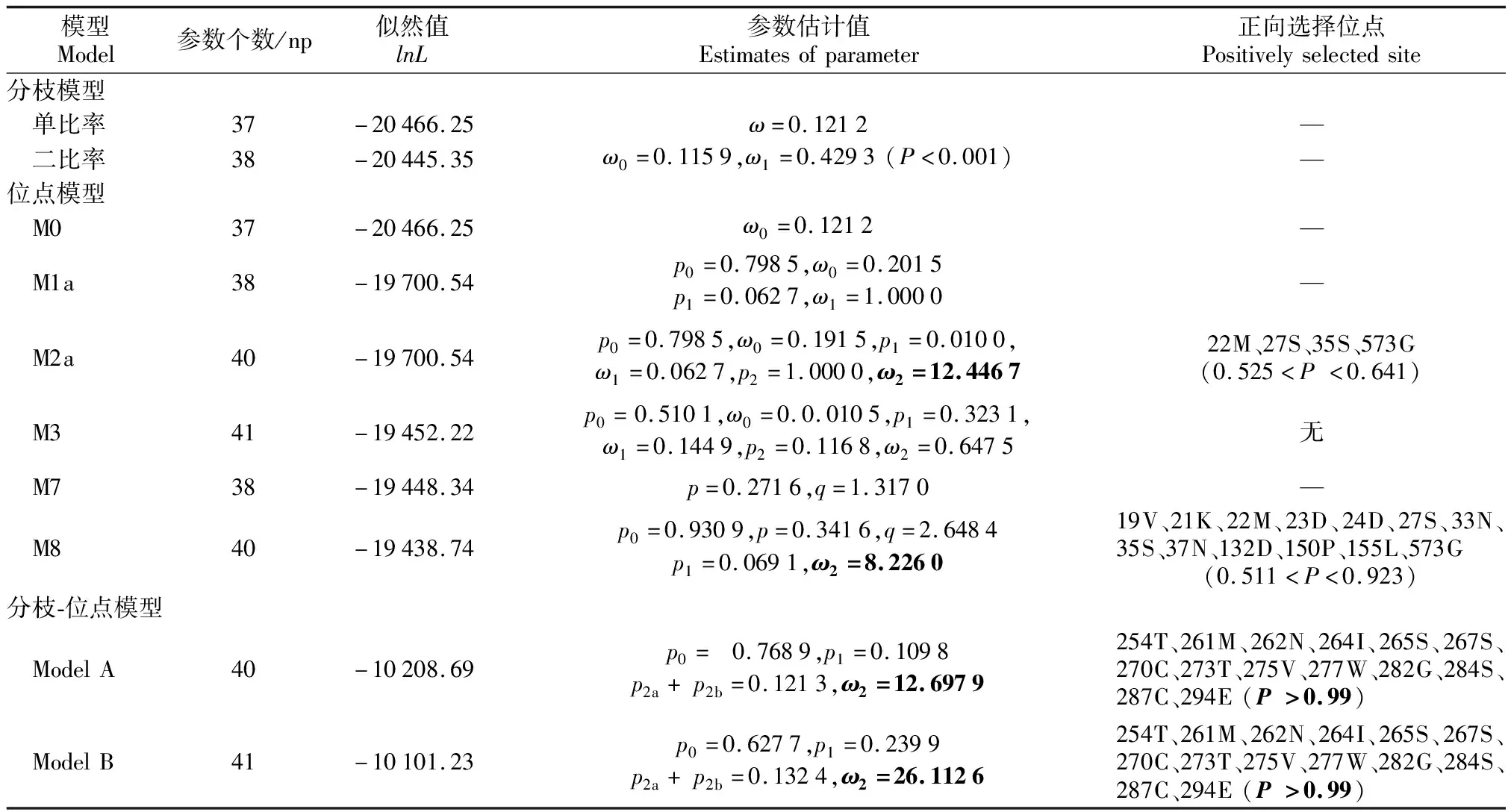
表2 HMGR基因在不同模型下的参数估计值、对数似然值及正向选择位点统计
2.5 HMGR基因表达分析
为探索HMGR基因的表达特征从而进一步了解萜类化合物的生物合成机制,分别对HMGR基因在火炬松5个不同组织部位中的表达特性进行倍分析(图4)。结果表明HMGR基因在嫩叶组织中具最高的表达量,分别是根和树皮组织的9倍和10倍,是成熟叶子和芽组织中的4倍和3倍。其次是在芽和成熟叶组织中。在根和树皮组织中HMGR基因的表达量则相对较低。
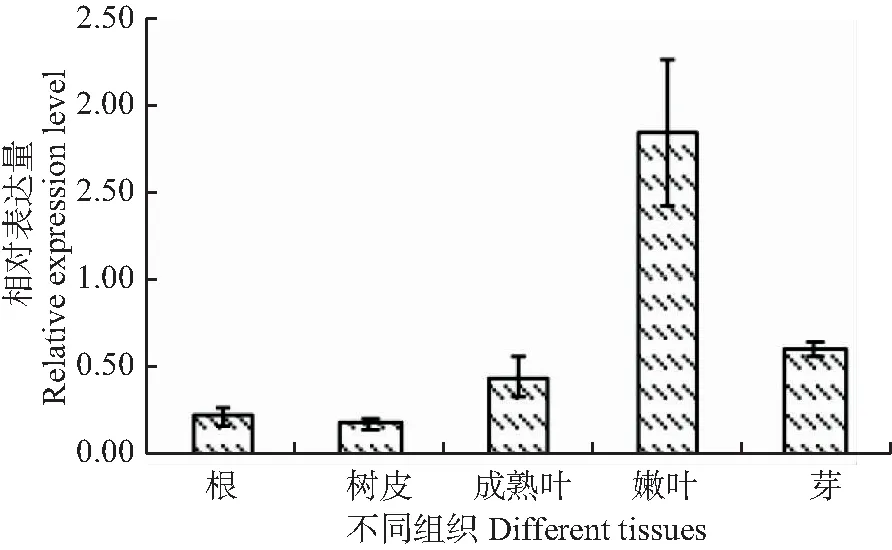
图4 HMGR基因在火炬松各组织部位的表达分析
3 讨论与结论
研究对HMGR编码基因的系统发育在火炬松进化枝中的分子进化及其不同组织部位的表达特性进行分析。结果发现:裸子植物、单子叶植物和双子叶植物的HMGR基因分别被聚类在同一进化枝中。这表明HMGR基因在进化过程中相对保守。但同为棕榈科的海枣和油棕的HMGR基因则被聚类在不同的进化枝中,可能是因为HMGR基因的进化速率与对应物种的进化速率不一致导致的[17]。多序列比对分析发现火炬松HMGR基因CDS序列的C-端比其他物种的短500~800 bp,可能是火炬松在进化过程中由于核苷酸的突变作用提前形成了终止密码子导致了C-端部分片段的丢失[18]。
分枝模型中火炬松进化枝并未检测到正向选择作用,位点模型中虽然有部分位点的ω值大于1,但其BEB后验概率值均小于0.95。这很大程度上是受正向选择频率差异的影响,因为大部分有功能的基因都很少受到强烈的正向选择作用,这种情况下部分受到正向选择作用的位点很容易被中和掉[19-20]。随后的分枝位点模型也证明了这一点,Model A和Model B两种分枝-位点模型均检测到14个BEB后验概率值大于0.95的正向选择位点[21]。
HMGR基因在火炬松针叶组织中的表达量相对较高,在树皮组织中的表达量最低。据此推测,虽然人工割脂部位是在树干处,但其主要作用是松脂储存,松脂的主要合成部位则是在松针组织中。这意味着在高脂火炬松的定向培育工作中,活冠体积这一性状也应重视。
