乳腺癌预后标志物SNRPD1的研究
2021-06-23戴晓峰
陈 霄, 戴晓峰
(1.江南大学 生物工程学院,无锡 214122;2.江南大学 无锡医学院,无锡 214122)
乳腺癌发病率高居榜首,在西方国家约占所有女性癌症的30%[1],也是我国妇女最常见的恶性肿瘤之一,是中国妇女第二大癌症死因[2-3]。乳腺癌高度异质,虽然原发病灶都是乳腺,但临床表型各不相同,目前至少包含3种截然不同的亚型,即管腔型(luminal)、人类表皮生长因子受体2(HER2)型和三阴型(Triple Negative)[4-5]。这些亚型在临床上表现不同,针对不同亚型也采取不同的治疗策略。如临床上一般采用内分泌疗法治疗luminal型[6];对HER2型乳腺癌患者常使用化疗及赫赛汀靶向治疗;而三阴型乳腺癌患者由于雌激素受体(ER)、孕激素受体(PR)以及HER2表达量都很低,以上疗法效果均不佳,该类患者常伴随复发、转移,5年存活率不到15%[7]。因此,寻找新的乳腺癌诊断和治疗靶点至关重要。
剪接体是一个具有环形纤芯复杂结构的核糖核蛋白(RNP),由7个基因(SNRPB、SNRPD1、SNRPD2、SNRPD3、SNRPE、SNRPF和SNRPG)编码的蛋白质组成,主要负责将前体RNA剪接成mRNA[8],准确的剪接对确保正常的细胞功能(如细胞增殖、细胞凋亡、迁移和侵袭)至关重要。有研究表明:剪接体基因的表达与癌症的发生有关,且SNRPD1在肺癌和卵巢癌中显著高表达[9],另有学者提议可使用SNRPD1表达高低来区分具有高度侵袭性的癌症[10]。此外,SNRPD1也被提议作为多种癌症的潜在治疗靶点,如黑素瘤、肺癌[11-12]。
近十年来,随着微阵列、二代测序等高通量技术的发展,生物信息学被广泛应用于癌症机理研究[13-14]。本研究利用生物信息学和分子生物学实验研究SNRPD1在乳腺癌发生发展中的作用机制,为乳腺癌药物研发,尤其是恶性程度较高的三阴性乳腺癌的药物开发提供理论基础。
1 材料与方法
1.1 生物信息学分析
1.1.1 数据下载
美国的癌症基因组谱图(TCGA)数据库储存了各种癌症的多组学数据与临床随访数据。通过TCGA 数据库(http://cancergenome.nih.gov)下载了乳腺癌转录组数据和临床数据(2020 年2月)。该数据集包含998个乳腺癌患者肿瘤样本,28 218个基因的转录水平数据,其中102位患者在随访中死亡。在数据处理前,数据通过log2归一化获得正态分布的表达值。通过quantile-quantile plot,将数据与标准正态分布进行对比,作为正态性的检验。
1.1.2 生存分析
使用KMplot在线工具(http://kmplot.com/analysis/)分析GSE42568数据集中SNRPD1的表达对乳腺癌病人10年总体生存率(Overall survival)和复发生存率(Relapse free survival)的影响。GSE42568数据集包含了来自104位乳腺癌病人癌症样本与17个正常乳腺样本的基因表达数据,使用cox回归模型以及log-rank检验检验模型的显著性。
1.1.3 功能分析与聚类
通过对表达量与SNRPD1偶联的基因功能富集分析,可以寻找SNRPD1所调控的生物学过程。基因相关性分析主要使用Pearson相关系数表征,公式如下:
使用Pearson相关性系数筛选与SNRPD1相关的基因,以R2>0.5且P<0.01作为筛选阈值。对筛选到的SNRPD1相关基因,使用基因本体论(GO)数据库进行富集分析,其数学模型是利用超几何分布和Fisher精确检验衡量给定基因集中各生物学通路占比的统计学显著性。超几何分布公式如下:
该公式描述了给定所有N个基因中有M个基因属于某通路,若随机挑取n个基因,其中k个基因属于该通路的概率。
此外,使用非监督的层级聚类功能观测目标生物学功能是否与病人的临床表型相关联。以上数据分析,使用编程语言R撰写脚本,其中使用到程序包“ClusterProfiler”[15]“org.Hs.db.eg”[16]以及“pheatmap”[17],多重假设检验使用Benjamini-Hochberg法校准P值[18]。P<0.01作为统计检验显著性的阈值。
1.2 细胞生物学实验
1.2.1 细胞培养
实验使用乳腺癌细胞系MCF7,培养基使用添加了10%胎牛血清(Gibco)的DMEM培养基,于37 ℃、5%CO2培养。细胞培养使用的胰蛋白酶购自Gibco公司;D-PBS、HEPES(吉诺生物);胰岛素(Insulin)购自江苏省无锡市第四人民医院。
1.2.2 siRNA转染
靶向SNRPD1两个siRNA 由吉玛公司进行合成。转染前,细胞在孔板中以约50%的融合度铺板。转染时,按产品操作手册,在Opti-MEM培养基中依次加入siRNA和lipo3000试剂,混合后静置15~20 min,然后与孔板中的细胞混合。两条siRNA同时转染,各占总siRNA用量的50%。表1中列出了为SNRPD1设计的siRNA。
三是最终形成体系化的财务管理模式,为企业的运营和发展提供客观数据和资料。大数据时代下数据的挖掘、加工、利用、处理和分析等成为企业财务管理工作的基础,以上工作流程也将成为财务管理构建的新模式和运作机制。模式的核心在于“数据的搜集、整理和分析”,即“数据说话”为企业财务管理决策提供基础,财务管理报告中的各项决定和规划能够进一步指导企业运作和发展提供服务。
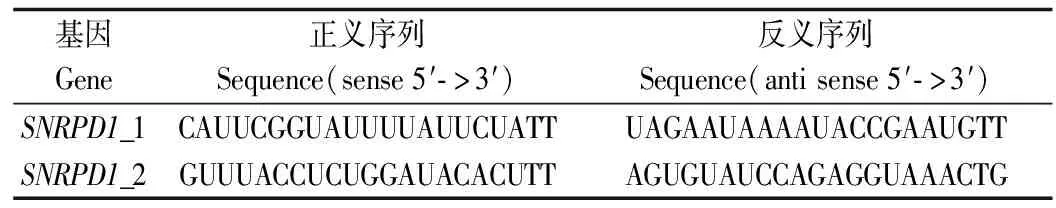
表1 研究所用siRNA
1.2.3 实时荧光定量PCR
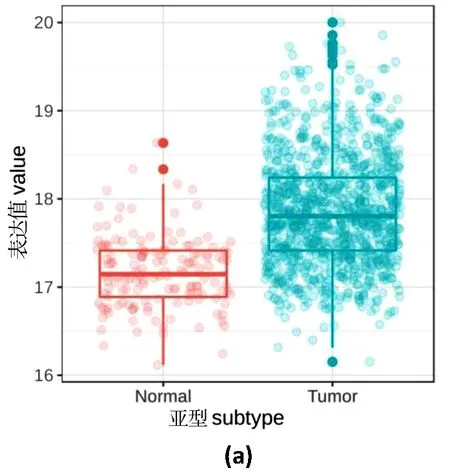
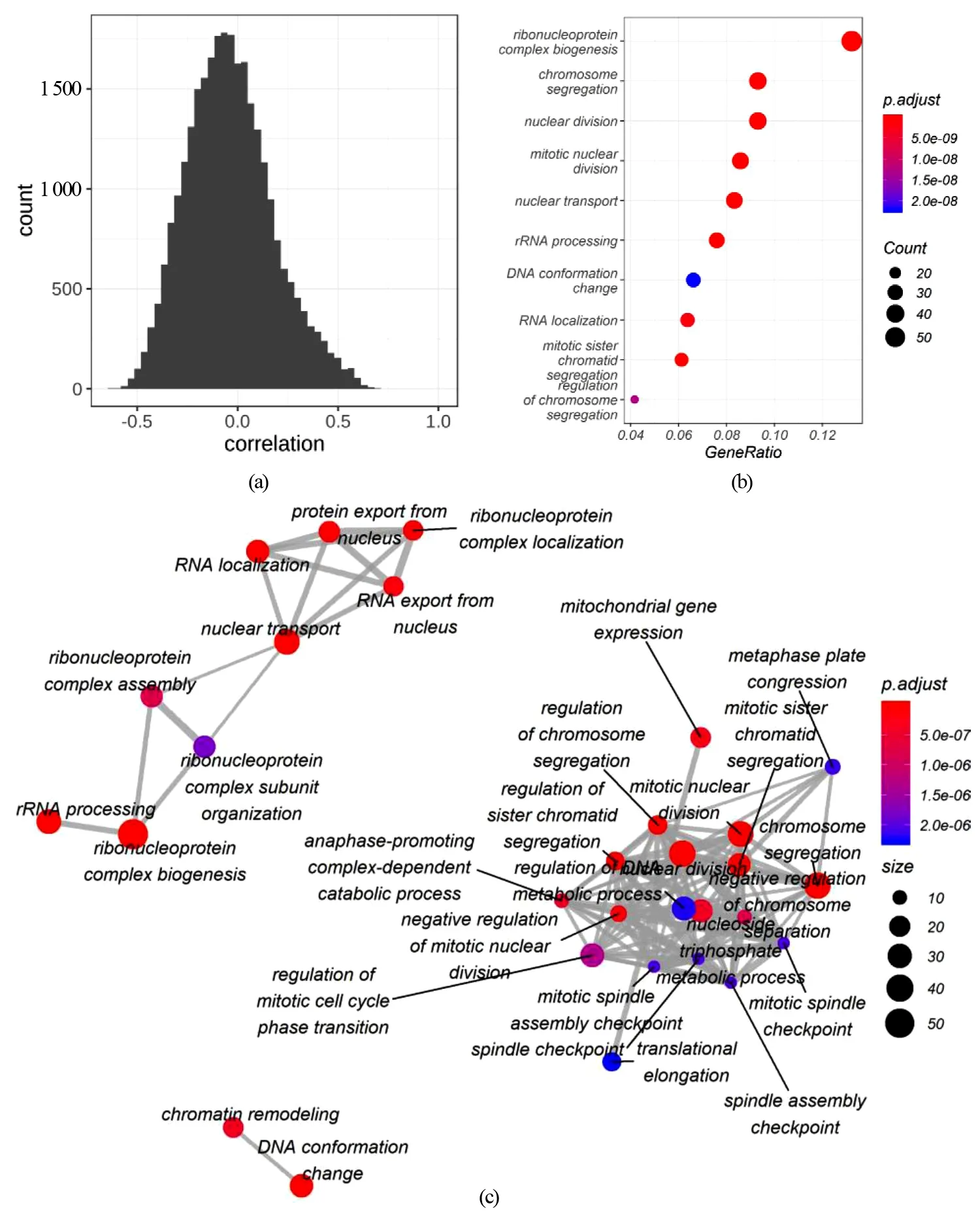
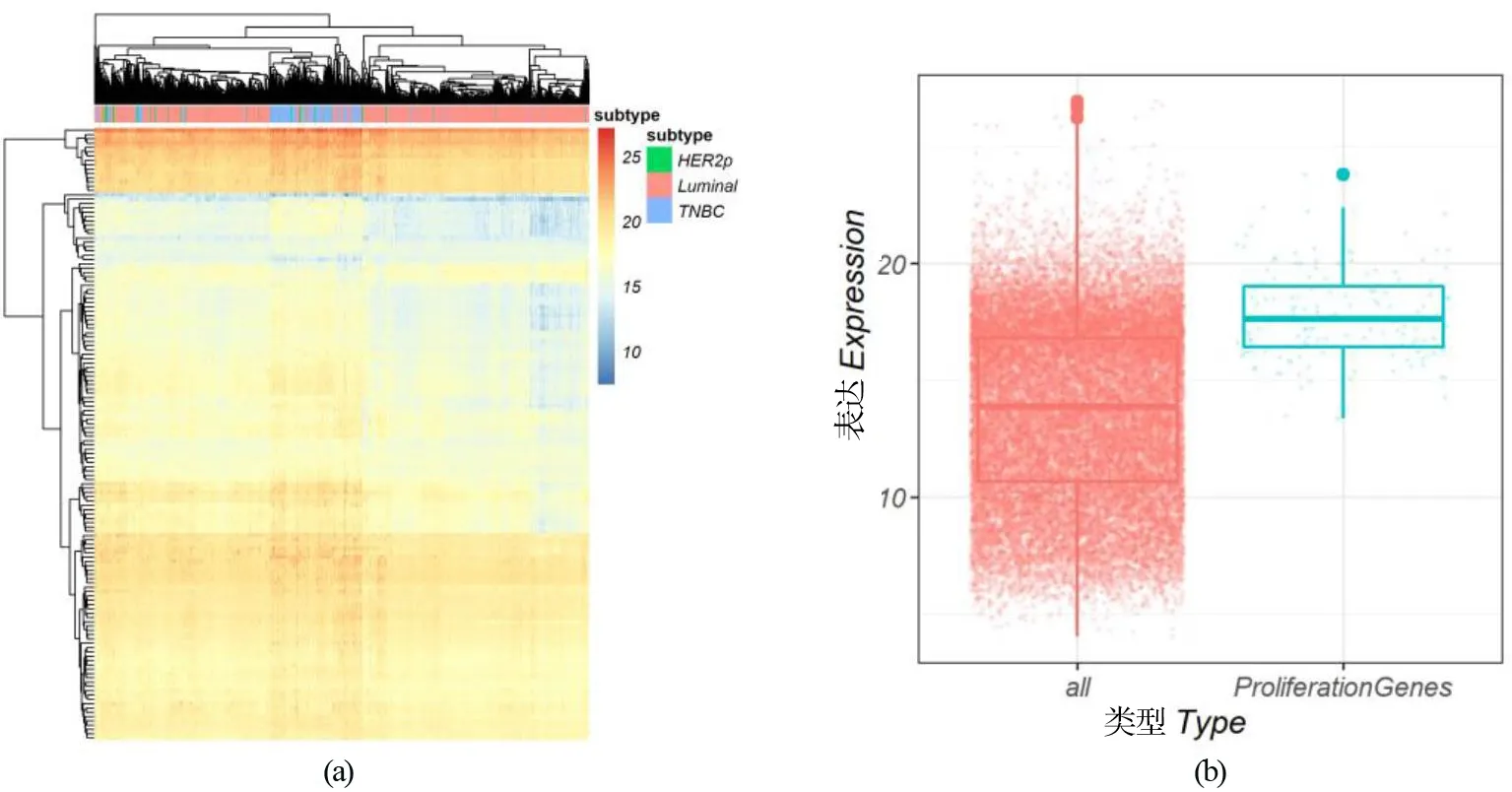
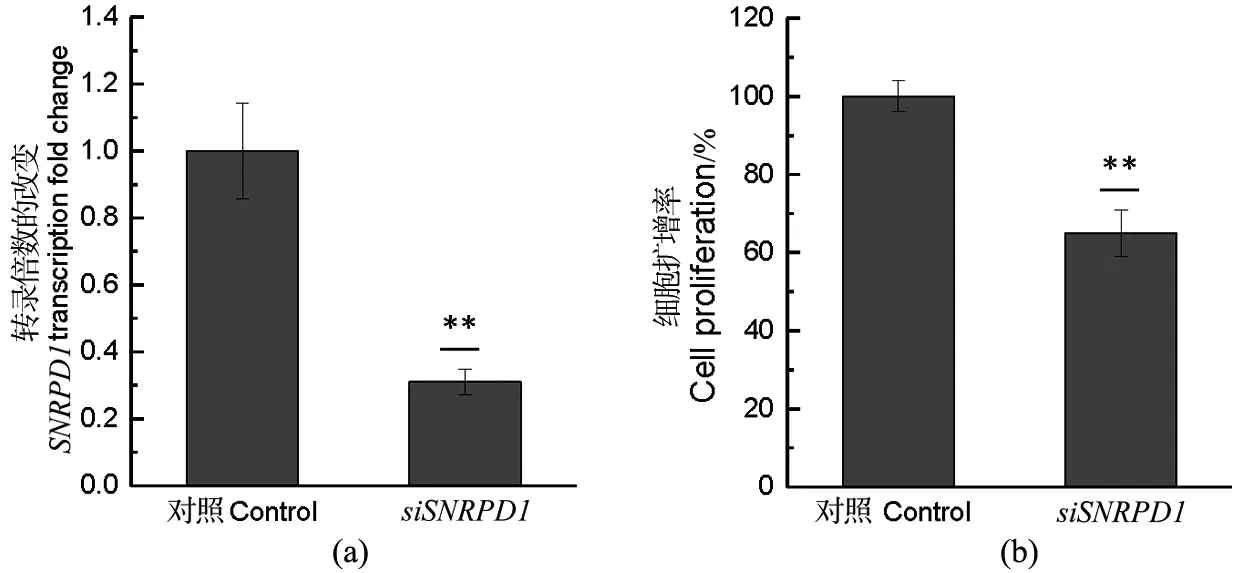
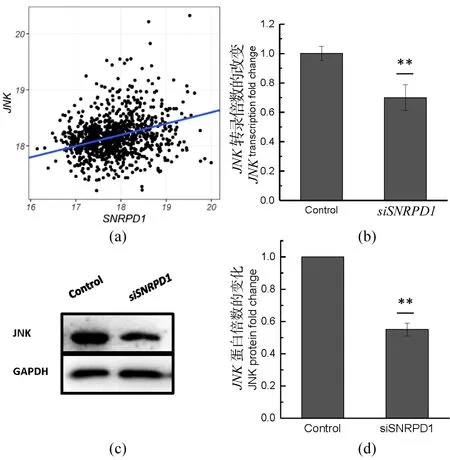
基因转录水平测定使用实时荧光定量PCR(qPCR)。siRNA转染24 h后提取总RNA(TRIzol),使用PrimeScriptRT逆转录酶(Takara)将RNA逆转录成cDNA。使用qPCR试剂盒(康为生物)以及罗氏LightCycler 480qPCR仪进行qPCR扩增。相对表达水平使用2-ΔΔCt方法计算。使用t检验评估统计学显著性。所有t检验显著性如下标识:*表示P<0.05,**表示0.01 表2 研究所用qPCR引物 1.2.4 免疫印迹 siRNA转染48 h后,使用含有蛋白酶抑制剂的RIPA裂解液提取总蛋白。使用BCA分析试剂盒(Tiangen)测算蛋白质浓度。蛋白质样品在SDS-PAGE胶上分离,并使用BioRad 湿转转膜仪转移到PVDF膜上。转膜后,在室温5%脱脂牛奶中封闭1 h,使用一抗在4 ℃过夜孵育蛋白,次日在二抗下孵育2 h。使用High-sigECL Western Blot试剂(天能)显色,并使用BioRad成像设备检测信号。本实验使用JNK(c Jun N terminal kinase 1)总蛋白抗体,购自proteintech(Catalog number: 51151-1-AP)。 1.2.5 增殖测定 转染后48 h,使用CKK-8(Dojindo)测量细胞增殖,并在37 ℃ 孵育2 h后,使用EZ Read 800酶标仪(Biochrom)检测发光。使用t检验评估细胞数量变化的显著性。 2.1.1SNRPD1在不同乳腺癌亚型中的差异表达和预后分析 通过对来自TCGA乳腺癌转录组数据分析,并利用方差分析表征SNRPD1在不同类型中差异表达的显著性,结果显示:基因SNRPD1在肿瘤组织中的表达量显著高于正常组织[图1(a),P<2×10-16]。针对不同亚型乳腺癌的SNRPD1表达量分析发现,SNRPD1在恶性程度最高的三阴性中表达量最高,且远远高于表达量最低的Luminal型[图1(b),P<2×10-16]。结果表明:SNRPD1不仅在肿瘤中高表达,其表达高低还可能与癌症的恶性程度相关。为了验证SNRPD1对病人的预后影响,使用MKplot与cox回归模型进行生存分析,分析结果表明:无论是使用病人整体生存率还是非复发率作为指标,SNRPD1的高表达都预示着更差的预后,即更低的生存概率和更高的肿瘤复发概率[图1(c)和(d)]。以上结果表明,SNRPD1的高表达可能在乳腺癌的发生和恶化中起到关键作用,但其作用机制尚不明确。 (a)SNRPD1在正常组织和癌症组织中的表达量;(b)SNRPD1在不同乳腺癌亚型中的表达量;(c)不同SNRPD1表达水平的病人的整体生存率;(d)不同SNRPD1表达水平的病人的癌症非复发率 表达量相关联的基因往往在功能上有一定的关联。为了挖掘SNRPD1参与的细胞生物过程,利用转录组数据进行相关性分析,寻找与SNRPD1表达相关的基因,即SNRPD1共表达基因,再通过功能富集分析寻找SNRPD1共表达基因参与的细胞通路。通过计算SNRPD1与所有基因的皮尔森相关性,可以获得SNRPD1相关性表达谱,呈正态分布[图2(a)]。通过相关性表达谱,筛选共得到442个相关基因(343个基因正相关,99个基因负相关)。 GO富集分析表明:SNRPD1共表达基因除了主要参与剪接体功能外,还参与了细胞核分裂和有丝分裂等细胞生物学过程[图2(b)]。不仅如此,通过GO富集分析,将GO富集到的通路基于相似性构建网络,获得了GO功能网络。该GO功能网络表明,SNRPD1共表达GO网络主要有两个簇:RNA加工和有丝分裂。推测SNRPD1除了负责RNA加工,还可能与细胞有丝分裂相关[图2(c)]。 (a)所有基因与SNRPD1的表达相关性数据分布,横坐标表示相关性大小,纵坐标表示基因数量;(b)SNRPD1共表达基因的通路富集结果,横坐标表示给定的基因集合中该通路的基因的比例,颜色表示显示性检验的P值;(c)SNRPD1共表达基因的GO富集网络 为了确认有丝分裂基因在乳腺癌中的作用,利用TCGA转录组数据进行了无监督层级聚类分析。分析结果显示:对有丝分裂基因的聚类能区分三阴型乳腺癌与luminal乳腺癌,且这些基因在三阴型乳腺癌中高表达[图3(a)]。此外,也观察到HER2亚型的患者也聚成了一簇,且部分表达量较高。以此推测,SNRPD1可能参与细胞有丝分裂,进而在癌症的发生发展以及迁移恶化中起作用。最后,比较了细胞参与有丝分裂的基因的表达量与所有基因的表达量,结果显示,细胞参与有丝分裂的基因在乳腺癌中高表达[图3(b),P<2×10-16]。 (a)细胞有丝分裂基因表达量对乳腺癌病人进行无监督层级聚类,不同亚型的病人使用不同颜色标出,各基因表达量使用红蓝色表示;(b)有丝分裂基因相对于所有基因的表达量 2.2.1SNRPD1敲降对乳腺癌细胞系细胞增殖的影响 通过siRNA技术以达到在乳腺癌细胞系MCF7中敲降SNRPD1的目的。被敲降的细胞称为siSNRPD1细胞。通过qPCR验证,siSNRPD1细胞中基因SNRPD1的转录水平被敲降至对照组的30%以下[图4(a),P=0.001 6]。使用细胞增殖实验检测基因敲降对细胞增殖的影响。增殖实验显示,SNRPD1敲降导致siSNRPD1细胞增殖能力下降至对照组的60%[图4(b),P=0.001 3]。 (a)利用qPCR验证SNRPD1敲降效果;(b)细胞增殖实验 2.2.2SNRPD1敲降对细胞增殖标志蛋白质的影响 JNK为细胞增殖的标志分子,根据前期相关性分析,TCGA病人癌组织中JNK与SNRPD1的转录水平呈现显著正相关[图5(a),P=3.3e-05]。使用JNK作为细胞增殖标志分子,从分子层面验证SNRPD1对细胞增殖的影响。蛋白质免疫印迹结果显示,siSNRPD1细胞的JNK蛋白质表达量下降到原来的约50%[图5(c)和(d),P=0.004 1]。qPCR验证发现,siSNRPD1细胞中的JNK基因转录量下降到原来的70%[图5(b),P=0.008 5],与蛋白质免疫印迹结果吻合。 (a)SNRPD1与JNK转录组散点图;(b)JNK的qPCR定量分析结果;(c)JNK蛋白免疫印迹结果;(d)JNK蛋白免疫印迹结果定量分析 通过数据分析和实验验证,确定了SNRPD1与乳腺癌细胞增殖的关联。预测SNRPD1与细胞分裂、细胞增殖相关,其高表达可预示乳腺癌预后较差以及恶性程度更高,并通过实验证明,抑制SNRPD1表达将导致细胞增殖下降,且调控细胞增殖的JNK蛋白表达下降。SNRPD1低表达抑制细胞的快速增殖,并可能进一步参与癌症的发生和恶化过程。 然而,SNRPD1如何影响细胞的增殖,以及JNK是否介导SNRPD1引起细胞增殖变化仍需要进一步探究。此外,研究前期找到的SNRPD1还与细胞分裂、DNA复制相关,虽这些过程都与细胞增殖密切相关,但仍需要进一步验证这些变化过程。有研究证明,SNRPD1在肺癌、卵巢癌和黑素瘤中差异表达,然而其对病人的具体作用方式并没报道。实验首次提出将SNRPD1的作用与细胞增殖联系起来,并使用差异表达解释乳腺癌亚型的不同临床结果,暗示SNRPD1作为乳腺癌预后标志物及其在临床治疗中的潜力,尤其是针对增殖较快的三阴型乳腺癌,并为其他类型癌症的治疗提供借鉴。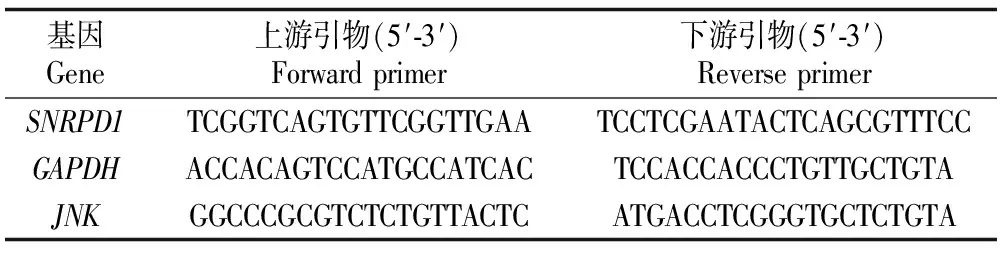
2 结果与讨论
2.1 SNRPD1参与细胞生物学过程分析预测
2.2 SNRPD1在细胞增殖中的作用
3 结语
