锰氧化物对水体中铊的去除机制研究进展
2021-06-23张良静尚长健徐祥健姜永海
张良静, 尚长健, 韩 旭, 徐祥健, 夏 甫, 邓 圣, 杨 昱, 姜永海
1.中国环境科学研究院, 国家环境保护地下水污染模拟与控制重点实验室, 北京 100012 2.北京师范大学水科学研究院, 北京 100875 3.污染场地安全修复技术国家工程实验室, 北京 100015
铊(Tl)是一种剧毒性的稀有重金属,其对哺乳动物的毒性远大于Hg、Cd、Pb、Zn等[1-2],是世界公认的13种优先控制的金属污染物之一[3],环境中的Tl主要来源于含Tl矿石风化或工业活动[4]. Tl在水体中的主要存在形式是Tl(Ⅰ)和Tl(Ⅲ),Tl(Ⅰ)的离子半径和K+相似,在水中稳定、易迁移,因此对水环境造成的危害更大[5-6];Tl(Ⅲ)性质类似于Al,在中碱性条件下不稳定,易发生水解,沉淀态的Tl(OH)3、Tl2O3是Tl(Ⅲ)的主要存在形式[7].
中国作为世界上唯一发现Tl独立成矿的国家[1],面临着较高的Tl污染风险. 近年来,工业废水的排放导致多起地表和地下水Tl污染事件,如2013年广西某些企业将未经任何处理的选矿和洗矿废水排入贺江,造成严重Tl污染[8];黔西南滥木场铊矿区地下水Tl超标,浓度高达13.4~1 102 μg/L[9];Tl污染不仅在国内发生,英国、意大利等国家的一些矿区附近也有地表水和地下水Tl超标的报道[10-12]. 因此了解Tl在水体中的去除技术和方法研究日益受到关注.
XU等[13]对去除Tl的新技术进行了总结,包括吸附[14]、化学氧化和沉淀[15]、离子交换[16]、络合作用[17]等. 锰氧化物是天然的氧化剂,具有良好的阳离子交换性能,对各种金属离子具有强有力的吸附性,对某些元素的分配和生物利用至关重要[18-19]. 已证明锰氧化物对Tl具有良好的吸附和氧化性能,在水溶液中Tl(Ⅰ)可以通过表面络合和氧化沉淀等作用被Mn(Ⅳ)吸附,天然条件下Tl与铁锰氧化物的结合能力很强[1];将Tl(Ⅰ)氧化成为Tl(Ⅲ)去除是一种有效的方式,常用的氧化剂如H2O2、MnO2和重硫酸盐等可将易溶的Tl(Ⅰ)转为难溶的Tl(Ⅲ),后者更容易通过沉淀、吸附和共凝聚作用被去除[8,20].
MnO2是一种最常见的用于Tl去除的锰氧化物,已有学者对其去除Tl的行为特征进行了总结[13,21],而改性的锰氧化物或锰氧化物与其他物质的复合材料也表现出对Tl较强的去除能力,而且在可重复使用和易分离等方面具有独特优势[4,22-23];此外,研究[20,24-25]证明,pH、竞争吸附离子和有机质等环境因素对锰氧化物去除Tl具有显著影响,但对此尚缺少系统分析;锰氧化物对水环境Tl的去除机制也亟待总结,这些研究工作对推动锰氧化物去除Tl技术发展具有重要意义.
基于此,该研究综述了不同类型锰氧化物对Tl的吸附特征、影响因素及吸附机制的进展,探讨了其未来研究重点和发展方向,为深入开展锰氧化物去除水体中Tl的研究提供参考.
1 不同类型锰氧化物对Tl的去除行为

1.1 合成锰氧化物
化学合成的锰氧化物指在热力学作用下,Mn(Ⅱ)通过化学氧化形成高价锰氧化物的过程. MnO2对Tl的吸附特征与其结构密切相关,含空位的二维层状型δ-MnO2主要包含Mn(Ⅳ),含有空位0.06~0.11/Mn,其对Tl的氧化与吸附能力很强[27-28];Tl的吸附形态会随Tl/Mn负荷比增加而变化,当Tl/Mn负荷比>0.02,Tl主要以水合Tl(Ⅰ)的形式吸附,当Tl/Mn的负荷达到0.2,Tl主要以氧化Tl(Ⅲ)形式吸附,随着氧化还原产生的Tl(Ⅲ)和Mn(Ⅱ)阻塞MnO2层间的空缺位点,Tl的氧化吸收能力和速率会受到限制[14,29];锰氧化物的形态也是影响Tl吸附性能的一个重要因素,LI等[2]制备了4种不同形态的锰氧化物,发现其对Tl(Ⅲ)的吸附性能均较好,且线状和朵状的MnO2对Tl(Ⅰ)的吸附性能更好,说明不同合成方式MnO2对Tl(Ⅰ)和Tl(Ⅲ)吸附性能有差异. 同时MnO2可以通过催化氧化作用增强高锰酸盐和次氯酸对Tl(Ⅰ)的氧化,使体系的反应速率增强2~3倍[30].
近年来,研究热点从传统的MnO2转到了纳米MnO2(nMnO2),nMnO2是对Tl最有活力的吸附剂之一[4],相比传统吸附剂,纳米级别的吸附剂具有独特优势,其比表面积较大、孔隙度高且具有空心结构,因此对污染物的吸附性能显著提高,最大吸附量可达672 mg/g[10,13,31-33]. 由于nMnO2在水中容易产生凝聚作用,其可分离性较差,目前缺少将Tl从nMnO2上去除的合适方法,所以nMnO2的可再生性是需要解决的问题.
总之,普通合成锰氧化物(以MnO2为主)对Tl具有较好的吸附和氧化性能,锰氧化物的晶型结构及形态影响对Tl的去除效果;Tl(Ⅰ)和Tl(Ⅲ)在锰氧化物上的吸附氧化特征存在差异,目前对合成锰氧化物是否可循环利用及可分离性程度探讨较少.
1.2 矿物锰氧化物
矿物锰氧化物比普通MnO2含有更多结晶颗粒,低含量的矿物锰氧化物对Tl也具有较强的吸附性. Tl(Ⅰ)聚合倾向较低,容易形成弱的水合表面络合物,因此Tl(Ⅰ)容易吸附到锰氧化物的活性位点上,LIU等[25]研究发现Tl(Ⅰ)在软锰矿(β-MnO2)上的最大去除率达到67.9%;水钠锰矿是在微生物氧化和自催化氧化状态下形成的高活性矿物[18],其八面体MnO6层堆积结构具有良好的Tl吸附性能. 其吸附可分为3个步骤:①Tl以外壳络合形式吸附到水钠锰矿的表面;②Tl(Ⅰ)被氧化成Tl(Ⅲ),以内壳络合的形式吸附到水钠锰矿的八面体空位;③Tl的同位素(203Tl/205Tl)分馏作用[7,34],吸附-氧化-同位素分馏机制可能是Tl在水钠锰矿上特殊的去除机制.
Tl吸附的方式与矿物锰氧化物的结构密切相关. Tl(Ⅰ)主要以水合阳离子形式吸附到钡镁锰矿(3×3隧道结构)的多层吸附位点,对于锰钾矿(2×2隧道结构),水合Tl(Ⅰ)通过取代K+的方式被吸附,这和与Tl有着相似离子半径和水合能的Rb+在锰钾矿上的吸附行为类似[14,35-36];吸附到三晶斜系水钠锰矿、钡镁锰矿和锰钾矿等矿物上的Tl主要是Tl(Ⅰ),氧化的Tl(Ⅲ)吸附的成分较少,而吸附到六方晶系水钠锰矿上的Tl(Ⅰ)氧化成Tl(Ⅲ)占比较大,此时的Tl(Ⅲ)以络合形式进行吸附[14,34].
矿物锰氧化物比普通合成锰氧化物具有更多的活性位点,其对Tl的吸附机制更加复杂;晶型结构直接决定着矿物锰氧化物的类型,目前矿物锰氧化物的晶型结构对其吸附氧化Tl的影响研究仍然有待深入.
1.3 改性锰氧化物
对锰氧化物进行结构或性质的改变以达到特定的目的是近年来研究的重点. WAN等[22]用氧化和化学沉淀方法制备了一种非晶质水合MnO2(HMO),HMO对Tl的吸附能力达352 mg/g,吸附后Tl的浓度可达到GB 5749—2006《生活饮用水卫生标准》规定的0.1 μg/L,而且吸附受其他离子影响较小,表现出较好的吸附选择性;HMO颗粒能通过NaOH-NaClO溶液有效再生,实现重复利用. 通过还原的方式对锰氧化物进行改性也可显著影响其对Tl的去除,Wick等[14]分别用对苯二酚、HEPES缓冲液和溶解性Fe(Ⅱ)部分还原得到δ-MnO2,由于晶体和颗粒大小的变化,还原后的δ-MnO2比原始δ-MnO2比表面积显著降低,因此对Tl的氧化吸附能力降低;说明天然条件下,有机质或Fe(Ⅱ)可能会还原锰氧化物,从而降低锰氧化物的活性.
合理的改性可以提高锰氧化物对Tl吸附能力,吸附剂的选择性和重复利用程度也会提高. 目前改性锰氧化物对Tl的去除研究仍然处于探索阶段,加强锰氧化物改性材料和改性方法的选取可以作为未来研究重点.
1.4 锰氧化物复合材料
锰氧化物和其他材料合成的新材料,对Tl具有更优质的去除效果. CHEN等[37]探究了化学合成的MnO2和蛭石之间的相互作用,并制备成MnO2-蛭石复合材料,此材料既规避了传统MnO2容易凝聚的问题,同时MnO2-蛭石比表面积(298.18 m2/g)远远大于单一的MnO2,对Tl的去除能力达144.29 mg/g.
MnO2与铁的复合材料可有效去除水中重金属,例如:MnO2@Fe3O4被证明可有效去除水中的As、Cd等重金属[38-39];磁性黄铁矿经非晶质、朵状MnO2包覆形成MnO2@磁黄铁矿复合材料,比表面积达到29.1 m2/g,相比纯的磁黄铁矿可以更有效去除废水中的Tl,且比普通合成的锰氧化物更容易从水中分离[4];CHEN等[8]用FeOOH负载MnO2形成纳米复合材料(MnO2@FeOOH),其对Tl具有很强的去除效果(吸附量450 mg/g). 也有研究者关注Fe和Mn的沥出问题,LI等[4]研究了MnO2@磁黄铁矿去除Tl后溶液中的Fe、Mn残留问题,发现随着pH的上升,Fe和Mn的沥出量会增强.
高分子聚合物与MnO2合成材料研究也取得了进展. PAN等[23]通过将纳米水合MnO2封装进聚苯乙烯阳离子交换器,制备出高分子聚合nMnO2,该材料能将工业废液Tl(Ⅰ)的浓度从1.30 mg/L降至0.14 mg/L(美国环境保护局规定的工业废液中Tl最大浓度标准)以下,天然水体中Tl(Ⅰ)浓度从1~4 μg/L降至0.1 μg/L(GB 5749—2006)以下;且高分子聚合nMnO2具有很好的再生性,可通过NaOH-NaClO溶液实现重复使用10次以上. 除了高价态的锰氧化物,纳米零价锰(nZVMn)和Tl之间的相互作用也成为近年来的研究热点,nZVMn单独作用时并不能对Tl发挥最好的去除效果,其和S2O82-、ClO-、H2O2结合可增强nZVMn对Tl的吸附和氧化性能,从而达到对Tl(Ⅰ)稳定和有效的去除效果(95%)[40].
影响复合材料性能的关键是Mn的占比. 如果Mn占比过低,合成材料不能提供充足的Tl吸附位点,但占比过高可能会产生Mn凝聚,降低对Tl的去除能力. 相比纯锰氧化物,复合材料可以同时结合锰氧化物和其他吸附材料的优势,显著提高对Tl的去除效果;金属锰氧化物复合材料有利于提高复合材料从溶液中的分离效果,高分子锰氧化物复合材料可以增强可重复利用程度. 但对锰氧化物进行复合或者改性可能会增加成本.
1.5 锰氧化物对Tl的吸附行为探讨
由表1可知,目前锰氧化物对Tl的吸附研究主要基于工业废水以及实验室制备的含Tl水;吸附平衡时间较短,大部分在24 h内,最长不超过72 h;此外,在可重复利用或易分离方面,改性锰氧化物和锰氧化物复合材料比合成锰氧化物及矿物锰氧化物具有优势,说明这2类锰氧化物去除Tl的潜力较大.

表1 Tl在不同类型锰氧化物上的吸附情况
相对于实验室环境,工业废水的成分往往更加复杂,但锰氧化物对Tl的去除也具有较好的工程应用. 采用20 μg/L的Tl(Ⅰ)进行柱试验模拟研究,MnO2-蛭石复合物能将Tl(Ⅰ)的浓度降至0.1 μg/L,同时锰的释放量小于0.1 mg/L[37];LI等[2]发现随着MnO2添加量的增加,工业废水中的Tl、Pb和Cu的去除率显著提高;在工业废水中,nMnO2通常是在高锰酸盐〔Mn(VⅡ)〕还原和溶解Mn(Ⅱ)氧化过程中形成的,对Tl具有较好的吸附、催化和氧化效果,可以增强石英砂对Tl的渗滤效果[20]. 但是在实际废水中,当离子种类较多或浓度较高时,nMnO2容易聚集和钝化[31].
6种不同类型锰氧化物和其他6种吸附剂对Tl吸附性能大小的比较结果如图1所示[2,4,8,22,31,41-46],由于试验条件的不同,与其他吸附剂最大吸附能力的直接比较相对困难,吸附量均是基于文献中报道的特定试验条件下对Tl的最优吸附量.
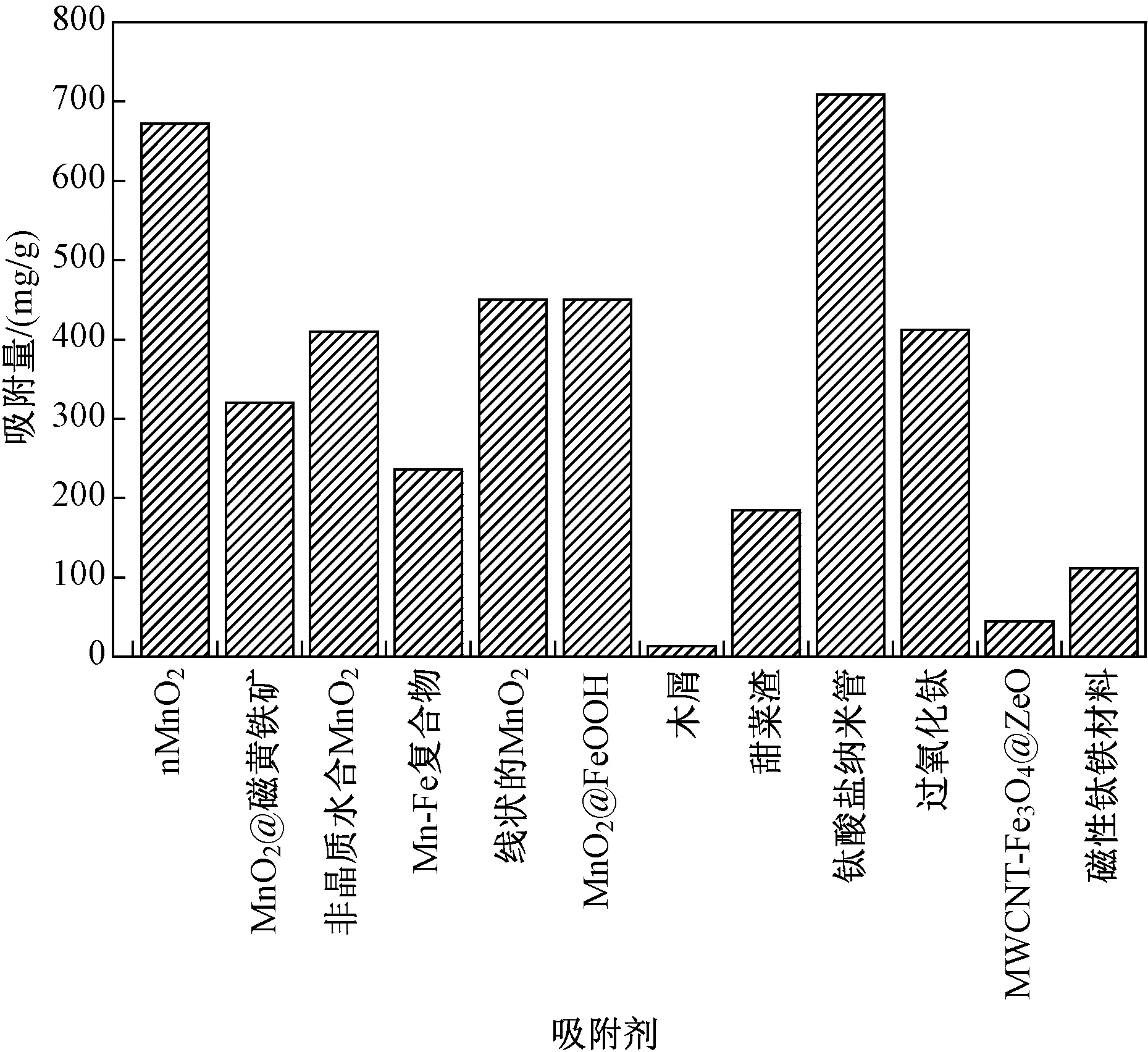
图1 不同吸附剂对Tl的吸附量比较Fig.1 Sorption capacities of Tl on different kinds of adsorbents
由图1可见,锰氧化物对Tl的吸附量均较大,超过200 mg/g,nMnO2对Tl的最大吸附量高达672 mg/g,同时钛纳米管对Tl的吸附性也较好,但是吸附量并不是判定吸附剂性能的唯一指标,吸附剂再生性、成本及可分离性也是吸附剂优劣的重要评定指标;虽然钛纳米管对Tl的吸附性也较好,但是成本相对更高. 在实际环境中某些阳离子可能比Tl的浓度大得多[23],因此吸附剂的吸附选择性而不是吸附能力决定了吸附剂的可应用性;LI等[4]通过对吸附剂的再生试验表明,Fe-Mn吸附剂在5个连续性吸附-解吸试验后依然保持高效和稳定的Tl去除水平(>90%),而高分子聚合型nMnO2通过适当的操作,可循环利用10次以上[23].
值得注意的是,Mn本身也是一种重金属,GB 5749—2006规定饮用水中Mn浓度不超过0.1 mg/L,因此在实际运用锰氧化物去除Tl污染时,需考虑水中溶解的Mn浓度. 在CHEN等[37]的研究中,化学合成的纯MnO2在溶液中的溶解量远超过0.1 mg/L;但是Mn被蛭石固化形成的MnO2-蛭石复合材料中Mn的溶解情况可忽略不计,再次说明了该材料对Tl去除的安全和有效性;HUANGFU等[20]利用同样浓度的nMnO2分别去除Tl(Ⅰ)和Tl(Ⅲ),去除Tl(Ⅲ)后液体中残留的Mn浓度更高,因为高价的Tl(Ⅲ)相比Tl(Ⅰ)可以取代MnO2表面更多的Mn.
2 影响Tl在锰氧化物上去除的因素
目前文献中探讨的影响Tl在锰氧化物上去除的主要因素包含pH、共存离子及有机质,下文详细阐述各因素对锰氧化物去除Tl的影响,需要注意各因素之间可能存在相关性.
2.1 pH
pH是影响Tl在锰氧化物上去除转化的最重要因素之一(见表2). 研究表明[47],碱性条件有利于Tl(Ⅰ)的去除,HUANGFU等[20]研究结果证实当pH从7.1升至9.0,nMnO2增强的石英砂对地表水中Tl的去除效果明显提升,但是WAN等[22]用水合MnO2去除Tl(Ⅰ)发现,随着pH由2升至8,吸附量先降后升,在pH为4时吸附量最低;LI等[4]用MnO2@磁黄铁矿处理含Tl(Ⅰ)废水发现,当反应的pH超过吸附剂的pHpzc,pH对Tl的去除影响较小,当pH低于pHpzc,会造成Tl去除率的轻微下降,这与用Fe-Mn复合物去除Tl(Ⅰ)的研究结果一致[41].

表2 pH对不同类型锰氧化物去除Tl的影响
pH直接影响不同类型锰氧化物对Tl的去除机制,这与锰氧化物表面携带的电荷性质有关. 当pH小于pHpzc时,Tl+和吸附剂表面携带的正电荷产生静电斥力作用,不利于酸性条件下锰氧化物对Tl(Ⅰ)的吸附去除,随着pH的上升,锰氧化物表面负电荷的增多使Tl-Mn之间的静电引力作用增强,从而有利于Tl的吸附[2,22,25],碱性条件也有利于锰氧化物对Tl的催化氧化[30],低pH有利于Tl(Ⅰ)氧化形成Tl2O3沉淀去除,会提升Tl的去除效率;当pH大于pHpzc时,Tl+很容易吸附到带负电的吸附剂表面.
研究[25]表明,锰氧化物在较大的pH范围内很容易与变价金属Tl发生氧化还原反应,氧化过程比吸附过程缓慢;Tl与nMnO2之间的氧化还原作用在酸性条件下更易发生,Mn(Ⅳ/Ⅲ)被还原成Mn(Ⅲ/Ⅱ),导致Mn(Ⅱ)的释放[23,31,34],这与其他重金属包括As(Ⅲ)、U(Ⅵ)和Cr(Ⅲ)在酸性条件下容易被锰氧化物氧化情况一致[48-50]. 总体而言,pH是影响锰氧化物去除Tl的最关键因素,对静电作用和氧化还原作用的影响最大.
2.2 共存离子
水体中多种共存离子可通过竞争吸附及络合作用的方式强烈影响锰氧化物对Tl的去除. 研究[20,31,47]表明,Ca2+、Mg2+等阳离子主要通过竞争锰氧化物表面的吸附位点、和nMnO2产生共凝聚作用抑制Tl的吸附,其中Ca2+的影响大于Mg2+;但是在较低浓度下(<1 mmol/L)此影响并不显著[4];Na+作为一种背景电解离子,对锰氧化物吸附Tl的影响小于Ca2+和Mg2+;而阴离子中SiO32-、PO43-和CO32-也会对Tl的吸附产生抑制作用. 由于Ca2+更容易和Tl(Ⅲ)产生络合作用,因此对Tl(Ⅲ)比Tl(Ⅰ)去除抑制作用更强[31]. 而改性锰氧化物或锰氧化物复合材料如水合MnO2、MnO2@FeOOH,由于对Tl具有更好的吸附选择性,受Ca2+、Mg2+影响较小[8,22-23],这类材料对Tl的吸附具有更好的优势.
共存重金属离子对锰氧化物去除Tl的影响研究相对较少,同一剂量锰氧化物对含Tl单一溶液和含Tl重金属复合溶液的去除率区别不大;Pb2+、Cr3+和Cd2+的存在对Tl-Mn体系的影响不显著[47],但是混合体系中金属污染物的优先去除问题是需要注意的方面,因为目前对于Tl的研究集中于人工合成水或废水环境,实际废水中除了含有Tl,还包含Pb2+、Cu2+等多种离子,因此锰氧化物对实际环境中Tl的去除效率可能会降低[2].
共存离子对不同类型锰氧化物去除Tl的影响如表3所示,具体的影响与离子浓度及锰氧化物类型有关. 总体而言,以Ca2+、Mg2+为代表的无机阳离子主要通过竞争吸附影响锰氧化物对Tl的去除,但是部分改性或锰氧化物复合材料由于具有较好的吸附选择性,受竞争吸附离子的影响较小;阴离子和重金属离子对锰氧化物去除Tl的影响研究目前较少,阴离子的影响主要以竞争吸附为主,重金属离子的影响需要考虑混合体系中金属污染物的优先去除问题.

表3 共存离子对不同类型锰氧化物去除Tl的影响
2.3 有机质
有机质如腐殖酸(HA)等对水体中Tl的去除有很大影响,HA既可以与Tl发生络合作用,又会影响锰氧化物对Tl的吸附[25],这与HA的浓度密切相关. 研究表明[4],低浓度(小于0.5 mmol/L)的HA可能对Tl去除影响不显著,但是HA浓度高于0.5 mmol/L时,会降低Fe-Mn复合物对Tl去除率,主要是因为HA和MnO2产生表面络合作用;HA也会使nMnO2对石英砂吸附Tl的效率受到抑制[20];Tl(Ⅰ)和Tl(Ⅲ)受HA的影响程度不同,由于Tl(Ⅲ)和HA形成更稳定的络合物,因此HA存在时,Tl(Ⅲ)的溶解度增大的程度高于Tl(Ⅰ),导致nMnO2对Tl(Ⅲ)去除效率降低得更多.
值得注意的是,pH对HA与Tl的络合能力有很大影响,LIU等[25]研究发现,随着pH升高,Tl和HA之间的络合能力明显增强,HA酸性基团的解离会增强金属的络合位点;此外,因为HA可能会还原MnO2,导致nMnO2的溶解[20,31-32].
不同类型的HA对Tl吸附的影响也不同. LIU等[25]发现从珠江沉积物中分离的HA和矿地附近沉积物采集的HA对Tl在天然锰矿物上吸附的影响不同,前者表现为抑制吸附,后者表现为先抑制后促进吸附,这可能与HA的性质有关,前者虽然含有更多的羧基和酚羟基官能团,但是与Tl的络合能力更弱. 除了HA,有机配体EDTA和DTPA对Fe-Mn复合物对Tl的吸附产生严重的抑制作用,虽然EDTA和DTPA与Tl(Ⅰ)的络合能力较差,但是与Tl(Ⅲ)的络合能力很强,Tl(Ⅲ)与EDTA和DTPA的稳定常数(lgK)分别高达38和46,因此EDTA和DTPA常常用来分离Tl[41].
总之,以HA为代表的有机质对锰氧化物吸附Tl的影响不可忽略,pH及HA类型和浓度都会影响HA和Tl之间的络合,也会影响锰氧化物对Tl的吸附. 具体通过3种方式影响Tl在锰氧化物上的吸附:首先是阻塞矿物表面的吸附位点,HA本身也可能被锰氧化物吸附;其次HA和Tl之间发生络合作用,HA和Tl竞争矿物表面的吸附位点;再者HA也可能形成Tl-HA-Mn表面络合物从而增强Tl的吸附[25]. 这和有机质、锰氧化物的类型及反应的pH条件密切相关.
3 Tl在锰氧化物上的去除机制
Tl在锰氧化物上的吸附机制是众多研究者关注的热点问题,锰氧化物的定量表征推动了Tl去除机制的深入研究. Wick等[14]采用Tl LⅢ-X射线吸收近边结构(X-ray absorption near edge structure, XANES)结合线性拟合的方式确定了Tl在锰氧化物上的氧化形态;而对扩展的X射线吸收精细结构(extended X-ray absorption fine structure, EXAFS)光谱的壳拟合表征了Tl局部协调的方式,量化了Tl在锰氧化物上的吸附机制;EXAFS光谱表征结果证实Tl(Ⅲ)在δ-MnO2空位或边缘的协同吸附机制更加复杂;Peacock等[34]采用相似的研究方法探究了Tl在水钠锰矿和钡镁锰矿上的吸附机制,通过Mn2p2/3XPS光谱表征量化了吸附后Mn价态的变化,说明Tl(Ⅰ)和Mn(Ⅳ)之间发生了氧化还原作用,pH越低,Mn的还原程度越高[2]. Tl在复合型材料上的吸附方式更加复杂,对于锰氧化物包裹型的材料,Tl(Ⅰ)可能会先从溶液中迁移到吸附剂的内壳结构中,然后再与锰氧化物表面的吸附位点相结合,最后达到平衡状态[4].
Tl在锰氧化物上的吸附机制主要包括络合作用、氧化沉淀、离子交换、静电引力和同位素分馏作用(见图2),下面分别就每种吸附机制进行阐述.

图2 Tl在锰氧化物上的去除机制概念模型Fig.2 Schematic diagram of Tl removal mechanisms by manganese oxides
3.1 络合作用
络合作用分为表面络合和内球络合. 表面络合是由静电或范德华力构成的非特异性作用力主导;内球络合由较强的共价键或离子键构成的特异性作用力支配,受共存离子的影响较小[22,51]. 结合FTIR光谱结果,LI等[4]发现MnO2表面羟基化的Mn-O-H和MnO6八面体中的Mn-O是Tl(Ⅰ)在锰氧化物表面发生络合作用的重要基团,WAN等[22]把这种作用称为离子交换作用〔见式(1)和式(2)〕;不同于这种表面络合作用,Tl也可通过内球络合吸附到水合MnO2和Fe-Mn复合物上,络合作用的大小与金属价态密切相关,Tl(Ⅲ)的络合能力显著强于Tl(Ⅰ)[22,41],LIU等[25]也证实了Tl可以通过内球络合吸附到软锰矿上;Peacock等[34]结合XANES和EXAFS光谱分析,认为Tl(Ⅲ)以内球三齿表面络合物的方式吸附到了水钠锰矿八面体空位中.
—Mn—OH+Tl+⟺Mn—O—Tl+H+
(1)
3—Mn—OH+Tl3+⟺(Mn—O—)3Tl+3H+(2)
3.2 氧化沉淀
鉴于锰氧化物强大的氧化性能,Tl(Ⅰ)氧化成沉淀态Tl(Ⅲ)是非常重要的去除机制[4,41]. LI等[4]通过定量化表征证实了吸附到MnO2@磁黄铁矿上的Tl(Ⅰ)部分氧化成了Tl2O3(39.2%)和Tl2O(55.4%),并沉淀在锰氧化物的中孔结构中,这与CHEN等[37]研究结果一致;多位学者证实了这种氧化沉淀作用在酸性条件下更为明显[23,52-53],如PAN等[23]发现当pH为2.02时,超过一半的Tl(Ⅰ)氧化成难溶的Tl(Ⅲ);而在pH接近中性(5.83)只有很少的Tl被氧化,该酸性条件下的氧化沉淀反应式如下:
2MnO2(s)+2H++2Tl+⟹
2Mn2++Tl2O3(s)+H2O
(3)
在氧化条件下,固态的Tl(OH)3可能是Tl在水溶液中的主要存在形式,这与体系pH密切相关;pH为7.0左右,Tl(OH)3的平衡浓度<0.001 ng/L,把水中的Tl(Ⅰ)氧化成Tl(OH)3沉淀去除是非常有效的一种方法[54].
3.3 离子交换
由于Tl+的价态和离子半径类似于K+,因此矿物结构上的Tl-K置换是Tl吸附到矿物锰氧化物上的一种特殊方式,如土壤中对Tl起滞留作用的常常是水钠锰矿,因为Tl+通过取代K+吸附到水钠锰矿上[55];Wick等[14]指出,Tl和Cs+类似,主要通过阳离子交换的方式吸附到钡镁锰矿和三晶斜系水钠锰矿上的多层吸附位点,除了矿物锰氧化物,Tl(Ⅰ)也通过阳离子交换作用吸附到多层碳纳米管上[56],因此离子交换是矿物锰氧化物去除Tl的一个重要机制;由于蛭石矿物的存在,MnO2-蛭石复合材料表面的K+也可被Tl+取代,从而促进其对Tl的吸附[37].
3.4 静电引力
pH对静电作用的影响较大,Tl(Ⅰ)在较大的pH范围内(4~9)都是以Tl+的形式存在[31],酸性条件下,锰氧化物表面携带较多正电荷,和Tl+产生静电斥力作用,不利于Tl的吸附;随着pH升高,超过锰氧化物的pHpzc,锰氧化物表面携带的负电荷和Tl+之间产生的静电引力会促进Tl的吸附[2,4,37];由于Tl在锰氧化物上的吸附往往包含多种机制,LI等[4]基于自己的试验条件总结了3种吸附机制按贡献大小排序为表面络合>氧化沉淀>静电引力.
3.5 同位素分馏
Tl的稳定同位素主要是203Tl和205Tl[57],Peacock等[34]提出了吸附-氧化-分馏机制用于解释Tl在海洋锰铁外壳中的富集行为,即Tl(Ⅰ)在吸附和随后氧化成Tl(Ⅲ)到Fe-Mn沉积物表面过程中存在着同位素分馏平衡;Nielsen等[7]探究了Tl在六边形水钠锰矿上的同位素分馏机制,认为分馏的程度和Tl的初始液相浓度成反比,受温度和试验时间的影响不大.
值得指出的是Tl在同一类型锰氧化物上的去除往往包含多种吸附机制. 虽然目前锰氧化物对Tl去除机制的研究已有了一定的探索,但锰氧化物的结构、性质作为影响Tl去除机制的最主要因素仍然有待深入研究,络合作用、氧化沉淀及静电引力是锰氧化物去除Tl的主要机制,几乎同时贯穿于所有锰氧化物对Tl的去除研究中,但它们同时存在时的关系和占比尚不明确;而离子交换及同位素分馏作用主要体现在矿物锰氧化物对Tl的去除研究中,目前探索相对较少.
4 结论与展望
a) 锰氧化物作为一种良好的吸附剂和氧化剂,具有广阔的应用前景. 前人对锰氧化物去除水体中Tl的研究表明:锰氧化物对Tl具有较好的吸附和氧化能力,经过合理改性的锰氧化物、锰氧化物与其他物质的复合材料对Tl具有更好的吸附选择性,同时可重复利用和分离性相对更好.
b) pH、共存离子和有机质是影响锰氧化物去除Tl的关键因素,其中pH直接影响锰氧化物去除Tl的机制,共存离子及有机质类型与浓度对锰氧化物去除Tl的影响需要进一步研究.
c) 虽然锰氧化物对Tl的吸附机制已有一定研究基础,但锰氧化物结构和性质对其去除Tl的影响尚不明确,特别是改性锰氧化物和锰氧化物复合材料去除Tl的机制更加复杂;Tl(Ⅰ)和Tl(Ⅲ)在去除过程中的联系和区别的定性和定量分析目前探索较少;部分学者关注锰氧化物对Tl去除效率的同时,考虑Mn离子在水溶液中的溶解释放量,今后需加强水溶液中Mn浓度对Tl吸附的影响及吸附剂稳定性的关注.
d) 未来Tl在锰氧化物上的研究重点可从以下三方面开展:首先,不同制备方法、不同晶型结构的锰氧化物对Tl的去除研究,结合先进的分析技术、表征手段和模型对吸附机理进行定性和定量分析;其次,基于地表水和工业废水的研究背景,进一步探索锰氧化物对低温、贫氧特殊地下水环境中Tl的去除效果和特征;最后,基于合成锰氧化物的研究基础及鉴于生物氧化锰对其他重金属优越的去除性能,考虑微生物和锰氧化物的结合用于水体中Tl的修复是未来发展趋势.
参考文献(References):
[1] 赵悦鑫,程方,门彬,等.铊在水-沉积物界面过程的研究进展[J].环境化学,2019,38(9):2047-2054.
ZHAO Yuexin,CHENG Fang,MEN Bin,etal.The water-sediment interfacial process of thallium[J].Environmental Chemistry,2019,38(9):2047-2054.
[2] LI Keke,LI Huosheng,XIAO Tangfu,etal.Synthesis of manganese dioxide with different morphologies for thallium removal from wastewater[J].Journal of Environmental Management,2019,251:109563.
[3] 王松,陈家昌,戴振宇,等.铊污染地下水的微生物修复研究[J].地球与环境,2018,46(3):282-287.
WANG Song,CHEN Jiachang,DAI Zhenyu,etal.A research on microbial remediation of Tl contaminated water[J].Earth and Environment,2018,46(3):282-287.
[4] LI Huosheng,LI Xiuwan,XIAO Tangfu,etal.Efficient removal of thallium(Ⅰ) from wastewater using flower-like manganese dioxide coated magnetic pyrite cinder[J].Chemical Engineering Journal,2018,353:867-877.
[5] 邓红梅,陈永亨,刘涛,等.铊在土壤-植物系统中的迁移积累[J].环境化学,2013,32(9):1749-1757.
DENG Hongmei,CHEN Yongheng,LIU Tao,etal.Study on the translocation and accumulation of thallium in soil-plant system[J].Environmental Chemistry,2013,32(9):1749-1757.
[6] 邓红梅,王耀龙,吴宏海,等.γ-MnO2对Tl(Ⅰ)的吸附性能[J].环境科学研究,2015,28(1):103-109.
DENG Hongmei,WANG Yaolong,WU Honghai,etal.Characteristics of Tl(Ⅰ) adsorption on γ-MnO2[J].Research of Environmental Sciences,2015,28(1):103-109.
[7] NIELESN S G,WASYLENKI L E,REHKMPER M,etal.Towards an understanding of thallium isotope fractionation during adsorption to manganese oxides[J].Geochimica et Cosmochimica Acta,2013,117:252-265.
[8] CHEN Meiqing,WU Pingxiao,YU Langfeng,etal.FeOOH-loaded MnO2nano-composite:an efficient emergency material for thallium pollution incident[J].Journal of Environmental Management,2017,192:31-38.
[9] 孙嘉龙,肖唐付,周连碧,等.铊矿山废水的微生物絮凝处理研究[J].地球与环境,2010,38(3):383-386.
SUN Jialong,XIAO Tangfu,ZHOU Lianbi,etal.Bioflocculant treatment of mine water from Tl Mineralized Area[J].Earth and Environment,2010,38(3):383-386.
[10] LAW S,TURNER A.Thallium in the hydrosphere of south west England[J].Environmental Pollution,2011,159(12):3484-3489.
[11] DINELLI E,LIMA A,DE VIVO B,etal.Hydrogeochemical analysis on Italian bottled mineral waters:effects of geology[J].Journal of Geochemical Exploration,2010,107(3):317-335.
[12] WICK S,BAEYENS B,FERNANDES M M,etal.Thallium sorption and speciation in soils:role of micaceous clay minerals and manganese oxides[J].Geochimica et Cosmochimica Acta,2020,288:83-100.
[13] XU Haiyin,LUO Yuanling,WANG Ping,etal.Removal of thallium in water/wastewater:a review[J].Water Research,2019,165:114981.
[14] WICK S,PENA J,VOEGELIN A.Thallium sorption onto manganese oxides[J].Environment Science & Technology,2019,53(22):13168-13178.
[15] LI Keke,LI Huosheng,XIAO Tangfu,etal.Removal of thallium from wastewater by a combination of persulfate oxidation and iron coagulation[J].Process Safety and Environmental Protection,2018,119:340-349.
[16] LIN T S,NRIAGU J O.Thallium speciation in river waters with Chelex-100 resin[J].Analytica Chimica Acta,1999,395(3):301-307.
[17] NAGEL A H,CUSS C W,GOSS G G,etal.The effect of major ions and dissolved organic matter on complexation and toxicity of dissolved thallium toDaphniamagna[J].Environmental Toxicology and Chemistry,2019,38(11):2472-2479.
[18] TEBO B M,BARGAR J R,CLEMENT B G,etal.Biogenic manganese oxides:properties and mechanisms of formation[J].Annual Review of Earth and Planetary Sciences,2004,32:287-328.
[19] 孟佑婷,郑袁明,张丽梅,等.环境中生物氧化锰的形成机制及其与重金属离子的相互作用[J].环境科学,2009,30(2):574-582.
MENG Youting,ZHENG Yuanming,ZHANG Limei,etal.Formation and reactions of biogenic manganese oxides with heavy metals in environment[J].Enviromental Sciences,2009,30(2):574-582.
[20] HUANGFU Xiaoliu,MA Chengxue,MA Jun,etal.Effective removal of trace thallium from surface water by nanosized manganese dioxide enhanced quartz sand filtration[J].Chemosphere,2017,189:1-9.
[21] ZHAO Zhuo,XIONG Yanhang,CHENG Xiankun,etal.Adsorptive removal of trace thallium(Ⅰ) from wastewater:a review and new perspectives[J].Journal of Hazardous Materials,2020,393:122378.
[22] WAN Shunli,MA Minghai,LV Lu,etal.Selective capture of thallium(Ⅰ) ion from aqueous solutions by amorphous hydrous manganese dioxide[J].Chemical Engineering Journal,2014,239:200-206.
[23] PAN Bingcai,WAN Shunli,ZHANG Shujuan,etal.Recyclable polymer-based nano-hydrous manganese dioxide for highly efficient Tl(Ⅰ) removal from water[J].Science China-Chemistry,2014,57(5):763-771.
[24] REN Zhichang,WU Wanling,YU Ling,etal.Hydrothermal synthesis of needle-shaped manganese oxide nanoparticle for superior adsorption of thallium(Ⅰ):characterization,performance,and mechanism study[J].Environmental Science and Pollution Research,2019,26(36):36776-36785.
[25] LIU Juan,LIPPOLD H,WANG Jin,etal.Sorption of thallium(Ⅰ) onto geological materials:influence of pH and humic matter[J].Chemosphere,2011,82(6):866-871.
[26] 王鑫浩.不同晶型MnO2吸附剂对水中铊及锑的吸附效果研究[D].西安:西安工程大学,2018:5-6.
[27] VILLALABOS M,LANSON B,MANCEAU A,etal.Structural model for the biogenic Mn oxide produced byPseudomonasputida[J].American Mineralogist,2006,91(4):489-502.
[28] BALGOOYEN S,ALAIMO P J,REMUCAL CK,etal.Structural transformation of MnO2during the oxidation of bisphenol A[J].Environmental Science & Technology,2017,51(11):6053-6062.
[29] BIDOGLIO G,GIBSON P N,OGORMAN M,etal.X-ray-absorption spectroscopy investigation of surface redox transformations of thallium and chromium on colloidal mineral oxides[J].Geochimica Et Cosmochimica Acta,1993,57(10):2389-2394.
[30] ZOU Yijie,CHENG Haijun,WANG Hainan,etal.Thallium(Ⅰ) oxidation by permanganate and chlorine:kinetics and manganese dioxide catalysis[J].Environmental Science & Technology,2020,54(12):7205-7216.
[31] HUANGFU Xiaoliu,JIANG Jin,LU Xixin,etal.Adsorption and oxidation of thallium(Ⅰ) by a nanosized manganese dioxide[J/OL].Water Air and Soil Pollution,2015.doi:https://doi.org/10.1007/s11270-014-2272-7.
[32] HUANGFU Xiaoliu,MA Chengxue,MA Jun,etal.Significantly improving trace thallium removal from surface waters during coagulation enhanced by nanosized manganese dioxide[J].Chemosphere,2017,168:264-271.
[33] 马铖雪,皇甫小留,何强,等.纳米MnO2强化过滤去除水中痕量铊[J].中国给水排水,2017,33(21):1-5.
MA Chengxue,HUANGFU Xiaoliu,HE Qiang,etal.Removal of trace Tl from drinking water by enhanced filtration using nanosized MnO2[J].China Water & Wastewater,2017,33(21):1-5.
[34] PEACOCK C L,MOON E M.Oxidative scavenging of thallium by birnessite:Explanation for thallium enrichment and stable isotope fractionation in marine ferromanganese precipitates[J].Geochimica Et Cosmochimica Acta,2012,84:297-313.
[35] YU Qianqian,OHNUKI T,KOZAI N,etal.Quantitative analysis of radiocesium retention onto birnessite and todorokite[J].Chemical Geology,2017,470:141-151.
[36] TSUJI M,KOMARNENI S.Powder X-ray-diffraction study of a cryptomelane-type manganic acid and its alkali cation-exchanged forms[J].Journal of Materials Research,1993,8(12):3145-3150.
[37] CHEN Meiqing,WU Pingxiao,LI Shuaishuai,etal.The effects of interaction between vermiculite and manganese dioxide on the environmental geochemical process of thallium[J].Science of the Total Environment,2019,669:903-910.
[38] ZHAO Zhiwei,LIU Jie,CUI Fuyi,etal.One pot synthesis of tunable Fe3O4-MnO2core-shell nanoplates and their applications for water purification[J].Journal of Materials Chemistry,2012,22(18):9052-9057.
[39] KIM E J,LEE C S,CHANG Y Y,etal.Hierarchically structured manganese oxide-coated magnetic nanocomposites for the efficient removal of heavy metal ions from aqueous systems[J].Acs Applied Materials & Interfaces,2013,5(19):9628-9634.
[40] LI Keke,LI Huosheng,XIAO Tangfu.Zero-valent manganese nanoparticles coupled with different strong oxidants for thallium removal from wastewater[J].Frontiers of Environmental Science & Engineering,2020,14(2):1-13.
[41] LI Huosheng,CHEN Yongsheng,LONG Jianyou,etal.Removal of thallium from aqueous solutions using Fe-Mn binary oxides[J].Journal of Hazardous Materials,2017,338:296-305.
[42] GUGUSHE A S,MPUPA A,NOMNGONGO P N.Ultrasound-assisted magnetic solid phase extraction of lead and thallium in complex environmental samples using magnetic multi-walled carbon nanotubes/zeolite nanocomposite[J].Microchemical Journal,2019,149:103960.
[43] MEMON S Q,MEMON N,SOLANGI A R,etal.Sawdust:a green and economical sorbent for thallium removal[J].Chemical Engineering Journal,2008,140(1/2/3):235-240.
[44] ZHANG Gaosheng,FAN Fang,LI Xiangping,etal.Superior adsorption of thallium(Ⅰ) on titanium peroxide:performance and mechanism[J].Chemical Engineering Journal,2018,331:471-479.
[45] PU Yubing,YANG Xiaofang,ZHENG Hong,etal.Adsorption and desorption of thallium(Ⅰ) on multiwalled carbon nanotubes[J].Chemical Engineering Journal,2013,219:403-410.
[46] ZOLGHARNEIN J,ASANJARANI N,SHARIATMANESH T.Removal of thallium(Ⅰ) from aqueous solution using modified sugar beet pulp[J].Toxicological and Environmental Chemistry,2011,93(2):207-214.
[47] 刘陈敏,张平,彭彩红,等.直接氧化生成锰氧化物去除水中铊的研究[J].水处理技术,2016,42(8):52-56.
LIU Chenmin,ZHANG Ping,PENG Caihong,etal.Research on removal of thailiun in water using manganese oxide generated by direct oxidation[J].Technology of Water Treatment,2016,42(8):52-56.
[48] LAFFERTY B J,GINDER-VOGEL M,ZHU M Q,etal.Arsenite oxidation by a poorly crystalline manganese-oxide.2.results from X-ray absorption spectroscopy and X-ray diffraction[J].Environmental Science & Technology,2010,44(22):8467-8472.
[49] LANDROT G,GINDER-VOGEL M,LIVI K,etal.Chromium(Ⅲ) oxidation by three poorly-crystalline manganese(Ⅳ) oxides 1.:chromium(Ⅲ):oxidizing capacity[J].Environmental Science & Technology,2012,46(21):11594-11600.
[50] WANG Z M,LEE S W,KAPOOR P,etal.Uraninite oxidation and dissolution induced by manganese oxide:a redox reaction between two insoluble minerals[J].Geochimica Et Cosmochimica Acta,2013,100:24-40.
[51] LALHMUNSIAMA,LEE SM,TIWARI D.Manganese oxide immobilized activated carbons in the remediation of aqueous wastes contaminated with copper(Ⅱ) and lead(Ⅱ)[J].Chemical Engineering Journal,2013,225:128-137.
[52] GAO Y,LEERMAKERS M,ELSKENS M,etal.High resolution profiles of thallium,manganese and iron assessed by DET and DGT techniques in riverine sediment pore waters[J].Science of the Total Environment,2007,373(2/3):526-533.
[53] KOSCHINSKY A,HEIN J R.Uptake of elements from seawater by ferromanganese crusts:solid-phase associations and seawater speciation[J].Marine Geology,2003,198(3/4):331-351.
[54] LIN T S,NRIAGU J.Revised hydrolysis constants for thallium(Ⅰ) and thallium(Ⅲ) and the environmental implications[J].Journal of the Air & Waste Management Association,2011,48(2):151-156.
[55] VANEK A,KOMAREK M,VOKURKOVA P,etal.Effect of illite and birnessite on thallium retention and bioavailability in contaminated soils[J].Journal of Hazardous Materials,2011,191(1/2/3):170-176.
[56] PU Yubing,YANG Xiaofang,ZHENG Hong,etal.Adsorption and desorption of thallium(Ⅰ) on multiwalled carbon nanotubes[J].Chemical Engineering Journal,2013,219:403-410.
