经皮穴位电刺激对类风湿关节炎大鼠外周阿片肽表达水平的影响
2021-06-23刘天红宋召军裘晟晨
刘天红,宋召军,裘晟晨
(浙江大学医学院附属第四医院,义乌 322000)
类风湿关节炎(rheumatoid arthritis, RA)是一种常见的自身免疫性疾病[1],以糜烂性、反复迁延性、对称性的多个小关节病变为主要特征[2],临床表现为慢性滑膜炎、关节组织破坏和功能受损[3-4]。RA所致的进行性关节损伤和功能性残疾严重影响患者的身心健康以及生活[5-6]。RA临床治疗,主要采用消炎镇痛、免疫抑制剂和激素治疗为主,这些治疗方法会导致多种不良反应和毒副作用。
经皮穴位电刺激(transcutaneous electrical acupointstimulation, TEAS)是以针灸经络学理论为依据,在皮肤特定穴位贴敷电极片,以不同频率和强度的脉冲电流作用于人体治疗的技术,是中医针灸学与经皮神经电刺激(transcutaneous electricalnerve stimulation, TENS)相辅相成的新型疗法,在缓解急慢性疼痛、改善患者生活质量等方面疗效显著[7-8]。TEAS抗炎镇痛效应非常明确,但机理研究主要局限于对致炎性细胞因子等炎症介质的调节上[9-10]。已有大量研究证明TEAS能有效促进RA模型大鼠内源性阿片肽(endogenous opioid peptide, EOP)的释放而达到中枢镇痛作用,也有初步研究显示TEAS同样能通过刺激外周阿片肽(peripheral opioid peptide, POP)及其受体的释放与激活而干预外周疼痛[11-12],但 TEAS是否作为一种有效刺激,激活外周炎症局部阿片系统,产生对RA炎症疼痛的综合调节,仍缺少足够的研究。
本文旨在从外周神经免疫途径研究 TEAS治疗对RA大鼠炎症疼痛的抑制效应、对外周和炎症局部阿片肽释放和受体的激活及致炎性细胞因子的调控情况,阐明类风湿关节炎疼痛(及其他类似慢性疼痛)的TEAS治疗机制。
1 材料与方法
1.1 实验动物
选用SPF级健康雄性Wistar大鼠60只,体质量(180±10)g,购自中国科学院上海实验动物中心[SCXK(沪)2017-0005],由浙江大学实验动物中心饲养。饲养期间给予啮齿动物标准颗粒饲养(由实验动物中心提供)和自由饮水,12 h循环照明。动物实验经浙江大学伦理委员会批准,动物的操作遵照国内外相关伦理要求执行。
1.2 主要试剂和仪器
动物用七氟烷气体麻醉剂(R511-22,深圳瑞沃德公司),TRIZOL(15596026,美国 Invitrogen公司),裂解液(P0013C,江苏碧云天公司),蛋白酶抑制剂(E429,美国Amresco公司),逆转录试剂盒(RR047A,宝生物工程公司),Ssofast Eva Green Super Mix(1725202,美国 Bio-RAD公司),弗氏完全佐剂 CFA(F5581,美国Sigma 公司),IL-1β、IL-6、TNF-α和前列腺素E2(Prostaglandin E2, PGE2)ELISA试剂盒(20191210,北京华英生物技术研究所),β内啡肽标准品(77367-63-6,英国Abcam公司),甲硫氨酸脑啡肽标准品(58569-55-4,英国 Abcam公司),强啡肽 A标准品(80448-90-4,英国 Abcam公司)。小动物气体麻醉机(R500,深圳瑞沃德公司),韩氏穴位暨神经刺激仪(Hans-200E,北京华卫公司),超声波细胞粉碎机(Scientz-950E,宁波新芝生物公司),足底测量仪(37450,意大利 UgoBasile公司),足肿容积测量仪(PV-200,成都泰盟公司),酶标仪(Cytation1,美国Bio-RAD公司),核酸蛋白分析仪(SmartSpec 3000,美国 Bio-RAD公司),荧光定量 PCR仪(CFX96,美国Bio-RAD公司),高效液相色谱仪(A46008,德国Knauer公司),HPLC色谱柱(25EE181ESJ,德国Knauer公司),紫外检测器(ADB01,德国Knauer公司)。
1.3 造模方法与分组
将实验大鼠随机分为 3组,分别为空白对照组(Normal)、模型对照组(CFA)、经皮穴位电刺激治疗组(TEAS),每组20只。CFA组和TEAS组均于右后足足底内注射CFA(2.5 mg/mL,每只注射0.1 mL,仅注射1次),建立类风湿关节炎疼痛模型[13-14]。Normal组注射等剂量生理盐水。TEAS组大鼠双后肢脱毛后,自然下垂固定,参照华兴邦大鼠穴位图谱[15],取患侧后肢足三里、昆仑穴,用直径为5 mm的圆形铂金电极,贴敷固定,使电极与皮肤保持良好接触,电极连接韩氏穴位暨神经刺激仪,疏密波刺激 2/100 Hz,强度 1~2 mA(15 min后增加1 mA),共30 min。造模24 h后开始经皮穴位电刺激治疗,每日1次,共治疗20次。CFA组仅贴敷固定铂金电极,不予通电。
1.4 指标检测
1.4.1 足跖热缩腿阈测定
采用动态足底测量仪检测大鼠患足跖热缩腿阈(thermal paw withdrawal latency, PWL)作为大鼠热痛阈指标。测量前先将大鼠置于透明塑料盒中,待大鼠安静后,将聚焦的红外热源置于大鼠右后足中央,避开足垫,对足底进行热刺激,刺激时间上限 20 s,最大热辐射强度为 30,仪器自动记录大鼠缩足反应时的潜伏期和红外辐射强度。连续测量3次,每次间隔10 min。分别于造模前和造模后1 d、4 d、8 d、12 d、16 d、20 d检测Normal组、CFA组和TEAS组实验大鼠右后足热缩腿阈变化情况。
1.4.2 关节炎指数[16]
采用WOOD氏关节炎评分标准,根据各大鼠关节红肿程度及累及关节数,计分比较。0分为正常;1分为轻微红肿,累及一个趾关节;2分为轻度红肿,累及2个及以上趾关节;3分为严重红肿,累及整个足跖;4分为重度红肿,整个足跖缺乏弹性。分别于造模前和造模后1 d、4 d、8 d、12 d、16 d、20 d检测Normal组、CFA组和TEAS组实验大鼠右后足关节炎指数变化情况。
1.4.3 足跖肿胀度测定[17]
大鼠足跖肿胀度采用足肿容积测量仪测定。以大鼠足跖毛际为标记线,分别于造模前和造模后1 d、4 d、8 d、12 d、16 d、20 d检测Normal组、CFA组和TEAS组实验大鼠右后足跖容积变化情况。足肿胀度(mL)=肿胀后各时间点足容积(mL)-肿胀前足容积(mL)。
1.4.4 足跖组织中炎性因子测定
采用 ELISA法检测足跖组织中白介素(interleukin, IL)-1β、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α和前列腺素E2(prostaglandin E2, PGE2)含量。采用七氟烷麻醉大鼠后开胸暴露心脏,使用 4℃生理盐水经升主动脉快速灌注,迅速将大鼠患侧足爪剪下,去皮,液氮中研碎,按1 mg组织加100 µL裂解液和1 µL蛋白酶抑制剂比例加入配好的裂解液,冰浴中超声粉碎,高速低温离心后,取上清。按照试剂盒说明书检测 IL-1β、IL-6、TNF-α和PGE2表达水平。
1.4.5 足跖组织中阿片肽测定
采用高效液相色谱法(HPLC)检测足跖组织中β内啡肽(β-endorphin, β-EP)、甲硫氨酸脑啡肽(methionine enkephalin, met-ENK)和强啡肽A(dynorphin A, DYN-A)含量。采用七氟烷麻醉大鼠后开胸暴露心脏,使用 4℃生理盐水经升主动脉快速灌注,迅速将大鼠患侧足爪剪下,去皮后在液氮中研碎,按1 mg组织加100 µL裂解液和1 µL蛋白酶抑制剂比例加入裂解液,冰浴中超声粉碎,高速低温离心后,取上清0.45 µm滤膜过滤。取续滤液20 µL进行HPLC测定。高效液相色谱条件为KNAUER C18色谱柱;流动相为 0~4 min乙腈(100mM)-KH2PO4,4~6 min乙腈(100mM)-水,6~12 min乙腈(100mM)-KH2PO4,流速1.0 mL/min;检测波长 210 nm;柱温为 40 ℃,进样20 µL。各杂峰与主峰分离度应大于1.5,且具有一定的主峰理塔板数。
1.4.6 足跖组织中阿片肽前体mRNA测定
采用荧光定量PCR法检测足跖组织中阿黑皮素原(proopiomelanocortin, POMC)、前脑啡肽原(proenkephalin, PENK)和前强啡肽原(prodynorphin,PDYN)阿片肽前体mRNA含量。采用七氟烷麻醉大鼠后开胸暴露心脏,使用 4 ℃生理盐水经升主动脉快速灌注,迅速将大鼠患侧足爪剪下,去皮,液氮中研为粉末(约100 mg),加入1 mL Trizol溶液,按试剂盒说明书操作步骤进行总RNA抽提、逆转录以及荧光定量PCR扩增。PCR反应体系为20 µL。以上各标本均做3个复孔。扩增条件为 95 ℃预变性 30 min,95 ℃变性10 s,61.9 ℃退火/延伸30 s,共40个循环,每个循环退火/延伸末期检测荧光信号。基因表达分析采用 2﹣△△CT法,差异≥2倍,认为基因表达增高,若≤0.5倍,认为基因表达降低[18]。各检测指标引物详见表1。
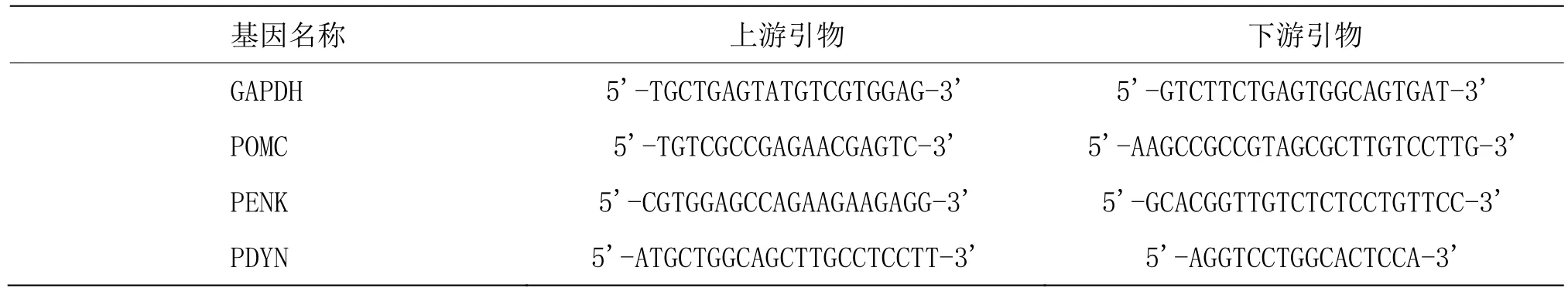
表1 内参和各目的基因的引物序列
1.5 统计学方法
采用SPSS16.0软件对数据进行统计分析。计数资料以百分数和例数表示,比较采用卡方检验;符合正态分布的计量资料以均数±标准差表示,比较采用t检验;重复测量数据采用重复测量方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 3组大鼠PWL的比较
造模前,3组大鼠PWL无明显差异(P>0.05)。CFA组和 TEAS组大鼠足趾注射 CFA24h后,PWL显著低于Normal组(P<0.01),表明成功建立大鼠类风湿关节炎疼痛模型。20 d内,CFA组大鼠各时间点PWL显著低于 Normal组,差异具有统计学意义(P<0.01)。TEAS组大鼠各时间点 PWL明显延长,20 d后 PWL显著高于CFA组,差异具有统计学意义(P<0.01),与Normal组相比无统计学差异(P>0.05)。详见表2、图1。
表2 3组大鼠PWL的比较 (±s,s)

表2 3组大鼠PWL的比较 (±s,s)
注:与Normal组比较1)P<0.01;与CFA组比较2)P<0.01
组别 n 0 d 1 d 4 d 8 d 12 d 16 d 20 d Normal组 20 11.51±0.29 11.90±0.59 11.60±0.34 11.75±0.47 12.09±0.50 11.95±0.55 12.01±0.31 TEAS 组 20 11.52±0.29 4.87±0.481) 6.33±0.44 7.00±0.50 8.43±0.47 9.80±0.47 10.33±0.572)CFA 组 20 11.42±0.30 4.73±0.471) 4.55±0.351) 5.28±0.441) 5.74±0.411) 5.59±0.291) 5.71±0.261)
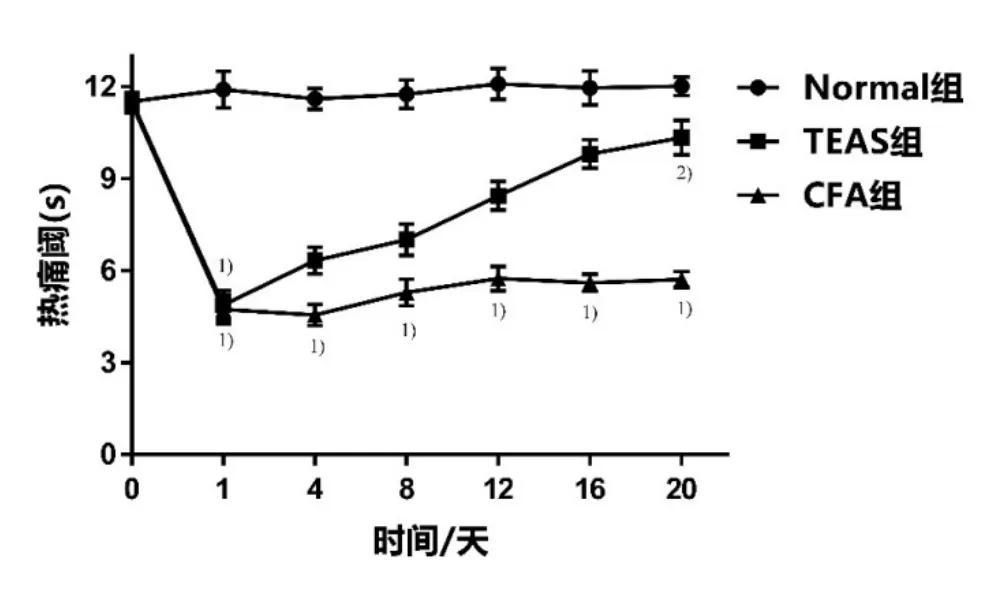
图1 TEAS治疗对CFA大鼠热痛阈的影响
2.2 3组大鼠关节炎指数的比较
造模前,3组大鼠关节炎指数均为 0分。CFA组和TEAS组大鼠足趾注射CFA 24h后,关节炎指数均达到4分,表明造模成功。20 d内,CFA组大鼠关节炎指数缓慢降低至3分;TEAS组大鼠关节炎指数较快速降低至1分,且低于CFA组(P<0.05)。详见表3、图2。
表3 3组大鼠关节炎指数的比较 (±s,分)
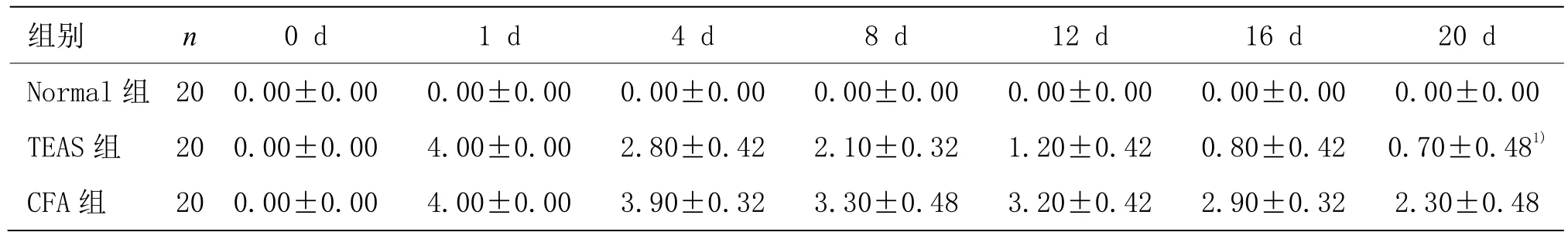
表3 3组大鼠关节炎指数的比较 (±s,分)
注:与CFA组比较1)P<0.05
组别 n 0 d 1 d 4 d 8 d 12 d 16 d 20 d Normal 组 20 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 TEAS 组 20 0.00±0.00 4.00±0.00 2.80±0.42 2.10±0.32 1.20±0.42 0.80±0.42 0.70±0.481)CFA 组 20 0.00±0.00 4.00±0.00 3.90±0.32 3.30±0.48 3.20±0.42 2.90±0.32 2.30±0.48
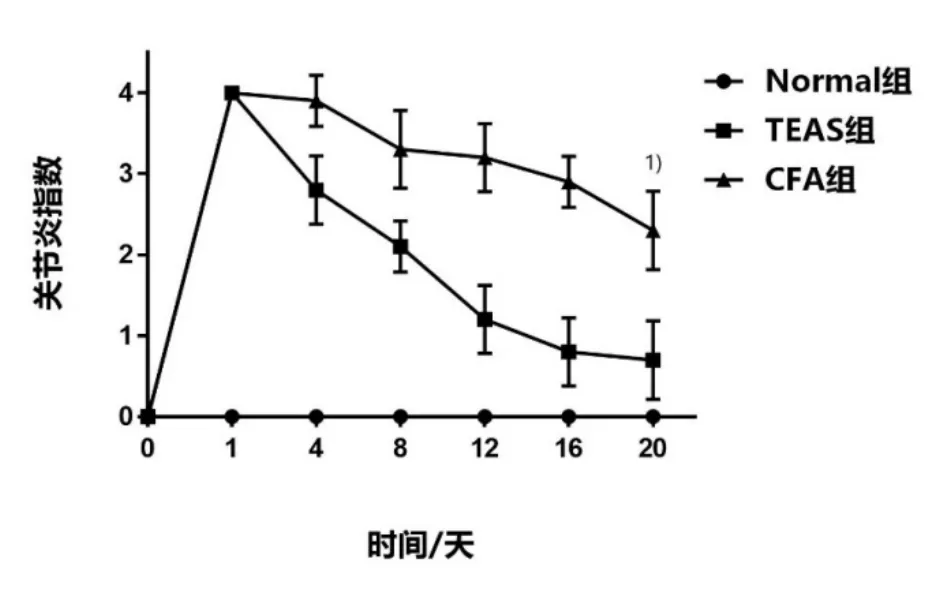
图2 3组大鼠关节炎指数的比较
2.3 3组大鼠足跖肿胀度的比较
造模前,Normal组、CFA组和TEAS组大鼠足跖大小无明显差异(P>0.05)。大鼠足趾注射 CFA 24 h后,CFA组(8.12 mL)和TEAS组(8.16 mL)大鼠足跖肿胀度无明显差异(P>0.05),表明成功建立大鼠类风湿关节炎疼痛模型。治疗20 d,TEAS组大鼠足跖肿胀度显著低于CFA组,差异具有统计学意义(P<0.01)。详见表4、图3。
表4 3组大鼠足跖肿胀度的比较 (±s, mL)
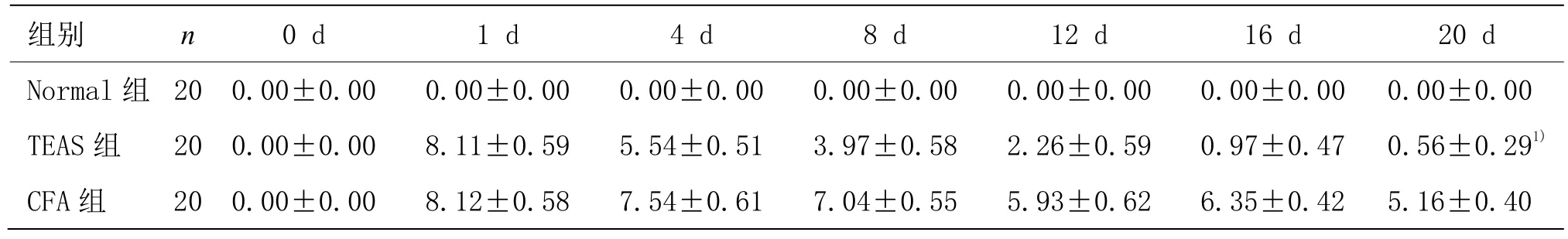
表4 3组大鼠足跖肿胀度的比较 (±s, mL)
注:与CFA组比较1)P<0.01
组别 n 0 d 1 d 4 d 8 d 12 d 16 d 20 d Normal 组 20 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 TEAS 组 20 0.00±0.00 8.11±0.59 5.54±0.51 3.97±0.58 2.26±0.59 0.97±0.47 0.56±0.291)CFA 组 20 0.00±0.00 8.12±0.58 7.54±0.61 7.04±0.55 5.93±0.62 6.35±0.42 5.16±0.40
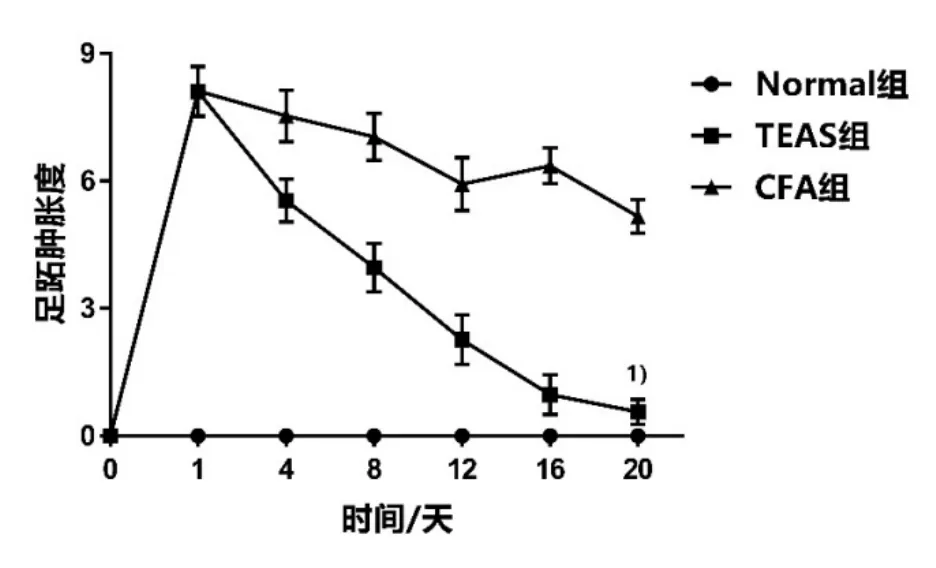
图3 3组大鼠足跖肿胀度的比较
2.4 3组大鼠炎性因子表达水平的比较
治疗20 d后,与Normal组比较,CFA组大鼠IL-1β、IL-6、TNF-α和 PGE2免疫炎性因子表达水平升高(P<0.05);与Normal组比较,TEAS组大鼠IL-1β和PGE2表达水平升高(P<0.05);与 CFA组比较,TEAS组大鼠IL-6和TNF-α表达水平降低(P<0.05)。详见表5。
表5 3组大鼠炎性因子表达水平的比较 (±s, pg/mg)

表5 3组大鼠炎性因子表达水平的比较 (±s, pg/mg)
注:与Normal组比较1)P<0.05;与CFA组比较2)P<0.05
组别 n IL-1β IL-6 TNF-α PGE2 Normal 组 20 6.89±1.91 16.32±6.46 5.89±1.42 15.33±1.49 TEAS 组 20 33.89±1.821) 23.74±4.322) 13.93±1.802) 33.44±1.851)2)CFA 组 20 27.35±5.601) 57.21±2.421) 32.64±2.991) 31.18±5.321)
2.5 3组大鼠阿片肽表达水平的比较
线性关系试验结果显示,β-EP、met-ENK和DYN-A分别在 0.1 pg/µL~1.0 pg/µL浓度范围内与峰面积呈良好的线性关系。精密度试验结果显示,β-EP、met-ENK和DYN-A连续进样6次的RSD值分别为 0.35%、0.41%和 0.32%。稳定性试验结果显示,β-EP、met-ENK和DYN-A在处理后12h内的RSD值分别为0.55%、0.63%和0.62%。重复性试验结果显示,6份β-EP、met-ENK和DYN-A测试的RSD值分别为1.15%、1.09%和 9.87%。回收率试验结果显示,9份β-EP、met-ENK和DYN-A测试的RSD值分别为0.95%、0.89%和9.13%。治疗20 d后,CFA组大鼠β-EP、met-ENK和DYN-A显著高于Normal组(P<0.05),表明慢性炎症疼痛能部分激活外周阿片系统,提示可能在炎症疼痛时存在内源性的阿片肽介导镇痛作用。TEAS组大鼠β-EP表达水平显著高于 CFA组和 Normal组(P<0.05),met-ENK表达水平与CFA组和Normal组没有明显差异(P>0.05),DYN-A表达水平与CFA组和Normal组没有明显差异(P>0.05),表明 TEAS治疗对外周阿片系统的激活是有选择性的,其镇痛作用可能与外周β-EP水平的上调表达有关。详见表6。
表6 3组大鼠阿片肽表达水平的比较 (±s, pg/mg)

表6 3组大鼠阿片肽表达水平的比较 (±s, pg/mg)
注:与Normal组比较1)P<0.05;与CFA组比较2)P<0.05
组别 n β-EP met-ENK DYN-A Normal组 20 0.25±0.05 0.19±0.03 0.14±0.02 TEAS 组 20 0.66±0.031)2) 0.37±0.031) 0.27±0.051)CFA 组 20 0.40±0.041) 0.29±0.061) 0.27±0.041)
2.6 3组大鼠阿片肽前体mRNA表达的比较
结果显示POMC、PENK mRNA在足跖炎症组织均有表达,PDYN基因在足跖炎症组织没有表达,可能存在其他调控方法。与Normal组比较,TEAS能显著上调足跖炎症组织中β-EP前体POMC基因表达水平(2.18倍),但对 met-ENK前体 PENK无显著影响(0.63倍),表明TEAS镇痛可能与外周内啡肽表达相关。详见表7。
表7 3组大鼠阿片肽前体mRNA表达的比较 (±s)
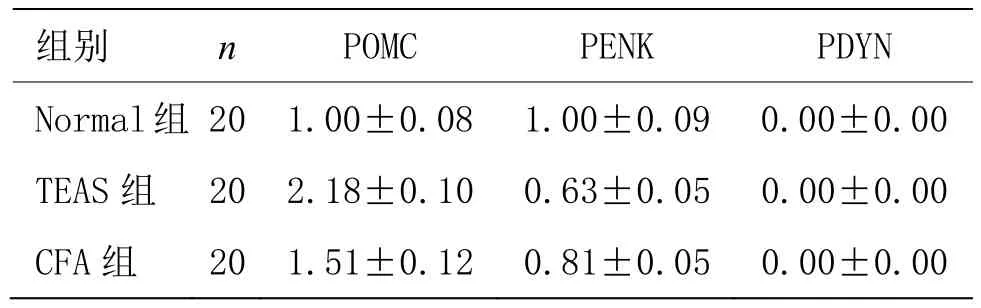
表7 3组大鼠阿片肽前体mRNA表达的比较 (±s)
组别 n POMC PENK PDYN Normal组 20 1.00±0.08 1.00±0.09 0.00±0.00 TEAS 组 20 2.18±0.10 0.63±0.05 0.00±0.00 CFA 组 20 1.51±0.12 0.81±0.05 0.00±0.00
3 讨论
类风湿关节炎是临床上常见的慢性、多发性、系统性的慢性炎性痛疾病,TEAS是治疗RA的重要临床医疗手段之一。通过贴于特定穴位的电极片,TEAS能将不同频率和强度的脉冲电流作用于人体,产生与针刺穴位类似的效应,诱导中枢神经系统分泌镇痛物质,以达到更好的治疗效果[19]。研究发现,足三里穴电针治疗可以减轻大鼠关节炎的足跖肿胀度,提高痛阈,降低关节滑膜细胞培养上清中PGE2的表达水平[20]。也有研究提出,电针足三里穴可以通过调节 p-ERK1/2表达,提升大鼠的痛阈[21]。同时,足三里和昆仑穴配伍进行电针治疗可以减轻由弗氏佐剂引起的慢性炎性痛,并且具有良好的治疗作用[22]。本研究选取具有舒筋活络、益气养血、扶正祛邪作用的足三里穴为治疗主穴,同时选配具有通利关节、舒筋活络止痛作用的昆仑穴进行治疗。结果显示TEAS组热痛阈、关节炎症指数和足跖肿胀度较CFA组改善显著,表明TEAS对RA有较好的镇痛治疗效果。
虽然TEAS的抗炎镇痛效应非常明确,但其机理研究主要局限于对炎性细胞因子等炎症介质的调节上[23-24]。本研究结果也显示TEAS组IL-6和TNF-α免疫炎性因子表达水平较CFA组显著降低,表明TEAS对RA有良好的抗炎治疗作用,且疗效类似传统的非甾体类抗炎镇痛药,但在降低局部炎症组织的PGE2、IL-1β炎性因子水平方面,TEAS作用不如抗炎镇痛药[25-27]。因此,TEAS治疗RA可能还存在其他的调节途径。
现代医学研究表明,疼痛感的调节具有复杂的外周机制,其中阿片肽在外周镇痛中起主要作用[27-28]。TEAS可使脑和脊髓释放脑啡肽、内啡肽,使脊髓释放强啡肽,同时降低中枢神经元细胞的敏感性,抑制伤害性传入神经兴奋、提高痛阈、改变下行抑制系统核团的活性,联合调控炎症疼痛,从而产生有效的镇痛效果[29-31]。研究发现,RA患者疼痛加重的同时,其血浆中β-EP表达水平会相应下降[32-33];注射β-EP可提高实验性关节炎大鼠的痛阈,而注射β-EP拮抗剂则会降低痛阈[34]。本研究结果显示,TEAS能显著上调大鼠足跖炎症组织中POMC(2.18倍)的表达水平,能显著上调外周β-EP(P<0.05)的表达水平,表明 TEAS能够选择性地激活外周阿片系统,其抗炎镇痛作用可能与外周β-EP水平的上升有关。
本研究阐明了类风湿关节炎疼痛(及其他类似慢性疼痛)的临床 TEAS治疗的部分机制(抗炎与镇痛并举)。在临床上可以更好地推广TEAS这一康复技术的应用,避免临床上常用的非甾体抗炎药导致的严重毒、副作用,弥补针刺让部分患者存在畏惧心理、不便携带、又有术后伤口感染风险的缺陷。促进类风湿关节炎患者的康复,更好地推广应用在肩周炎、慢性盆腔炎等慢性炎性痛病人的临床康复中。
