血清白介素-6与分化型甲状腺癌术后转移相关性的探讨
2021-06-23陈文新
林 禹,赖 力,陈文新*
(1.福建医科大学省立临床医学院,福建 福州350001;2.福建省立医院 核医学科,福建 福州350001;3.福建省心血管病重点实验室,福建 福州350001;4.福建省立医院 中心实验室,福建 福州350001)
甲状腺癌是内分泌系统最常见的恶性肿瘤。近十几年,随着甲状腺癌的诊断成像,尤其是超声的广泛应用,其发病率不断上升。2015年,甲状腺癌的发病率上升至我国恶性肿瘤的第10位[1]。由甲状腺乳头状癌(Papillary thyroid cancer,PTC)和甲状腺滤泡状癌(follicular thyroid cancer,FTC)组成的分化型甲状腺癌(Differentiated thyroid cancer,DTC)占甲状腺癌的85%以上。与其他恶性肿瘤相比,DTC分化良好,进展缓慢,生存率高,乳头状癌的5年净生存率接近100%[2]。虽然,DTC患者预后总体上良好,但仍有1.2%-4.2%患者进展为远处转移[3]。远处转移明显降低DTC患者的生存率,其5年生存率仅为36%[4]。因此,早期诊断DTC术后转移对改善患者的预后尤为重要。
对甲状腺全切的DTC术后患者,临床医生主要通过血清甲状腺球蛋白(Thyroglobulin,Tg)水平来评估治疗效果、监测术后转移情况及病情随访[5]。然而,血清抗甲状腺球蛋白抗体(Anti-thyroglobulin antibody,TgAb)、促甲状腺激素(Thyroid stimulating hormone,TSH)及检测方法灵敏度等诸多因素干扰Tg检测,使其检测结果失真,影响医生评估患者的病情,进而延误患者的诊疗。因此,需探寻能及时监测到DTC术后发生转移的血清学指标,以提高DTC患者的生存率。最新研究发现:血清IL-6与DTC的发生、术前转移及预后密切相关[6-8],但较少文献报道血清IL-6与DTC术后转移的关系及其诊断效能,本研究拟就上述内容进行探讨。
1 材料与方法
1.1 一般资料
DTC术后患者43例,选自2017年5月至2017年12月行131I治疗(TSH为刺激状态)的患者。女30例,男13例,年龄13-71岁,平均年龄为(39.7±13.7)岁。所有患者于131I治疗后5-7天内行治疗剂量的131I全身显像,其中17/43例(39.5%)发现转移灶。
1.2 纳入标准
同时符合以下条件者:①DTC已行甲状腺全切术;②行131I治疗及全身显像;③131I治疗前检测甲状腺相关激素,包括TSH、FT3、FT4、Tg、TgAb,且TgAb阴性,即<115 IU/mL[9](TgAb阳性时,Tg检测值失真,于以排除)。
1.3 排除标准
有其中一项病史者:①既往有除甲状腺癌外的其他恶性肿瘤病史;②有慢性感染病史或近期感染;③糖尿病;④有冠心病或既往心衰病史;⑤有免疫系统疾病;⑥有慢性过敏史或近期出现过敏的症状。
1.4 检测方法
1.4.1血清IL-6测定 使用酶联免疫吸附法(Enzyme-linked immuno sorbent assay,ELISA)检测,采用比利时DIAsource ImmunoAssays公司试剂盒,深圳雷杜生命科学股份有限公司的RT-6100全自动酶标仪进行检测。标本采集:早晨空腹抽取静脉血5 ml,分离血清,-20℃保存备用。
1.4.2血清TSH、FT3、FT4、Tg、TgAb测定 釆用电化学发光法(Electro-chemiluminescence immunoassay,ECLIA),检测仪器为Roche cobas 6000电化学发光仪,采用Roche公司配套试剂。
1.4.3131I全身显像(131I whole body scan,131I-WBS) 患者131I 治疗后 5-7 天内行治疗剂量131I-WBS,步径速度为9.2-10 cm/min,矩阵为256×1024;后行颈、胸部断层显像,6°/帧,共采集60帧,矩阵为64×64;检查仪器为GE公司的SPECT/CT Discovery 670。
1.5 统计学方法

2 结果
2.1 血清IL-6、Tg与DTC术后转移的关系
43例DTC术后患者行131I治疗及131I-WBS,131I-WBS 发现转移17例,无转移26例。转移组的血清IL-6水平为(21.56±7.72)pg/ml,无转移组IL-6水平为(17.25±5.76)pg/ml,两组总体IL-6水平存在着统计学差异(t=-2.09,P=0.04),见表1。DTC术后转移组的血清Tg水平中位数为48.87(17.73,266.45)ng/ml,无转移组Tg水平中位数为5.77(0.30,25.93)ng/ml,两组总体Tg水平存在着统计学差异(z=3.54,P<0.01)。DTC术后转移组的TSH水平为(79.13±32.64)mIU/L,无转移组的TSH水平为(80.85±59.17)mIU/L,两组总体TSH水平差异无统计学意义(t=0.109,P=0.913)。

表1 DTC术后有/无转移组的血清IL-6水平比较(pg/ml)
2.2 ROC曲线分析血清IL-6、Tg单独检测及联合检测对DTC术后转移诊断效能
血清IL-6诊断DTC术后转移的临界值为19.5 pg/ml,灵敏度为58.8%,特异度为80.8%,AUC为0.680(95%CI 0.507-0.853);Tg诊断DTC术后转移的临界值为30.2 ng/ml,灵敏度为70.6%,特异度为84.6%,AUC为0.822(95%CI 0.697-0.948);IL-6联合Tg检测诊断DTC术后转移的灵敏度为76.5%,特异度为80.8%,AUC为0.835(95%CI 0.698-0.971),见表2、图1。

表2 血清IL-6、Tg单独检测及联合检测对DTC术后转移诊断效能
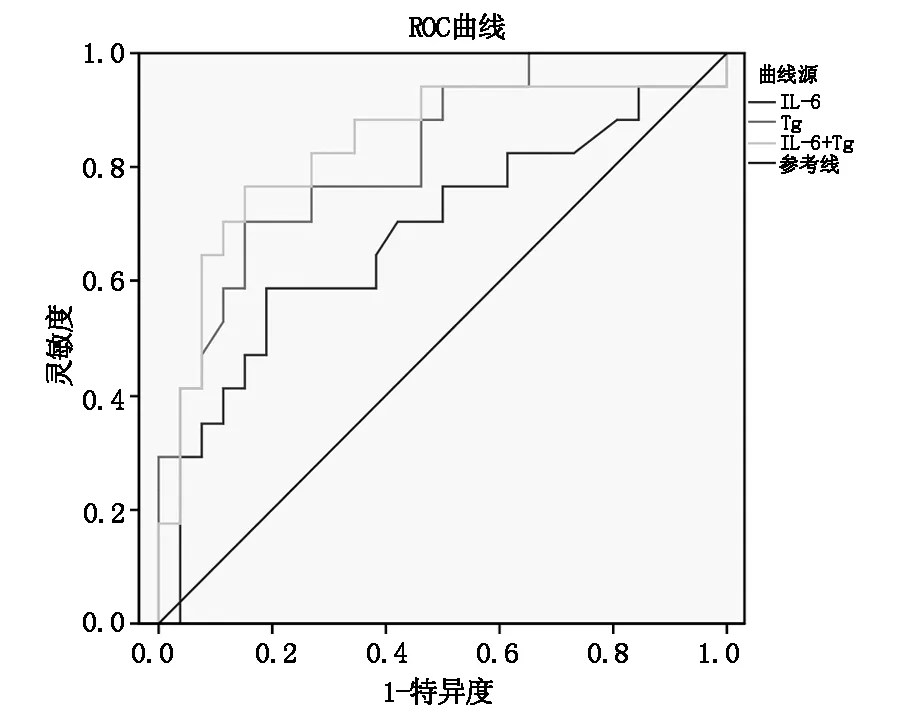
图1 IL-6、Tg单独检测及联合检测的ROC曲线
2.3 DTC术后血清IL-6与年龄、甲状腺功能相关激素不具有相关性
见表3。
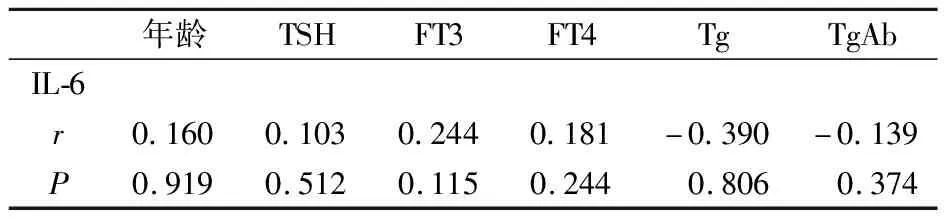
表3 DTC术后血清IL-6与年龄、甲状腺相关激素的Pearson相关性分析
3 讨论
正常人体仅有甲状腺滤泡上皮细胞可合成和分泌Tg。由于DTC细胞分化良好,也可合成和分泌Tg,故可通过检测Tg水平来反映体内DTC细胞存活的情况。对甲状腺全切的DTC术后患者,131I治疗前Tg水平显著影响其生存率[10],可以预测肿瘤存在或复发[11],对监测肿瘤转移、评估治疗效果等方面具有重要意义。然而,诸多因素影响血清Tg的检测结果,如检测时TSH、TgAb水平及检测方法的灵敏度等。其中,TgAb水平显著地影响Tg的检测[12],并且目前的检测方法无法排除该类影响[13]。根据已有的检测方法以及TgAb阳性检测结果的定义,高达25%-30%的DTC患者在确诊时TgAb即呈阳性[14]。当TgAb阳性时,Tg的检测值低于体内的真实水平,不能准确反映患者病情。因此,需寻找能早期发现DTC术后发生转移的血清学指标,以改善患者的预后。
甲状腺癌发生的具体机制目前还未完全明确。最新研究表明,肿瘤相关的炎症(如肿瘤浸润的白细胞和肿瘤内细胞因子环境)和自身免疫功能失调可能在包括甲状腺癌等多种癌症的发生中起着核心作用[15]。细胞因子,如IL-6、IL-23、IL-1β在上述两方面中都扮演着重要角色[16-17],其中IL-6具有多种的生物活性。多类细胞可分泌IL-6,如免疫细胞、角质形成细胞、骨髓基质细胞及某些肿瘤细胞等[18-19]。IL-6能够促进免疫细胞之间的交流、调节转录因子、诱导细胞的增殖、调节包括甲状腺上皮细胞在内的多种细胞生长发育[20-22]。IL-6不仅参与炎症环境的形成,而且发挥着促肿瘤效应[23]。IL-6与相关的细胞表面受体结合,激活信号转导子和转录激活子3(Signal transducer and activator of transcription 3,Stat3)信号通路,从而诱导有利于肿瘤细胞生存的基因表达及赋予肿瘤细胞抗凋亡的能力[24]。升高的血清IL-6水平与包括甲状腺癌在内的多种肿瘤的发生、肿瘤大小、转移及生存率降低明显相关[6,7,16,25]。DTC患者的术前血清IL-6水平高于甲状腺良性疾病及正常人,且在术后降至正常人水平,可辅助诊断DTC[6,7,26]。在DTC患者中,血清IL-6水平是总体生存率重要的预后因子,其水平越高,生存率越低[6]。
IL-6还可促进恶性肿瘤发生术后转移及远处器官转移。骨髓微环境中产生的IL-6可通过旁分泌及自分泌机制,促进多种恶性肿瘤患者发生骨转移。在一些特定器官(如脑、肺或肝)中过度表达的IL-6会吸引循环肿瘤细胞(circulating tumor cells,CTCs)到这些器官,并促进其成为转移瘤[27]。相对于无转移的肝癌、食管癌术后患者,发生术后转移患者的血清IL-6水平明显升高,且肝癌患者血清IL-6水平与术后复发率和转移率成正相关[28-29]。此外,肿瘤原发灶分泌的IL-6充当CTCs的“引诱剂”,使其定植于原发灶,完成 “肿瘤自身播种”,从而加速基质细胞招募、血管生成及肿瘤生长[30]。
本研究结果发现:DTC术后转移组的血清IL-6水平高于无转移组,提示血清IL-6水平升高与DTC术后转移相关,并且其不受年龄、甲状腺相关激素的影响,可作为DTC术后转移的有效辅助诊断指标。IL-6与Tg联合检测,可以提高对DTC术后转移的诊断效能。鉴于本研究为小样本研究,血清IL-6在DTC术后转移中的临床应用价值还有待后续加大样本进一步验证。
