骨肉瘤患者行大剂量甲氨蝶呤化疗后肝功能异常及与血药浓度的相关性分析
2021-06-23袁桂艳刘焕君李荣郭瑞臣
袁桂艳,刘焕君,李荣,郭瑞臣
(山东大学齐鲁医院药学部,山东 济南 250012)
骨肉瘤(osteosarcoma)是起源于间叶组织,并以能产生骨样组织的恶性梭形基质细胞为特征的恶性肿瘤,是目前全世界范围内最常见的原发性恶性骨肿瘤之一[1],好发于儿童和青少年,约70%发生在10~20岁,传统手术治疗5年生存率低,约为10%~20%[2-3],手术和化疗相结合使5年生存率提升至50%~60%[4],并能控制远处转移,增加保肢概率。目前常用大剂量甲氨蝶呤化疗,用量通常为8~12 g·m-2,但其体内代谢过程和血药浓度个体差异大,选择性差,在提高疗效的同时也增加对机体正常细胞的毒性,从而引起严重的不良反应,如骨髓抑制、肝肾损伤、胃肠道反应、黏膜损害等[5]。因此,大剂量甲氨蝶呤化疗须常规监测其血浓度,根据血药浓度数据调整用药剂量及亚叶酸钙解救次数,在保证甲氨蝶呤疗效的同时尽可能减轻其带来的严重不良反应。
有关大剂量甲氨蝶呤化疗引起的肝功能异常及其与血药浓度的相关性研究较少,且研究结果不太一致。本研究以骨肉瘤患者为研究对象,探讨大剂量甲氨蝶呤化疗后肝功能指标异常情况及其与甲氨蝶呤不同时间点血药浓度的相关性,为临床大剂量甲氨蝶呤合理应用提供依据。
1 材料与方法
1.1 临床资料 回顾性分析2018年1月~2019年12月入住我院并采用大剂量甲氨蝶呤化疗的骨肉瘤患者,化疗前肝功能指标正常者纳入,异常者排除,共纳入病例30例,男18例,女12例,平均年龄(17.48±6.4)岁,平均体重(59.72±14.93)kg。
1.2 甲氨蝶呤治疗方案及其血浓度监测 化疗前1日、化疗当日及化疗后3日进行静脉水化(2 000~2 500 mL液体)及碱化(碳酸氢钠)。化疗当日甲氨蝶呤按10 g·m-2静脉滴注给药,持续6 h。于化疗完成后6 h采用亚叶酸钙解救,剂量为0.015 g,每6 h一次,连用3日。化疗期间联合使用异甘草酸镁或复方甘草酸苷等药物保肝、帕洛诺司琼等止吐,并适当补充维生素。于化疗结束后0、24、48、72 h抽取患者静脉血,采用酶放大免疫技术(enzyme multiplied immunoassay technique,EMIT)测定甲氨蝶呤血浓度,根据其血浓度调整亚叶酸钙解救剂量。
1.3 肝功能检测及评价 化疗前3日内检测患者肝功能,化疗结束后72 h内再次检测肝功能,取第1次检测的肝功能指标用于统计学分析。根据化疗常见不良反应事件评价标准[6](CTCAE,见表1)对谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)和碱性磷酸酶(AKP)进行分级评价。因目前尚无谷氨酸脱氢酶(GLDH)、γ-谷丙酰基转肽酶(GGT)、白蛋白(ALB)的分级标准,本研究不对这3指标进行分级评价。

表1 肝功能指标异常评价标准
1.4 统计分析 采用SPSS17.0软件对肝功能指标及甲氨蝶呤血浓度进行统计学分析,计量资料采用Mean±SD表示,组间比较采用t检验。化疗后肝功能指标与甲氨蝶呤血药浓度的相关性评价采用Spearman相关性分析法。P<0.05为统计学显著性差异标准。
2 结果
2.1 化疗前后肝功能异常情况分析 52例次骨肉瘤患者化疗前后肝功能指标ALT、AST、GLDH、GGT、AKP、TBIL、ALB的均值进行配对t检验,统计分析结果见表2。结果显示,ALT、AST、GLDH化疗后的平均值明显大于正常值上限,且与化疗前比较具有统计学显著性差异(P<0.05),GGT、TBIL、ALB化疗前后平均值虽具有统计学差异(P<0.05),但数值均处于正常值范围内,不具有临床意义。AKP化疗前后平均值无统计学差异(P>0.05)。结果提示,大剂量甲氨蝶呤化疗可影响骨肉瘤患者肝功能,表现为ALT、AST和GLDH水平显著升高。

表2 化疗前后肝功能指标的统计学分析
2.2 化疗后肝功能异常发生率 大剂量甲氨蝶呤化疗后,40例次ALT异常升高,发生率为76.92%,37例次AST升高,发生率为71.15%,5例次TBIL升高,发生率为9.62%,38例次GLDH升高,发生率为73.08%,12例GGT升高,发生率为23.08%,5例ALB轻度降低,但均大于30 g·L-1,发生率为9.62%。AKP未见异常病例出现。如将上述肝功能指标任意一项异常者定义为肝功能异常,则有44例次发生肝功能异常,总发生率为84.62%,有23例次发生Ⅱ级及Ⅱ级以上肝功能异常,发生率为44.23%,结果见表3。
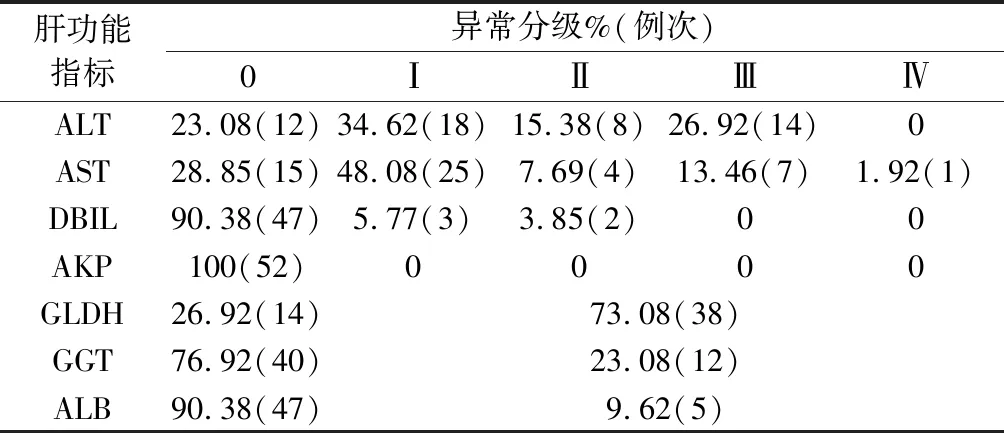
表3 化疗后肝功能各指标异常率
2.3 化疗后甲氨蝶呤血药浓度 大剂量甲氨蝶呤化疗后0、24、48和72 h其血浓度均值分别为(812.38±257.12)μmol·L-1、(7.09±7.00) μmol·L-1、(0.36±0.63)μmol·L-1、(0.14±0.06) μmol·L-1,个体间差异明显,尤0 h和24 h。临床实践中甲氨蝶呤血浓度安全范围设定为24 h,≤10 μmol·L-1,48 h,≤1 μmol·L-1,72 h,≤0.1 μmol·L-1,而将0 h血浓度≥700 μmol·L-1定义为有效浓度范围。根据上述标准,52例次骨肉瘤患者达到有效浓度范围的比例为61.54%(32/52),24 h超过中毒浓度的比例为21.15%(11/52),48 h未有病例超过中毒浓度,而72 h有缺失数据,收集到38例次数据,超过中毒浓度的比例为71.05%(27/38)。
大剂量甲氨蝶呤化疗后ALT、AST和GLDH正常组和异常组平均血药浓度见表4。由表中结果可知,ALT、AST正常组和异常组甲氨蝶呤0 h和24 h平均血浓度均具有显著性统计学差异(P<0.05),GLDH正常组和异常组甲氨蝶呤0h平均血浓度差异不具有统计学意义(P>0.05),但24 h具有统计学意义(P<0.05)。此外,ALT、AST、GLDH正常组和异常组48 h和72 h血浓度统计学分析结果显示,各组均无统计学显著性差异(P>0.05)。提示,甲氨蝶呤化疗0 h和24 h的血浓度对肝功能指标ALT和AST影响较大。

表4 化疗后部分肝功能指标正常/异常组的0和24 h平均血药浓度(μmol·L-1)
2.4 肝功能异常指标与甲氨蝶呤血浓度相关性 采用Spearman相关性分析法分析肝功能异常指标ALT、AST、GLDH与0、24、48和72 h的相关性,结果见表5。从表中数据可以看出,甲氨蝶呤0 h和24 h血浓度与肝功能指标ALT、AST具有显著相关性(P<0.05),24 h血浓度与GLDH具有显著相关性(P<0.05),而48、72 h血浓度与肝功能指标不具有相关性(P>0.05),提示甲氨蝶呤0 h和24 h血浓度与化疗后肝功能指标具有显著相关性。

表5 肝功能指标与血浓度的相关性分析结果
4 讨论
甲氨蝶呤是叶酸抗代谢药物,可竞争性抑制二氢叶酸还原酶的活性,阻止二氢叶酸转变为四氢叶酸,抑制细胞内DNA的合成,发挥广谱抗肿瘤活性[7],临床主要用于治疗急性淋巴性白血病、骨肉瘤等,但通常需要常规剂量数十倍的大剂量。大剂量给药,在提高疗效的同时,也带来严重的肝肾损伤、骨髓抑制等不良反应,故化疗期间,需密切监测不同时间点甲氨蝶呤的血浓度,并据此调整亚叶酸钙剂量,以减轻或避免甲氨蝶呤引起的严重不良反应[8-9]。本研究发现,甲氨蝶呤不同时间点血浓度呈现很大的个体差异,尤以0 h和24 h血浓度差异显著,可能与患者年龄、性别、基因多态性、用药量等相关[10]。
大剂量甲氨蝶呤引起的肝毒性多为急性肝功能损伤,以ALT及AST明显升高多见,部分表现为直接胆红素升高,肝纤维化少见[11]。本研究发现,30例骨肉瘤患者使用大剂量甲氨蝶呤化疗52例次后,ALT和AST明显升高,异常发生率分别为76.92%和71.15%,肝功能总异常发生率为84.62%,这与饶晶晶等[12]的研究结果基本一致。
对大剂量甲氨蝶呤化疗后肝功能异常与不同时间点血浓度的相关性研究较少,已有研究基本分析的是与化疗后24、48和/或72 h的血药浓度的相关性,较少纳入化疗后0 h的血药浓度,且不同学者研究结果不一。有研究报道,大剂量甲氨蝶呤化疗后的肝损伤发生率与其24 h血浓度密切相关[13],另有研究认为,大剂量甲氨蝶呤化疗后48和72 h的血浓度对于预测其引起的肾损伤具有重要意义,而72 h血浓度与其肝功能重要指标ALT不具有显著相关性[14],大剂量甲氨蝶呤化疗后其24和48 h血浓度与其不良反应发生率显著相关[15],甲氨蝶呤44 h血浓度与其肝损害不具有统计学差异[16]。
本研究采用Spearman相关性分析系统评价了患者肝功能异常指标与甲氨蝶呤0、24、48和72 h血浓度的相关性,研究发现,肝功能指标异常与0和24 h血浓度具有显著相关性(P<0.05),而与48和72 h血浓度缺乏相关性(P>0.05),与部分文献报道的研究结果一致。因此,化疗期间,医师/药师应重点关注患者大剂量甲氨蝶呤化疗后0和24 h甲氨蝶呤的血浓度,有针对性地加强对患者的肝功能监护,对完善个体化精准治疗具有重要意义。
