黄化茶树新梢色素和主要生化成分含量变化特征及其相关性分析
2021-06-22刘声传林开勤陈智雄鄢东海
刘声传,魏 杰,林开勤,陈智雄,徐 霖,鄢东海*
(1 贵阳学院 生物与环境工程学院,贵阳 550005;2 贵州省农业科学院茶叶研究所,贵阳 550006)
叶色突变的黄化茶树(Camelliasinensis)具有新梢色泽特异、高氨基酸等特征,且制成的绿茶品质好[1]。高等植物(除了石竹目植物)叶片中的色素主要分为叶绿素、类胡萝卜素和花青素3大类[2]。叶绿素、类胡萝卜素属于光合色素,存在于叶绿体中,花青素属于多酚类物质,均匀分布于液泡中。叶片细胞内3大类色素的含量、比例、分布决定叶片颜色,调控叶片光合作用[3-4]。天线色素类胡萝卜素能将吸收的光能传递给叶绿素a,具有光保护和清除自由基的作用[5]。不少研究表明,花青素能过滤可见光和紫外线,减轻叶片中光氧化损伤[6-7]。高含量花青素是紫化茶树的典型特征和茶叶苦涩的主要物质。目前,一些学者研究了紫化茶树‘紫娟’的色素累积特性,发现其叶色变化与花青素含量/叶绿素含量比值显著正相关,与类胡萝卜素含量变化关系不大,花青素积累量随叶片发育先增加后减少[8-9]。王峰等[10]研究发现18个茶树品种(系)干物质含量与光合色素含量显著正相关,叶绿素含量和类胡萝卜素含量显著正相关。7月光照最强时,‘黄金芽’叶色最黄,叶绿素含量最低[11]。而氨基酸、花青素和叶绿素含量是导致绿茶品质季节间差异的主要生化因子[12]。黄化茶树不同时期,叶色变化差异大,茶叶品质、产量不稳定,限制了其优势发挥[13-14]。目前,有关黄化茶树色素积累规律与主要品质成分的相关性研究报道不多。为此,本试验以黄化茶树品种‘中黄3号’(‘ZH3’) 为试验材料、常绿品系‘苔茶15’(‘TC15’)为对照,研究不同月份‘ZH3’新梢(一芽二叶)叶绿素、类胡萝卜素、花青素和主要生化成分的含量变化,探讨这些指标间的相互关系,为揭示黄化茶树叶片色泽形成的生理生化机制及其更好开发利用提供理论支持。
1 材料和方法
1.1 供试材料
本试验于贵州省茶叶研究所湄潭资源圃(107°29′22″E,27°45′48″N,海拔778 m)进行。供试材料为黄化茶树品种‘中黄3号’(‘ZH3’)和常绿品系‘苔茶15’(‘TC15’),树龄4年,无性系,双行双株种植,大行距1.5 m,小行距40 cm,穴距33 cm。‘ZH3’和 ‘TC15’各种有1行,长10 m,紧邻。茶园管理合理,茶树生境一致,生长环境良好,长势优。分别于2019年4月12日、5月31日、7月14日、8月17日采摘一芽二叶,一部分立即液氮保存,带回实验室于-70 ℃保存备用;另一部分,及时杀青、烘干,制作烘青绿茶品质成分检测样品。
1.2 测定指标及方法
1.2.1 生化成分含量由中国茶叶研究所茶叶质量标准与检测技术研究中心分别采用国家标准GB/T 8305-2013、GB/T 8312-2013、GB/T 8313-2018和GB/T 8314-2013检测水浸出物、咖啡碱、茶多酚和游离氨基酸含量,3次重复。
1.2.2 叶绿素和类胡萝卜素含量叶绿素和类胡萝卜素含量测定参照《植物生理生化实验原理和技术方法测定》[15]方法,略作修改,3次重复。取储存于-70 ℃新梢,液氮中迅速研磨至粉末,加95%乙醇10 mL,混匀,静置5 min后过滤,用95%乙醇定容至25 mL,以95%乙醇为空白对照,在波长665 nm、649 nm和470 nm下测定吸光度A665、A665和A665,据此计算光合色素浓度和含量。
叶绿素a浓度(Ca)=13.95A665-6.88A649
叶绿素b浓度(Cb)=24.96A649-7.32A665
总叶绿素浓度(CT)=Ca+Cb
类胡萝卜素浓度(Cx,C)=(1000A470-2.05Ca-114.8Cb)/245
叶绿体色素含量(mg/g)=(C·V·N)/m·1 000,式中,C为色素含量(mg/L);V为提取液体积(mL);N为稀释倍数,m为样品质量(g)。
1.2.3 花青素含量花青素含量测定参照王静等[16]方法,略作修改,3次重复。取经液氮研磨的粉末样2.0 g,加沸水10 mL,于沸水浴中提取30 min,过滤后加冷沸水定容至50 mL。吸取2 mL供试液置于刻度试管中,加酸性乙醇溶液至5 mL,混匀,静置30 min,以酸性乙醇为空白对照,在波长535 nm下测定吸光度。
花青素质量浓度 (mg/mL)=试液与对照液吸光度差×101.83/吸取溶液量(mL) ×10[17]
花青素含量(mg/g)=花青素质量浓度×V/m,式中,V为提取液体积(mL),m为样品质量(g)。
1.3 数据统计分析
数据采用SPSS26.0软件进行单因素方差分析、Pearson相关性分析,组间多重比较采用最小显著差异法(Least-significant difference, LSD)[18]。
2 结果与分析
2.1 两种茶树叶绿素含量在不同月份的变化特征
2.1.1 叶绿素a含量图1,A显示,从4至8月份,‘ZH3’和‘TC15’叶绿素a含量均呈先下降后上升趋势,均在5月份达到最低值,在8月份达到最高值;但‘ZH3’的含量始终低于同期的‘TC15’,且变幅明显大于‘TC15’。‘ZH3’叶绿素a含量在4、5月份无显著变化,随后逐月大幅显著上升;‘TC15’叶绿素a含量在4、5、7月份均无显著变化,仅在8月份才显著增加。‘ZH3’和‘TC15’叶绿素a含量在5月份分别为0.513和0.990 mg/g,在8月份分别为1.067和1.159 mg/g。
2.1.2 叶绿素b含量由图1,B可看出,‘ZH3’和‘TC15’叶绿素b含量基本上呈现先降后升的趋势,它们分别在5和7月份达到最低值,均在8月份达到最大值;‘ZH3’和‘TC15’叶绿素b含量均在4、5月份无显著变化,但‘ZH3’分别比‘TC15’低41.9%、54.9%;在7、8月份,‘ZH3’叶绿素b含量持续显著增加,而‘TC15’先显著降低再显著升高,‘ZH3’分别比同期‘TC15’高47.5%、22.1%。‘ZH3’和‘TC15’叶绿素b含量最低值分别为0.185 mg/g(5月)和0.265 mg/g(7月),最高值(8月)分别为0.635 和0.520 mg/g。
2.1.3 总叶绿素含量由图1,C可知,两种茶树总叶绿素含量表现出与叶绿素a相似的先降低后上升的变化趋势,只是‘TC15’的最低值延迟至7月份,‘ZH3’的变化幅度更大。‘ZH3’总叶绿素含量在4、5、7月份分别比‘TC15’低42.7%、50.1%、13.5%,而在8月份略高于‘TC15’;‘ZH3’和‘TC15’总叶绿素含量最高值(8月)分别为1.701 和1.679 mg/g,最低值分别为0.698 mg/g(5月)和1.335 mg/g(7月)。
2.1.4 叶绿素a/b值‘ZH3’ 叶绿素a/b值呈先增加后递减趋势,并在5月达到最大值,‘TC15’ 叶绿素a/b值则呈先降低后上升再降低趋势,并在7月份达到最大值,两者均在8月达到最小值,且‘TC15’ 的变幅更大。‘ZH3’叶绿素a/b值在4月份与‘TC15’接近,在5月份(2.773)略高于‘TC15’(2.415),在7、8月份分别比‘TC15’低51.6%、24.7%(图1,D)。
以上结果说明两种茶树不同月份间叶绿素a、总叶绿素含量的变化趋势大体相似,但叶绿素b含量、叶绿素a/b变化趋势不一致,‘ZH3’的叶绿素a、叶绿素b、总叶绿素含量变幅更大。两种茶树的高光合活性时期不同,总体上‘ZH3’的光合效率低于‘TC15’。
2.2 两种茶树类胡萝卜素和花青素含量在不同月份的变化特征
由图2,A可知,‘ZH3’类胡萝卜素含量随着生育期呈逐渐递减趋势,而‘TC15’ 类胡萝卜素含量则呈先降后升再降变化趋势;‘TC15’ 类胡萝卜素含量各月份均高于同期‘ZH3’,并在5月份接近,在4、7、8月份差异明显;4至8月份‘ZH3’类胡萝卜素含量的变幅明显大于‘TC15’。‘ZH3’和‘TC15’ 类胡萝卜素含量最高值(4月)分别为0.194 和0.233 mg/g,最低值分别为0.075 mg/g(8月)和0.185 mg/g(5月)。
两种茶树花青素含量随着生育期均呈先上升后下降的变化趋势,且均在7月份达到最大值;除7月份外,‘ZH3’花青素含量均略高于同期‘TC15’ (图2,B)。‘ZH3’和‘TC15’ 花青素含量在4、5月份均无显著变化;在7月份显著升高至最高值(分别为1.31 和1.78 mg/g),此时期‘ZH3’花青素含量比‘TC15’低26.4%;随后,两者均显著降低至最低值,分别为0.54 和0.45 mg/g。以上结果初步表明‘ZH3’ 类胡萝卜素含量变幅更大,各时期‘TC15’的类胡萝卜素含量高于‘ZH3’,试验地8月份高温、强光抑制了茶树花青素合成。

线上同一品种(系)内不同小写字母表示月份间在0.05水平差异显著(P<0.05);下同图1 ‘ZH3’和‘TC15’新梢叶绿素a(A)、叶绿素b(B)、总叶绿素(C)含量及叶绿素a/b值(D)在不同月份的变化Different normal letters on the same line (cultivar) indicate significant difference among different months at 0.05 level (P<0.05). The same as belowFig.1 Changes of chlorophyll a (A), chlorophyll b (B), total chlorophyll (C) contents and chlorophyll a/b ratio (D) in young shoots of ‘ZH3’ and ‘TC15’ in different months

图2 不同月份‘ZH3’和‘TC15’类胡萝卜素和花青素含量变化Fig.2 Changes of carotenoids and anthocyanin contents in young shoots of ‘ZH3’ and ‘TC15’ in different months
2.3 两种茶树不同月份3种色素所占比例及其动态变化
图3显示,各月份两种茶树3种色素所占比例均表现为叶绿素>花青素>类胡萝卜素,表明两种茶树类胡萝卜素占比均较小。‘ZH3’和‘TC15’叶绿素比例均呈先降低后升高的变化趋势,并均在7月份最低(分别为43.85 %和39.99%),在8月份达到最高值(分别为73.45%和72.22%);‘ZH3’叶绿素比例在4、5、7月份差异不大,‘TC15’叶绿素比例在4、5月份差异不大。‘ZH3’ 类胡萝卜素比例呈递减趋势,‘TC15’ 类胡萝卜素比例先递减后小幅上升。两种茶树类胡萝卜素比例均在4月份最高且相近,分别达到12.06%和11.02%;‘ZH3’在8月份达到最低值3.24%,远低于同期的‘TC15’(8.43%);‘TC15’在7月份达到最低值6.68%,但仍稍高于同期的‘ZH3’(6.42%)。‘ZH3’和‘TC15’的花青素比例均随着生育期均呈先升高后大幅下降的趋势,‘ZH3’在4至5月份大幅升高,而‘TC15’ 在5至7月份大幅升高,并均在7月份达到最大值(分别为49.73%、53.33%),在8月份达到最低值(分别为23.32%、19.35%);‘ZH3’的花青素占比在4、5月份明显高于‘TC15’,在7、8月比较接近。
2.4 两种茶树品质成分含量在不同月份的变化
如表1所示,两种茶树制作的烘青绿茶水浸出物含量接近,均约为50%,且各时期之间无显著差异;‘ZH3’和‘TC15’的游离氨基酸含量随着月份均呈先降低后上升趋势,并均在4月达到最高值(分别为7.3%、3.8%),均在7月达到最低值(分别为2.6%、2.4%),且各时期均表现为‘ZH3’高于‘TC15’,尤其是‘ZH3’游离氨基酸含量在4月份比‘TC15’高92.1%;‘ZH3’的咖啡碱含量在月份间均无显著变化,‘TC15’ 咖啡碱含量在5月份显著低于其他3个月,其他月份间无显著差异;两种茶树的茶多酚含量变化趋势相似,均呈先上升后降低的趋势,并均在4月达到最低值,7月达到最高值,且在4、5、7月份间均差异显著。可见,在4至5月份,‘ZH3’的游离氨基酸含量降幅显著,而‘ZH3’ 和‘TC15’的茶多酚含量均增幅显著。

图3 不同月份‘ZH3’(A)和‘TC15’(B)新梢色素 比例的动态变化Fig.3 Dynamic changes of pigment proportion in young shoots of ‘ZH3’ (A) and ‘TC15’ (B) in different months
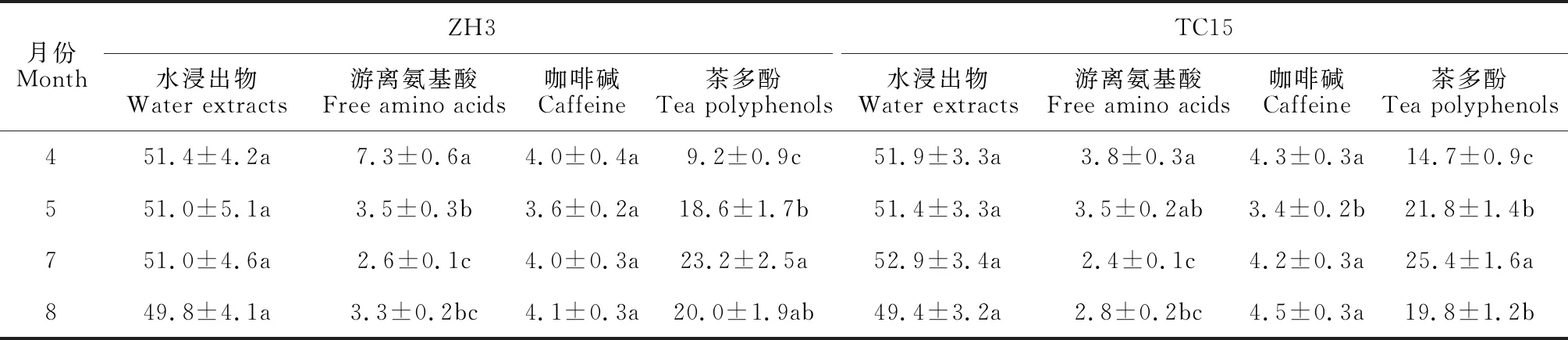
表1 不同月份‘ZH3’和‘TC15’新梢生化成分含量
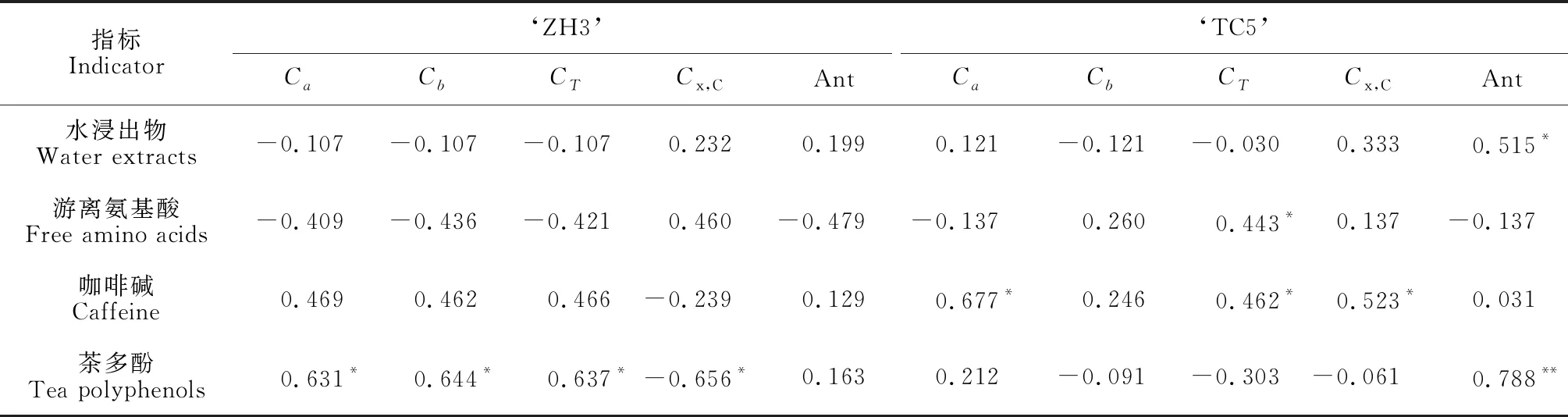
表2 ‘ZH3’和‘TC15’新梢色素含量与其主要品质成分含量的相关系数
2.5 两种茶树色素含量与其品质成分含量的相关性分析
表2显示,两种茶树的水浸出物含量与叶绿素b、总叶绿素含量负相关,与类胡萝卜素含量和花青素含量均正相关,但仅与‘TC15’的花青素含量显著正相关(r=0.515*)。‘ZH3’的游离氨基酸含量与叶绿素a、叶绿素b、总叶绿素、花青素含量均呈负相关,与类胡萝卜素含量呈正相关,但均未达到显著水平;‘TC15’ 游离氨基酸含量与叶绿素a、花青素含量负相关,与叶绿素b、类胡萝卜素含量正相关,但仅与总叶绿素含量呈显著正相关(r=0.443*)。‘ZH3’ 咖啡碱含量与叶绿素a、叶绿素b、总叶绿素、花青素含量正相关,与类胡萝卜素含量负相关,但均未达到显著水平;‘TC15’ 咖啡碱含量与叶绿素a(r=0.677*)、总叶绿素(r=0.462*)、类胡萝卜素(r=0.523*)含量均显著正相关,与叶绿素b、花青素含量均呈不显著正相关。‘ZH3’ 茶多酚含量与叶绿素a(r=0.631*)、叶绿素b(r=0.644*)、总叶绿素(r=0.637*)含量呈显著正相关,与类胡萝卜素含量显著负相关(r=-0.656*),与花青素含量呈不显著正相关;‘TC15’ 茶多酚含量与叶绿素a呈不显著正相关,与花青素含量呈显著正相关(r=0.788**),与叶绿素b、总叶绿素、类胡萝卜素含量呈不显著负相关。
3 讨 论
3.1 两种茶树新梢色素和主要生化成分的累积特征
茶树新梢中色素主要分为叶绿素、类胡萝卜素和花青素3大类。黄化品种‘ZH3’和常绿品系‘TC15’叶绿素a、总叶绿素含量在4至8月份均呈先下降再上升趋势,并在8月份达到最高,这与‘名山213 ’、‘名山131 ’和‘名山311’的叶绿素a含量表现为秋季>春季>夏季[19]的研究结果类似。两种茶树的叶绿素b含量变化趋势不同,但峰值都出现在8月份;‘ZH3’叶绿素a、叶绿素b和总叶绿素含量在4、5月份远低于‘TC15’,而其叶绿素b含量在7、8月份略高于‘TC15’,致使其叶绿素含量与‘TC15’差异减小。其原因可能是本试验点位于西南地区,夏季取样时间处于梅雨季节、持续天阴有雨,而秋季气温高、光照强。试验地气温在4、5月份不高,植物叶绿体结构发育异常,减少了叶绿素酸酯a向叶绿素b的转化,致使叶绿素b减少了光能的酸酯吸收和传递,避免引起光系统Ⅱ反应中心受破坏而降低光合功能[20];在7月下旬后,随着气温的升高,植物叶绿体结构恢复正常,叶绿素a、叶绿素b含量增加。例如,白化茶树品种‘小雪芽’ 在20 ℃和25 ℃条件下叶绿体结构发育完整,在20 ℃条件下叶绿体膜有损伤,在15 ℃条件下叶肉细胞内无成熟叶绿体[21];白榆白化芽叶绿素b合成在弱光下加快[22]。另外,叶绿素a/b值可一定程度上反映光合能力强弱,叶绿素a/b值高,光合活性和光合速率也高[22]。‘ZH3’叶绿素a/b值峰值出现在5月,而‘TC15’ 叶绿素a/b值峰值出现在7月,表明两种茶树的高光合活性时期不同。
类胡萝卜素是对叶绿素捕获光能的补充,具有保护叶绿素不被光氧化的作用[23]。黄化品种‘ZH3’类胡萝卜素含量呈递减趋势,与叶绿素b含量变化趋势总体上相反。表明4、5月‘ZH3’类胡萝卜素含量较高,对于光合产物的积累贡献较大,弥补叶绿素b含量不足。同时,常绿品系‘TC15’类胡萝卜素含量在各时期均高于‘ZH3’,而其叶绿素含量在4、5、7月均远高于‘ZH3’,仅在8月与‘ZH3’非常接近,一定程度说明各时期‘TC15’的光合效率高于‘ZH3’。
花青素具有过滤可见光和紫外线,减轻叶片受到伤害的潜力[24]。Burger等[25]研究发现在受到紫外线胁迫时,高花青素的红叶受到的伤害显著低于绿叶。本研究中茶树黄化品种‘ZH3’花青素含量在4、5、8月份略高于常绿品系‘TC15’,而在7月份比‘TC15’低26.4%,表明叶绿体突变的黄化茶树新梢更需花青素保护。两种茶树花青素含量峰值均出现在7月份,这可能与该时期环境中光照较强、温度较高有关。较强的光照和高温能诱导花青素含量增加,致使茶树芽叶变为紫红色[23]。而在8月份,‘ZH3’和‘TC15’ 花青素含量均最低,这可能是该时期温度过高所致。研究表明低温可诱导茶树中花青素生物合成相关基因表达,促使花青素含量增加,过高温则抑制基因表达,降低花青素积累[26]。
叶片呈色是各种色素综合作用的结果,正常绿色叶片中叶绿素含量高于其他色素含量,叶片呈绿色[27]。叶绿素含量降低,类胡萝卜素和花青素相对含量升高,叶片呈现黄色或者红色[28]。‘ZH3’新梢4月为黄色,5、7月变为浅粉红色,8月变为浅绿色。‘TC15’新梢4、5月为浅绿色,7月变为绿紫色,8月变为浅绿色。大部分黄色变异的茶树属于光照敏感型,新梢的黄化程度主要受光照影响,其黄化程度随光照强度的增强而增加[23,29-30]。温度敏感性的多为白化变异茶树,新梢叶色受温度主导,新梢叶色除叶脉外呈白色、奶白色或玉白,低于或超过温度范围则出现返绿现象,返绿后叶色不可逆转[23,29-30]。本研究采样时间为4、5、7、8月,环境光照强度逐渐增强,温度逐渐升高,且8月份光照最强、温度最高,而‘ZH3’的黄化程度随着月份逐渐减弱,于8月份返绿。2019年10月17日,观测采样地的‘ZH3’,其新梢变为黄色。表明‘ZH3’ 既不属于光敏感型黄化茶树品种,也不属于温度敏感性白化茶树品种。低温、低光照有利于‘ZH3’新梢黄化,表明‘ZH3’可能属于生态复合型黄化茶树品种,这有待进一步研究。
本研究中两种茶树新梢水浸出物在月份间无显著变化,品种(系)间也比较接近。‘ZH3’咖啡碱含量在月份间无显著变化,而在‘TC15’中存在显著变化。‘ZH3’ 和‘TC15’游离氨基酸含量变化分别为2.6%~7.3%、2.4%~3.8%,茶多酚含量变化分别为9.2%~23.2%、14.7%~25.4%。‘ZH3’的游离氨基酸含量在各时期均高于‘TC15’,其茶多酚含量在4、5、7月份低于‘TC15’。这再次表明,相较于常绿茶树,黄化茶树具有高氨基酸、品质成分含量变幅大的特性[13-14]。
3.2 两种茶树新梢色素含量与主要生化成分的关系
茶树新梢的色素含量、比例不仅反映光合效率的强弱,而且与成茶品质密切相关[23]。本研究表明‘ZH3’水浸出物和咖啡碱含量受色素含量影响小,而‘TC15’受影响大。‘ZH3’、‘TC15’游离氨基酸和茶多酚含量与新梢色素含量之间存在不同的、复杂的正负相关性。这些结果表明受色素影响,两种茶树新梢生化成分变化规律呈现多样性。本研究中,黄化品种‘ZH3’ 游离氨基酸含量、茶多酚含量分别与新梢类胡萝卜素含量正、负相关,表明黄化茶树新梢类胡萝卜素含量升高有助于氮代谢、抑制碳代谢。类胡萝卜素组分的差异是形成黄叶肉桂芽叶黄色表型的重要因素[31]。在一定环境条件下,黄化茶树新梢叶色黄化明显,其氨基酸含量明显升高。然而,冯琳[32]推测黄化茶树新梢类胡萝卜素合成受到抑制在代谢水平动态地促进了氨基酸合成,与本研究结果不一致。常绿品系‘TC15’游离氨基酸含量主要受叶绿素含量影响,茶多酚含量受花青素含量显著影响。氮素供应充足时,常绿茶树‘龙井43’ 叶绿素、氨基酸含量呈正相关[33]。茶树中花青素可在花青素还原酶作用下催化形成茶多酚的主要成分儿茶素[34]。一定程度解释了这一现象。其复杂的代谢网络关系有待从代谢组等组学水平进一步揭示。
综上所述,通过对不同时期黄化和常绿茶树新梢色素、主要生化成分含量测定分析,研究不同月份两种茶树新梢色素和生化成分的含量变化、积累规律及其相互关系,初步认为黄化品种‘中黄3号’新梢颜色越黄,类胡萝卜素、游离氨基酸含量越高,叶绿素、茶多酚含量越低,叶绿素a/b值较高,花青素含量适中,茶树新梢色素含量与其主要生化成分关系密切。
