山丹百合鳞茎提取液中活性物质及其对樱桃番茄的保鲜效果
2021-06-22葛蓓蕾王云霞张光弟
杨 英,张 萍,葛蓓蕾,王云霞,张光弟,靳 磊
(宁夏大学 农学院,银川 750000)
樱桃番茄(Lycopersiconesculentumvar.cerasiforme),学名圣女果,是茄科(Solanaceae)番茄属(Lycopersicum)一年生草本植物[1],常被人们称为小西红柿,既有番茄红润的外表,又有樱桃般娇小的体型,其色泽鲜艳、风味浓厚,是全国优先推广的四大水果之一[2-3]。‘碧姣’(‘Bijiao’)因其生长健壮、结果能力强,果实皮薄、肉脆、甜度高而深受生产者和消费者喜爱,是宁夏栽培面积最广,市场上最常见的樱桃番茄品种。然而樱桃番茄是呼吸跃变型果实,在生长停止到开始进入衰老期间,呼吸速率会突然升高[4],再加上采收后因微生物感染[5-6]、外界机械作用等极易导致果实变质腐烂,大大缩短了货架期,这给鲜食樱桃番茄的贮藏保鲜及运输销售等造成了困难。因此,在贮藏过程中如何选择适宜的保鲜技术,延缓浆果采后自身“衰老”与防止微生物侵染就成为一个重要问题[7]。
防腐保鲜剂主要包括化学保鲜剂以及从动植物体中提取出的天然保鲜剂[8]。目前使用最多的仍然是化学保鲜剂,能够有效延缓果实腐烂,保鲜效果相对较好,但大多化学合成物会使人体产生癌变、畸形等负面作用,严重影响身体健康,而且在环境污染方面也存在着一定的隐患,使得无毒、安全、抗菌性强的天然保鲜剂成为果蔬保鲜的首选[9-10]。山丹百合(Liliumpumilum),作为《中国药典》收录的3种百合之一,分布于宁夏、陕西、山西、山东、河南、河北、东北、青海等省区,是百合广布种之一,具有良好的适应性和抗逆性,有利于引种驯化,极具开发价值。已有研究表明,山丹百合鳞茎中含有皂甙、多糖、总酚和生物碱等活性物质[11-12],具有良好的抑菌和抗氧化活性,能有效地抑制微生物生长及延缓脂肪氧化,然而关于山丹百合鳞茎提取液的保鲜作用研究还鲜有报道。因此,本研究以山丹百合鳞茎为材料,研究其提取液在5 ℃和20 ℃下对樱桃番茄‘碧姣’果实的保鲜效果,以期为樱桃番茄的采后保鲜和百合天然保鲜剂的开发应用提供理论依据。
1 材料和方法
1.1 试验材料
樱桃番茄‘碧姣’果实于2019年7月购自宁夏银川市徐家庄,果实直径约为1~3 cm,在硬红期采收无病虫害、果形大小、硬度、色泽一致的果实,采摘后立即运回实验室进行试验。山丹百合鳞茎于2019年6月采自宁夏罗山石窑洞沟,百合鳞茎洗净后放置在-80 ℃冰箱中冷冻48 h,取出后在真空冷冻干燥机中干燥48 h后粉碎,过80目筛备用,常温下避光保存。青霉(Penicillium)是樱桃番茄采后常见的真菌病害,菌种由宁夏大学农学院方海田教授提供,用于测定山丹百合鳞茎浸提液抑菌活性。
1.2 百合鳞茎提取液的制备
称取百合干粉1 g于三角瓶中加入10 mL乙醇溶液,在80 Hz、40 ℃下超声提取30 min,之后于4 ℃离心10 min(12 000 r/min),收集上清液,连续提取2次后用于成分测定。合并上清液于30 ℃下旋转蒸发提取溶剂,浓缩后冷冻干燥成粉,用蒸馏水将干粉重新溶解,配制成浓度为0.2、0.4、0.6、0.8、1.0 g/L的提取液。
1.3 试验设计
果实保鲜试验设计7个处理:CK为空白对照(不做任何处理),CH0、CH0.2、CH0.4、CH0.6、CH0.8和CH1.0分别为浓度0、0.2、0.4、0.6、0.8和1.0 g/L的百合鳞茎提取液处理。处理时,分别将樱桃番茄果实浸泡在鳞茎提取液和蒸馏水中3 min,每个处理10个番茄果实,3次重复。果实晾干后,装入一次性餐盒中,分别置于5 ℃(每隔7 d取样测定1次)和20 ℃(每隔3 d取样测定1次)下定期取样测定果实贮藏品质,直到番茄果实出现腐烂为止。依据贮藏保鲜试验结果,选用0.8 g/L百合鳞茎提取液测定活性成分及抗氧化和抑菌活性。
1.4 百合鳞茎提取液相关指标测定
1.4.1 活性物质含量(1)总酚含量 采用福林-肖卡法测定[13]。取10 mL试管,加入鳞茎提取液0.1 mL、蒸馏水7.9 mL、福林酚试剂0.5 mL,摇匀后静置1 min,再加入1.5 mL 20%的饱和碳酸钠溶液,混匀后避光反应2 h,以提取溶剂为对照,765 nm下测吸光值,结果以每克百合鳞茎干粉中含有的没食子酸质量(mg)表示。
(2)总黄酮含量 采用NaNO2-AlCl3法测定[14]。取25 mL试管,加入1 mL鳞茎提取液、4 mL蒸馏水、0.3 mL 5%亚硝酸钠,反应5 min,再加入0.3 mL 10% 氯化铝,静置反应5 min,最后加入4 mL 1 mol/L氢氧化钠和2.4 mL蒸馏水,510 nm下吸光值,结果以每克百合鳞茎干粉中含有的芦丁质量(mg)表示。
(3)总黄烷醇含量 采用香草醛比色法测定[15]。取10 mL试管,加入1 mL鳞茎提取液,再加入5 mL香草醛溶液,混匀后反应20 min,在500 nm下测吸光值,结果以每克百合鳞茎干粉中含有的儿茶素质量(mg)表示。
(4)皂甙含量 采用香草醛-冰醋酸法测定[16]。取1 mL鳞茎提取液于具塞试管内,将提取溶剂挥干,加入0.2 mL 5%香草醛-冰醋酸溶液和0.8 mL高氯酸,置于60 ℃恒温水浴锅中显色反应15 min,取出后立即冷却5 min,加入5 mL冰醋酸,摇匀后静置10 min,544 nm下测吸光值,结果以每克百合鳞茎干粉中含有的薯蓣皂甙质量(mg)表示。
(5)多糖含量 采用硫酸-苯酚显色法测定[17]。取2 mL鳞茎提取液于10 mL容量瓶中,加入1 mL 5%苯酚试剂,摇匀后迅速加入5 mL浓硫酸,于沸水中加热15 min,取出后冷水浴冷却,加2 mL蒸馏水,490 nm下测吸光值,结果以每克百合鳞茎干粉中含有的葡萄糖质量(mg)表示。
(6)生物碱含量 采用溴甲酚绿比色法测定[18]。取3 mL鳞茎提取液于10 mL容量瓶中,加5 mL溴甲酚绿,再加氯仿10 mL,振摇3 min,静置30 min,分取氯仿层。以醋酸-醋酸钠缓冲液3 mL为对照,于414 nm下测吸光值,结果以每克百合鳞茎干粉中含有的秋水仙碱质量(mg)表示。
1.4.2 抗氧化活性DPPH自由基活性清除测定参照裘纪莹等[19]研究方法。取12.50 mg DPPH溶于乙醇中,定容至100 mL,其浓度为125 mg/L,使用之前稀释5倍,现配现用。将0.1 mL百合鳞茎提取液(浓度0.8 g/L)加到3.9 mL DPPH乙醇溶液中,避光反应30 min,在515 nm处测吸光值,结果以每克提取物中所含的水溶性维生素E(Trolox)物质的量(μmol/g)表示。
铜离子还原能力测定参照焦灏琳等[20]的方法,取0.1 mL百合鳞茎提取液(浓度0.8 g/L),依次加入硫酸铜、新铜试剂和醋酸铵缓冲液各1 mL,最后加入1 mL水,反应30 min后在450 nm下比色,结果以每克提取物中所含的水溶性维生素E(Trolox)物质的量(μmol/g)表示。
1.4.3 抑菌活性采用比浊法[11]测定抑菌活性,控制青霉菌悬液的浓度在波长600 nm处的吸光值约为1(OD600≈1.0)。称取百合鳞茎提取物0.1 g,溶于100 mL蒸馏水中,制成1 mg/mL 溶液,用 0.22 μm过滤器过滤。取50 mL三角瓶,加入PDB液体培养基20 mL,菌悬液0.1 mL,提取液0.5 mL,于28 ℃恒温培养箱培养48 h,在600 nm处测定吸光值。测定后吸取上述各培养液0.1 mL,分别涂于PDA固体培养基上,28 ℃下倒置恒温培养48 h,观察其菌落生长状态,重复3次。
1.5 樱桃番茄保鲜指标测定
1.5.1 感官指标质量损失率(%)采用称重的方法测定[21];色度采用CR-200色差仪测定[6],用色度a/b的值表示;硬度(kg/cm2)采用手持式果实硬度计测定[22]。
1.5.2 营养指标可溶性固形物(TSS)含量(%)采用日本爱拓PAL-3数显糖度计进行测定[23]。维生素C(Vc)含量(%)采用2,6-二氯靛酚滴定法测定[24]。称取番茄果肉100 g,放入组织捣碎机中,加100 mL 2%草酸,迅速捣成匀浆。称10 g浆状样品,用2%草酸将样品移入100 mL容量瓶,并稀释至刻度,摇匀过滤。取10 mL滤液置于50 mL锥形瓶中,用已标定过的2,6-二氯靛酚溶液滴定,直至溶液呈粉红色15 s不褪色为止。总酸(TA)含量(%)采用酸碱滴定法测定[25]。称取10 g樱桃番茄果肉,加水定容至100 mL,取滤液20 mL用0.1 mol/L NaOH滴定。
1.5.3 SOD活性采用NBT光还原法[26]测定。称取10 g樱桃番茄果肉,加入10 mL pH 7.8磷酸缓冲液,研磨成匀浆,离心10 min,取上清液同反应液在4 000 lx日光灯下(25 ℃)反应30 min后用黑暗终止反应,避光测吸光度值OD560,单位表示为U/g。
1.6 数据处理
利用Excel 2010和SPSS 26软件进行数据统计和方差分析,采用Origin 2018软件作图。
2 结果与分析
2.1 百合鳞茎提取液中活性物质的含量及其抗氧化、抑菌活性
图1显示,山丹百合鳞茎中的总酚、皂甙、总黄酮、生物碱、总黄烷醇、多糖活性成分含量差异显著(P<0.05)。总酚(2.41 mg/g)和生物碱(2.07 mg/g)含量相对较高,是其他活性成分含量的1.5~7.0倍,总黄烷醇含量(0.34 mg/g)最少;同时,百合鳞茎提取液具有一定的抗氧化活性;在提取液浓度为0.8 g/L时,其DPPH自由基清除力为7.1 μmol/g,铜离子还原能力为1.06 μmol/g。另外,吸光度值(OD600)与真菌量呈正相关,OD600值越大,培养液中存在的真菌数越多[27]。由图1可见,青霉菌悬液在加入0.8 g/L百合鳞茎提取液后,青霉菌悬液吸光度值(OD600)比对照组(Ⅰ和Ⅱ)显著降低74.44%~79.76%,在PDA固体培养基上的菌落生长情况显著受到抑制,从而说明百合鳞茎提取液对青霉菌具有显著的抑菌活性。
2.2 百合鳞茎提取液浓度对贮藏过程中樱桃番茄果实感官指标的影响
2.2.1 质量损失率鲜食樱桃番茄含水量一般在90%~95%,蒸腾作用严重时会加速失水,进而影响其质量的变化,因此,质量损失率是反映樱桃番茄保鲜质量的重要指标之一[28]。表1显示,在5 ℃和20 ℃贮藏条件下,樱桃番茄质量损失率在不同浓度百合鳞茎提取液处理之间均存在差异显著(P<0.05);同一时间内,质量损失率随提取液浓度的增加呈先减小后增加的趋势,并均在浓度为0.8 g/L(CH0.8)时达到最低值,且大多与同期其余处理和对照差异显著;同一浓度时,质量损失率随贮藏时间的延长而呈递增趋势。其中,在5 ℃贮藏条件下,樱桃番茄质量损失率在0.4~0.8 g/L处理(CH0.4~CH0.8)时显著低于CK,而在其余浓度处理时显著高于对照,在CH0.8处理期间较对照组显著减少了50.58%~58.82%。在20 ℃环境中,于百合鳞茎提取液处理3 d后,樱桃番茄质量损失率仅在CH0处理(喷施蒸馏水)下显著高于对照,在所有浓度提取液处理下均低于对照,且大多达到显著水平;质量损失率在CH0.2和CH0.8处理下各时期较CK分别显著下降了70%~83.78%和47.62%~70.27%。以上结果说明在低温条件下提取液浓度过低或过高都会加快樱桃番茄果实质量损失,对保鲜品质有抑制作用;在常温条件下,各浓度山丹百合鳞茎提取液均对樱桃番茄果实具有保鲜作用;在低温和常温下均以0.8 g/L山丹百合鳞茎提取液处理的质量损失最低,保鲜效果最佳。

A.活性物质含量(Tp.总酚;Sa.皂甙;Td.总黄酮;Al.生物碱;Ts.总黄烷醇;Po.多糖);B.抗氧化指标(DPPH. DPPH自由基清除力; Cu.铜离子还原能力);C.抑菌活性;D.青霉菌菌落变化图(Ⅰ.霉菌;Ⅱ.霉菌+蒸馏水;Ⅲ.霉菌+百合提取物);不同小写字母 表示指标(处理间)在0.05水平差异显著(P<0.05)图1 山丹百合鳞茎提取液活性物质含量及其抗氧化和抑菌活性A. Active substance content (Tp. Total phenol; Sa. Saponin; Td. Total flavonoid; Al. Alkaloids; Ts. Total flavanols; Po. Polysaccharide); B. Antioxidant capacity (DPPH. DPPH radical scavenging ability; Cu. Copper ions reducing power); C. Bacteriostatic activity. D. Penicillium variation (Ⅰ. Mold; Ⅱ. Mold+distilled water; Ⅲ. Mold+lily extract); The different normal letters mean significant difference among index(treatments) at 0.05 level (P<0.05)Fig.1 The main active substance content and antioxidant capacity, bacteriostatic activity of the bulb extracts from L. pumilum
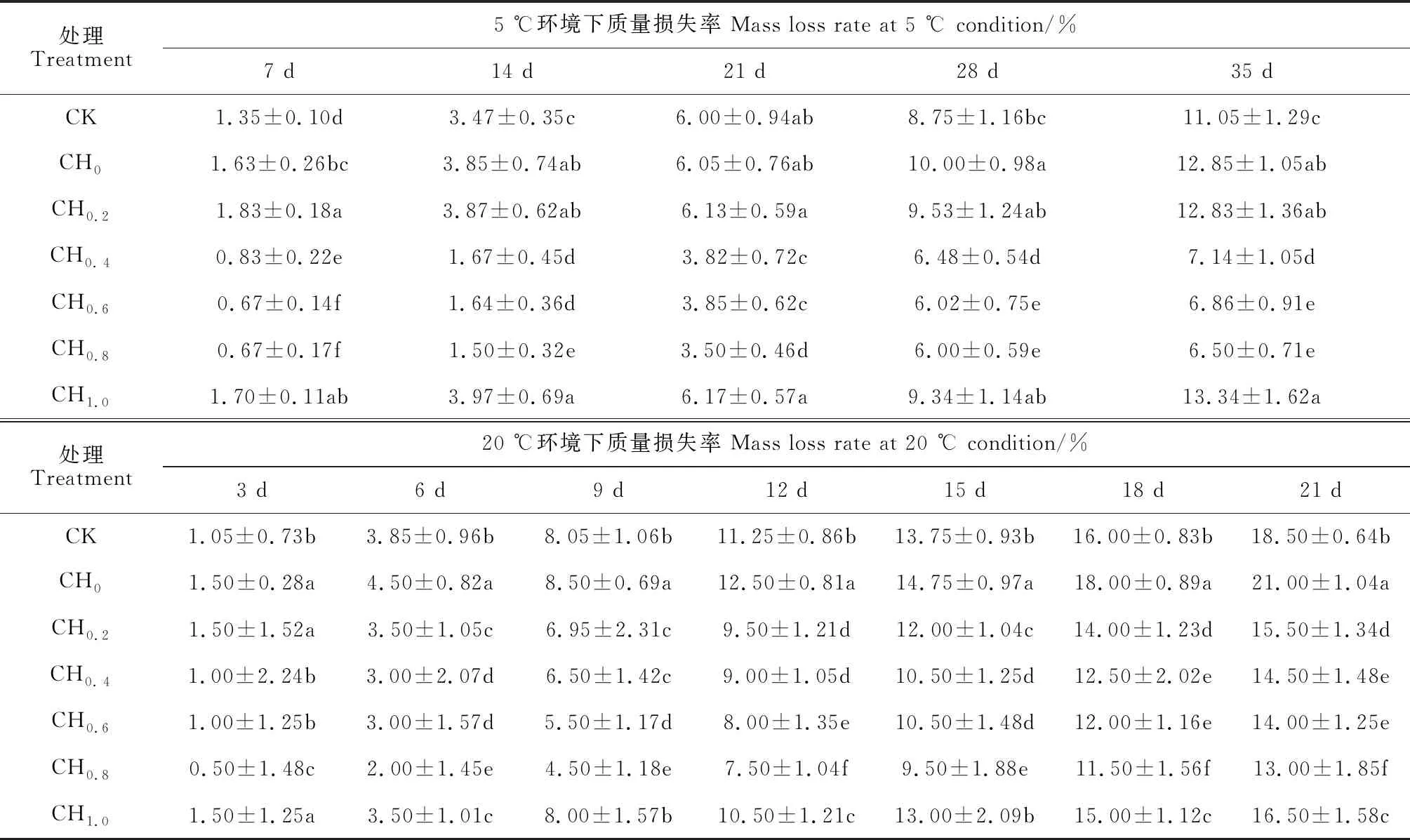
表1 不同浓度百合鳞茎提取液处理对5 ℃和20 ℃下樱桃番茄质量损失率的影响
2.2.2 硬度果实硬度是衡量果实品质和反映果实成熟、衰老的一个重要指标[29]。图2显示,在5 ℃低温和20 ℃常温条件下,樱桃番茄果实硬度在不同浓度百合鳞茎提取液间存在显著性差异(P<0.05),并随贮藏时间延长均呈缓慢下降趋势。其中,在5 ℃低温条件下,CH0.4~CH0.8处理果实硬度在整个贮藏期始终明显高于对照CK,并以CH0.8处理效果最佳,其余浓度处理均与对照相近(图2,A);在20 ℃常温条件下,除蒸馏水处理(CH0)果实硬度始终低于CK外,各浓度鳞茎提取液处理果实硬度均不同程度高于对照CK,仍以CH0.4~CH0.8处理较高,并以CH0.8处理果实硬度最高(图2,B)。可见,低温条件下适宜浓度(0.4~0.8 g/L)和常温条件下各个浓度百合鳞茎提取液均能有效抑制贮藏过程中番茄果实硬度下降,表现出明显保鲜作用,而0.8 g/L浓度处理在低温和常温条件下的处理效果均最佳。
2.2.3 色度a/b值a值表示由绿到红,正值为红色,负值为绿色[30];b值表示由蓝到黄,b值越大,黄色越强,所以a/b值的大小可以反映果实颜色的变化。图3显示,在5 ℃低温和20 ℃常温贮藏条件下,樱桃番茄果实色度a/b在不同浓度百合鳞茎提取液间存在显著性差异,并随贮藏时间延长均呈迅速增加的趋势。其中,在5 ℃贮藏过程中,CH0处理果实的色度a/b始终高于对照CK,CH0.4~CH0.8处理果实的色度a/b始终明显低于对照CK,CH0.2和CH1.0处理则在前期(0~7 d)明显低于对照,而在中后期(14~35 d)高于CK(图3,A)。说明适宜浓度(0.4~0.8 g/L)百合鳞茎提取液可以有效延缓低温贮藏过程中番茄果实颜色的变化,且以0.8 g/L处理效果最佳,而鳞茎提取液浓度过高或过低则对番茄果实无保鲜效果。同时,在整个20 ℃常温贮藏期,各浓度鳞茎提取液处理番茄果实色度a/b均不同程度低于对照组,并以CH0.8处理最低,而CH0处理却始终高于对照组(图3,B),说明不同浓度百合鳞茎提取液均可延缓常温贮藏番茄果实色度a/b的变化,且以0.8 g/L处理保鲜效果最好。
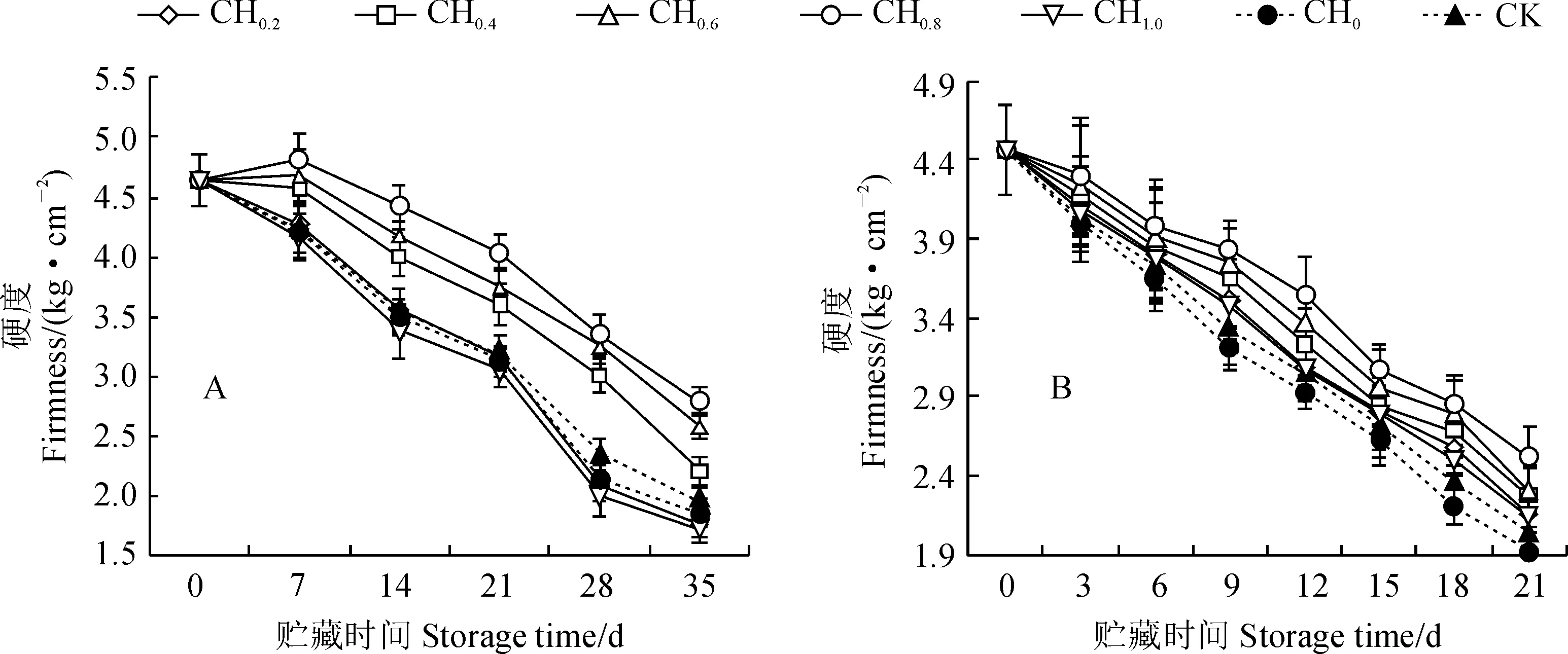
图2 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)环境下樱桃番茄果实硬度的变化Fig.2 The fruit firmness of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions
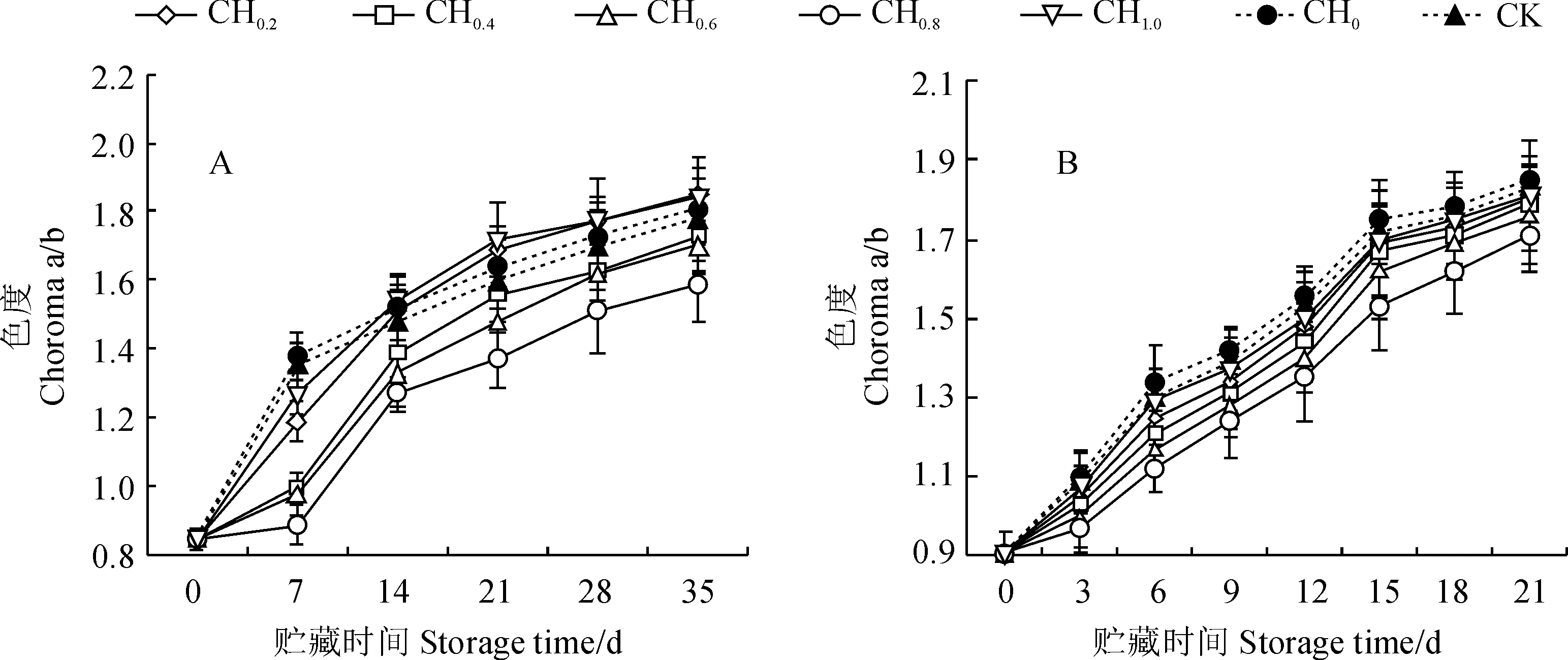
图3 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)贮藏环境下樱桃番茄色度a/b的变化Fig.3 The fruit chroma a/b of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions
2.3 百合鳞茎提取液浓度对贮藏过程中樱桃番茄果实营养指标的影响
2.3.1 Vc含量图4显示,在低温和常温贮藏过程中,各处理樱桃番茄果实Vc含量均呈现先升高后下降的变化趋势,只是各浓度处理和贮藏温度Vc含量峰值的高度、出现时间以及升降幅度、快慢存在明显差异。在贮藏前期,樱桃番茄果实Vc含量增加的原因是开始贮藏时果实尚未完全成熟,在贮藏初期樱桃番茄有后熟过程;樱桃番茄Vc含量峰值出现后,开始呈现下降趋势。其中,在5 ℃低温条件下(图4,A),CH0.4~CH0.8处理的番茄果实Vc含量在贮藏前期(7 d)均低于CK,在中后期(14~35 d)均明显高于CK,并均在14 d时达到峰值(约34.02 mg/g左右);其余处理果实Vc含量均在7 d时达到峰值(约32.35 mg/g左右),其中的CH0处理始终低于对照,CH0.2和CH1.0处理在7~21 d高于对照,但在贮藏至35 d时显著低于对照。说明适宜浓度百合鳞茎提取液可以有效降低低温贮藏番茄果实中Vc含量的下降速度,对延缓其Vc流失有一定作用,并以0.8 g/L效果最好;但鳞茎提取液浓度过高或过低则对番茄果实无保鲜效果。
同时,在20 ℃常温条件下(图4,B),CH0、CH1.0和CK处理番茄果实Vc含量在贮藏6 d时达到峰值(约32.38 mg/g左右),且CH0处理在达到峰值前高于对照,之后低于对照,CH1.0处理则表现相反;CH0.2~CH0.8处理番茄果实Vc含量均在贮藏14 d时出现峰值(约33.98 mg/g左右),并均在达到峰值前低于对照,之后明显高于对照(以CH0.8处理最高),且在贮藏21 d时均显著高于对照组。这表明不同浓度百合鳞茎提取液均可较好地保持常温贮藏条件下番茄果实中Vc含量,并以0.8 g/L处理效果最好,有效延长贮藏时间3 d。
2.3.2 可溶性固形物(TSS)含量各浓度百合鳞茎提取处理樱桃番茄TSS含量随着低温和常温贮藏时间的延长均表现出逐渐上升的趋势,但处理间的差异在低温贮藏组较大,而在常温贮藏组较小。其中,在5 ℃低温条件下(图5,A),CH0.2和CH1.0处理的番茄果实TSS含量在贮藏18 d后高于对照;CH0.4、CH0.6和CH0.8处理的TSS含量始终显著低于对照组(P<0.05),并表现为CH0.8>CH0.6>CH0.4,这表明在一定范围内(0.4~0.8 g/L),鳞茎提取液浓度越大,果实TSS含量升高得越慢,保鲜效果就越好,浓度过高或过低都会使保存效果变差。同时,在20 ℃常温条件下(图5,B),各浓度百合鳞茎提取液处理番茄果实TSS含量在整个贮藏期均显著低于同期对照(P<0.05),并表现为:CH0.8>CH0.6>CH0.4> CH0.2>CH1.0,说明各浓度百合鳞茎提取液均可以显著提高常温贮藏环境下番茄果实的保鲜效果。

图4 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)贮藏环境下樱桃番茄Vc含量的变化Fig.4 The fruit Vc content of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions
2.3.3 总酸(TA)含量在果实成熟期,有机酸作为呼吸基质,是细胞内很多生化过程所需中间代谢物的提供者[31],因此在低温和常温贮藏期间樱桃番茄的TA含量均主要呈下降趋势。在5 ℃低温条件下(图6,A),CH0处理番茄果实TA含量始终低于同期对照;CH0.2和CH1.0处理的TA含量在贮藏前中期(0~21 d)均显著高于对照,贮藏至35 d时与对照差异不显著;CH0.4~CH0.8处理TA含量在贮藏期间均显著高于对照,且以CH0.8处理的效果最佳。同时,在20 ℃常温环境下(图6,B),CH0处理番茄果实TA含量始终明显低于同期对照;CH1.0处理在贮藏前期(3~9 d)低于对照,中后期高于对照;其余各浓度处理(CH0.2~CH0.8)TA含量在贮藏期均始终显著高于对照,并以CH0.8处理TA含量最高。说明适宜浓度(0.4~0.8 g/L)百合鳞茎提取液均能显著降低5 ℃低温贮藏过程中番茄果实TA消耗,浓度过高或过低都会使保鲜效果变差;在常温贮藏条件下,各浓度百合鳞茎提取液均能明显降低番茄果实TA消耗,均表现出较好的保鲜效果;0.8 g/L处理在低温和常温贮藏期间的TA消耗均最少,保鲜效果均最佳。
2.4 百合鳞茎提取液浓度对贮藏过程中樱桃番茄果实SOD活性的影响
超氧化物歧化酶可以清除果蔬在进行旺盛有氧呼吸和叶绿体进行光合电子传递中产生的自由基和活性氧,降低膜脂的过氧化作用,减轻对果蔬细胞膜的损伤和破坏[31]。在5 ℃低温和20℃常温贮藏期间,樱桃番茄果实中SOD活性在各处理组随着处理时间延长整体有先升后降的变化趋势,低温贮藏组在14 d时达到峰值,常温贮藏组在9 d时达到峰值(图7)。不同处理的果实中SOD活性升降速度有所不同。CH0处理SOD活性在低温和常温贮藏期间均始终低于对照;在低温贮藏条件下(图7,A),各浓度处理番茄SOD活性在14 d时均显著高于对照组(P<0.05),其CH0.2和CH1.0处理在贮藏至35 d时显著低于对照,此时其余处理SOD活性均显著高于对照,并表现为CH0.8>CH0.6>CH0.4;在20 ℃常温贮藏条件下(图7,B),各浓度百合鳞茎提取液处理樱桃番茄果实SOD活性在贮藏过程中均始终显著高于对照,并表现为CH0.2>CH0.4>CH0.6>CH0.8>CH1.0,即有随着提取液升高而降低的趋势。可见,适宜浓度的百合鳞茎提取液能有效延缓低温贮藏番茄果实SOD活性的下降,而各浓度百合鳞茎提取液均可有效延缓常温贮藏过程中番茄果实SOD活性的下降,从而维持果实中活性氧产生与清除的平衡。

图5 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)贮藏环境下樱桃番茄TSS含量的变化Fig.5 The fruit soluble solids content of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions

图6 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)贮藏环境下樱桃番茄总酸含量的变化Fig.6 The fruit total acid content of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions

图7 不同浓度百合鳞茎提取液处理对5 ℃(A)和20 ℃(B)贮藏环境下樱桃番茄SOD活性的变化Fig.7 The fruit SOD activity of cherry tomato treated by different concentrations of lily bulb extracts under 5 ℃ (A) and 20 ℃ (B) storage conditions
2.5 不同浓度百合鳞茎提取液处理樱桃番茄果实的保鲜效果
图8显示,低温5 ℃贮藏至28 d时,经蒸馏水(CH0)处理的番茄果实出现腐烂现象,而经0.8 g/L(CH0.8)百合鳞茎提取液处理的番茄果实贮藏至35 d仍未出现腐烂;同时,20 ℃常温贮藏至18 d时,CH0和CK处理番茄果实分别开始出现明显腐烂和萎蔫现象,CK组贮藏至21 d时也出现腐烂现象,而CH0.8处理的番茄果实贮藏至21 d时仍未出现腐烂,保持了较好的色度。即最佳浓度(CH0.8)百合鳞茎提取液处理的樱桃番茄在20 ℃和5 ℃下分别可贮藏21 d和35 d,分别比对照组(蒸馏水CH0和不做任何处理CK)延长了3~6 d和7~14 d。这表明适宜浓度鳞茎提取液可有效延长番茄果实的贮藏时间,表现出良好的保鲜效果。
3 讨 论
本研究对樱桃番茄低温和常温贮藏过程中山丹百合鳞茎提取液的保鲜机理进行了较为系统的探讨,测定了百合鳞茎提取物中多种活性成分含量及其抗氧化能力和抑菌活性,筛选出了百合鳞茎提取液的最佳保鲜浓度,对全面了解和掌握保鲜机理,提高樱桃番茄保鲜效果起到重要作用,同时对于有针对性地加工利用山丹百合鳞茎具有重要指导意义。
首先,山丹百合鳞茎提取液中含有的总酚(2.41 mg/g)、总黄酮(1.21 mg/g)和多糖(1.60 mg/g)等活性成分被认为是植物主要的抗氧化活性物质基础,具有较高的抗氧化作用和较强的清除DPPH自由基的能力[40],且具有广谱的抗菌作用[34]。本研究结果表明,山丹百合鳞茎提取液对樱桃番茄‘碧姣’果实具有明显的保鲜作用,既可以抑制引起樱桃番茄果实腐烂的青霉菌的生长,也可以消除樱桃番茄机体中的氧自由基[35],减少其对机体细胞的生理病害,保持机体细胞活性,减缓了番茄果实的腐烂,从而保持了果实的新鲜度,这与王晓君等[40]的研究结果相似。
其次,果实质量、硬度、色度是番茄保鲜研究中常用的感官指标[37],它们可以反映番茄果实的品质、成熟衰老程度、颜色变化。本研究中,在5 ℃和20 ℃贮藏条件下,适宜浓度山丹百合鳞茎提取液可有效减缓番茄果实质量损失率,降低色度值和硬度值,使果实较长时间地保持原有色泽和品质,这是因为百合鳞茎提取液可吸附在番茄果实表面,抑制叶绿素的降解和花青素的合成,从而达到保鲜效果,这与宋姝婧等[38]的研究结果一致。同时,果实中的Vc、总酸以及可溶性固形物是重要的营养成分,决定果实的口感和风味,也是果实贮藏保鲜的重要生化指标[37]。本研究中,在5 ℃和20 ℃贮藏条件下,适宜浓度山丹百合鳞茎提取液有延缓番茄果实成熟衰老的效果,可以较好地保持番茄果实中Vc、总酸和可溶性固形物含量,这是因为百合鳞茎提取液有效降低了氧气通透性,抑制了呼吸作用及番茄果实中复杂物质的降解,从而对番茄果实起保鲜作用,这与齐馨等[29]的研究结果相似。

图8 低温(5 ℃)和常温(20 ℃)条件下不同处理樱桃番茄果实色度的变化Fig.8 Fruit color changes of cherry tomato by the different treatments under low (5 ℃) and normal (20 ℃) temperature
再次,SOD是果实内酶清除活性氧系统的重要成分,它通过清除过量的活性氧来维持活性氧平衡,是抵御活性氧毒害的第一道防线[41]。本研究结果表明,在5 ℃和20 ℃贮藏条件下,山丹百合鳞茎提取液可以有效提高番茄果实的SOD活性,对樱桃番茄‘碧姣’具有明显的保鲜作用。这主要是因为百合鳞茎提取液中富含的总酚、多糖等活性成分可以清除氧自由基,抑制膜脂过氧化作用[36],降低营养成分的消耗速率,从而提高SOD活性,有效延长了贮藏时间,达到保鲜的效果,这与廖珏等[32]的研究结果一致。
此外,在5 ℃和20 ℃条件下,0.8 g/L百合鳞茎提取液保鲜效果最佳,贮藏后期(21 d和35 d)的质量损失率比CK有效降低了1.4~1.7倍,SOD活性有效提高了29.2%~33.6%,而0.4 g/L和0.6 g/L浓度处理的效果次之,仍可延缓番茄果实色度和硬度的变化,较好地保持了番茄果实中Vc、总酸和可溶性固形物含量;然而,在5 ℃环境下,0.2 g/L和1.0 g/L处理无保鲜作用,即鳞茎提取液浓度过高或过低时都会加强樱桃番茄果实自身营养物质的损耗,这可能是因为鳞茎提取物的溶解性受到影响,从而使得鳞茎提取液浸泡后果实表面形成的膜的性质发生改变,没能很好地抑制组织与环境间的气体交换,以致于不能减缓番茄果实品质的下降,甚至加速其衰老[39]。
4 结 论
山丹百合鳞茎提取液对樱桃番茄‘碧姣’果实具有保鲜作用,能显著降低樱桃番茄果实质量损失率以及总酸、Vc和可溶性固形物含量,保持果实色度和硬度的变化,并有效提高了SOD活性,延缓果实腐烂变质。0.8 g/L山丹百合鳞茎提取液在不同温度贮藏下保鲜效果均强于其他处理,在5 ℃和20 ℃环境下将樱桃番茄果实贮藏期分别延长了7~14 d和3~6 d。本研究结果为山丹百合鳞茎提取液作为天然保鲜剂的开发奠定了理论基础。
