南瓜膳食纤维对高脂血症大鼠的降血脂作用
2021-06-22刘静宜石晓玲陈小爱周爱梅
刘静宜,石晓玲,陈小爱,汤 酿,周爱梅
(华南农业大学食品学院,广东广州510642)
高脂血症是指机体内脂肪水平异常或者代谢异常导致血液中血脂水平高于正常范围的一种症状[1]。随着生活水平的提高,高脂血症和肥胖的人群越来越多,而高脂血症是导致动脉粥样硬化和心血管疾病的重要因素之一[2-3]。临床上常使用的他汀类、贝特类等药物降脂效果虽明显,但长期使用成本昂贵且副作用大,而一些具有降血脂效用的食品及其功能成分,因其安全、毒副作用小,逐渐成为防治高脂血症领域的研究热点[4-6]。
膳食纤维通常被定义为一类无法被人体消化酶所消化也无法被小肠所吸收的碳水化合物及其类似物的总和。国内外研究[7-9]表明,膳食纤维可减少机体对食物中脂肪酸和胆固醇的吸收,起到干扰胆汁酸代谢和改善肝脏脂质代谢等作用,在降血脂方面起到积极效果。研究表明[10],每日摄入20 g膳食纤维对改善高脂患者的血脂水平有显著效果。膳食纤维按溶解度可分为可溶性膳食纤维(soluble dietary fibre,SDF)和不溶性膳食纤维(insoluble dietary fibre,IDF)。SDF可溶解于水,吸水膨胀后形成凝胶,具有一定的黏性,会增加食物的黏滞性,可起到延缓葡萄糖的吸收等作用;IDF不溶于水,可促进肠道蠕动,减少排泄物在肠道的停留,起促进排便等功能。
南瓜(Pumpkin),属葫芦科一年生草本植物,根据产地可分为中国南瓜、印度南瓜和美洲南瓜等[11]。南瓜在我国种植范围广,资源十分丰富。研究表明,南瓜富含多种氨基酸、维生素、多糖和β-胡萝卜素等生物活性物质,能够降低机体胆固醇水平,促进体内胆固醇的排出,减缓血糖的上升从而减少血脂的生成[12],具有良好的食用价值[13]。南瓜也是一种很好的膳食纤维来源,Aziah等[14]测得南瓜粉的粗纤维含量达到干基的5.27%±0.03%,但目前国内外对南瓜膳食纤维的研究多集中于提取工艺及理化特性的研究[15-18],鲜见对其降血脂作用的深入研究,尤其未见南瓜SDF和IDF降血脂作用的对比研究。基于此,本实验以酶法获得的南瓜可溶性膳食纤维和不溶性膳食纤维为原料,对比其对高血脂大鼠的降血脂作用,以期为南瓜膳食纤维的进一步开发和利用提供理论依据。
1 材料与方法
1.1 材料与仪器
雄性SD大鼠 清洁级,体重(170±10)g,购自广州中医药大学实验动物中心,动物许可证号:SYXK(粤)2014-0136;新鲜海南蜜本南瓜 购于广州市场;α-淀粉酶(枯草杆菌,49800 U/g)、碱性蛋白酶(250000 U/g)、糖化酶(110000 U/g)广州市齐云生物技术有限公司;基础饲料、复合预混饲料4312 暨南大学;总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇测定试剂盒 四川迈克公司;其他试剂 均为国产分析纯。
YP3001N型电子天平 上海精密科学仪器有限公司;PL203型万分之一天平 梅特勒-托利多仪器有限公司;DHG-9070型电热恒温鼓风干燥箱 上海齐欣科技仪器有限公司;SHZ-D(Ⅲ)循环水多用真空泵 巩义市予华仪器有限公司;MD1600型全自动生化分析仪 美国Molecular Devices公司;水浴振荡器 哈尔滨市东联电子技术开发有限公司;UV-180PC紫外分光光度计 上海美普达仪器有限公司;L-550离心机 湘仪离心机仪器有限公司;600型数显电热恒温水浴锅 金坛市维诚实验器材。
1.2 实验方法
1.2.1 酶法制备南瓜膳食纤维 取清洗、去皮去籽后的南瓜泥,按固液比1∶6的比例加入pH=6的磷酸缓冲液,以0.5%α-淀粉酶和糖化酶(1∶7)在60℃下水解90 min,100℃灭酶5 min后,再以0.7%碱性蛋白酶在50℃下水解75 min,灭酶、抽滤,将滤渣水洗至中性,60℃烘干后得到IDF;向抽滤得到的滤液中加入四倍体积的95%乙醇溶液,室温沉淀1 h后抽滤,60℃烘干滤渣,得到SDF[19]。所得南瓜IDF和SDF基本组成成分含量如表1所示。
表1 酶法提取的南瓜膳食纤维的基本成分(%)Table 1 Basic components of pumpkin dietary fiber extracted by enzymatic method(%)
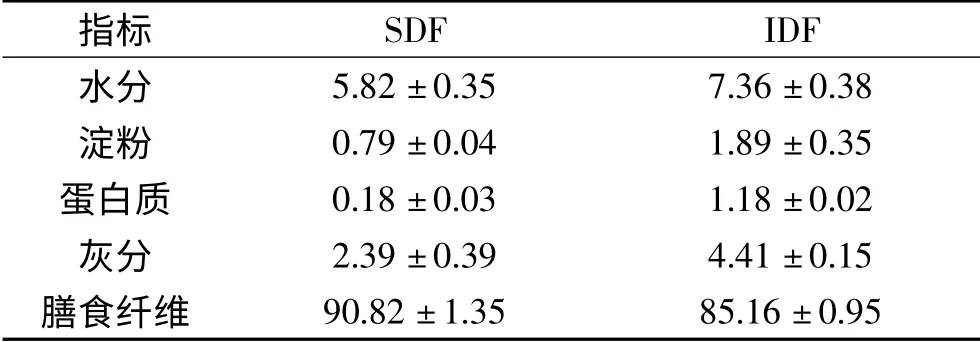
表1 酶法提取的南瓜膳食纤维的基本成分(%)Table 1 Basic components of pumpkin dietary fiber extracted by enzymatic method(%)
指标SDF IDF水分5.82±0.35 7.36±0.38淀粉 0.79±0.04 1.89±0.35蛋白质 0.18±0.03 1.18±0.02灰分 2.39±0.39 4.41±0.15膳食纤维90.82±1.35 85.16±0.95
1.2.2 饲料配制 基础饲料的配方组成如表2所示,高脂模型组以及膳食纤维组的饲料根据林德荣[20]实验方法稍作调整自行配制。
1.2.3 高血脂模型的建立 大鼠高脂模型的建立参考《保健食品检测与评价技术规范(2003版)》[21]。将80只SD雄性大鼠适应性喂养1周,随机选取10只大鼠继续给予基础饲料作为空白对照组,而其余70只给予高脂饲料作为高脂模型组。动物4~5只每笼喂养,自由饮水,自由采食,每天记录进食量,每三天称体重一次。30 d后对所有大鼠采眼眶血,测定血清TC、TG、HDL-C和LDL-C水平,模型组和空白组比较,高脂大鼠的血清中TC或TG显著升高(P<0.05),则判定模型成立。
1.2.4 实验分组及干预 将高脂模型组随机分成7组,即IDF高剂量组、IDF中剂量组、IDF低剂量组、SDF高剂量组、SDF中剂量组、SDF低剂量组和模型对照组,每组10只大鼠。各组喂食对应的饲料,为期4周。实验结束,禁食12 h后称重、收集粪便、眼眶取血。血样于4℃、3000 r/min离心10 min,分离血清后置于-80℃保存,待测定各项指标。然后麻醉大鼠并处死,进行解剖,剥离肝脏,称重[22-24]。
1.2.5 测定指标
1.2.5.1 粪便重量及粪便脂肪测定 收集大鼠禁食12 h后的粪便称取湿重,烘干后称取干重,并用索氏提取法测定粪脂含量[25]。
1.2.5.2 脏体比的测定 实验动物取血后,立即处死、称重、解剖,取肝脏,滤纸吸干称重,按照式(1)计算脏体比[26]。
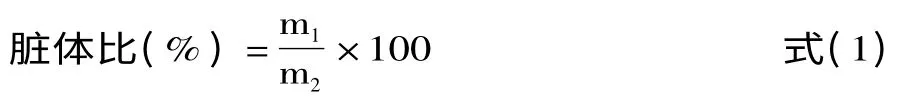
式中:m1表示大鼠肝脏重量,g;m2表示大鼠体重,g。
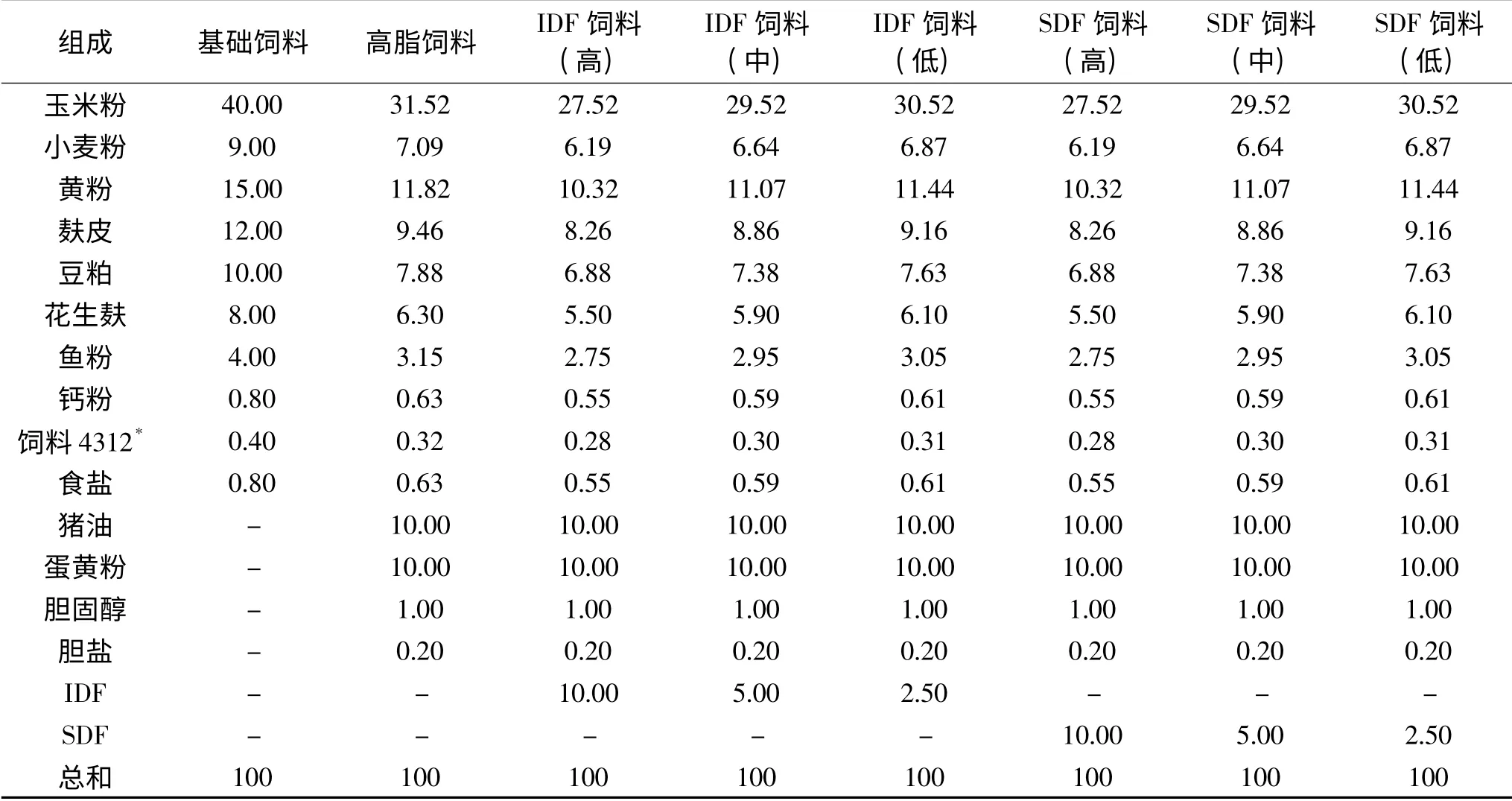
表2 各组大鼠饲料配方(%,w/w)Table 2 Feed formula for rats in each group(%,w/w)
1.2.5.3 肝脏粗脂肪含量测定 将肝脏于电热鼓风干燥箱100℃烘干至恒重,充分研碎,用滤纸包好并精确称重,置于索氏抽提器中用60℃石油醚抽提,抽提后再将滤纸包烘干精确称重[27],按照式(2)计算肝脏中的粗脂肪(Raw Fat,RF)。
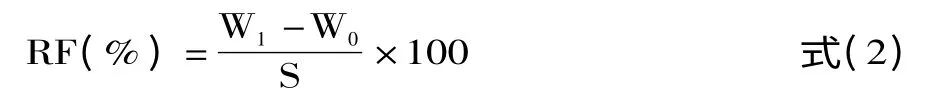
式中:W1表示抽提前滤纸包重量,g;W0表示抽提后滤纸包重量,g;S表示肝脏样品干重,g。
1.2.5.4 血脂指标的测定 参照试剂盒的操作方法,采用全自动生化分析仪测定血清中的TC、TG、LDL-C和HDL-C的水平并按照式(3)计算大鼠的动脉硬化指数(atherogenic index,AI)[28]。

1.2.5.5 肝脏病理组织学检查 取新鲜肝脏组织,在肝脏最大叶距边缘约5 mm处取小块肝组织,用生理盐水洗去浮血,滤纸吸干,进行Bouins液浸泡固定、石蜡包埋、切片和HE染色等,显微镜下观察肝组织的病理学变化情况[29]。
1.3 统计学处理
采用SPSS 17.0软件处理,实验数据以平均数±标准差表示组间差异采用t检验,P<0.05为差异显著,P<0.01为差异极显著[30]。
2 结果与分析
2.1 南瓜膳食纤维对大鼠生长指标的影响
整个实验期内各组大鼠行为活动正常,无一死亡且均未出现中毒体征。从图1可知,IDF组大鼠的摄食量相对较高,表现出更强的食欲,其中IDF中剂量组的食欲最好。而SDF高剂量组摄食量最低,低于空白对照组。由图2可得,以含膳食纤维的饲料饲养大鼠第4周时,空白对照组,SDF高、中、低剂量组,IDF高、中、低剂量组和高脂模型组的平均体重分别比建模完成时增加了27.93%、0.31%、24.92%、34.23%、35.16%、38.56%、34.50%和33.22%。除SDF高剂量组外,其余各组大鼠的体重呈稳步增长趋势,这可能是SDF的浓度过高导致饲料口感下降,降低了大鼠的食欲,从而导致体重无明显增势,这与图1中摄食量的减少相符。此外,高脂组大鼠的体重极显著低于除SDF高剂量组外的处理组(P<0.01),这可能是由于高脂饲料较软,长期饲喂不利于大鼠磨牙,而牙齿的生长导致食欲下降,这与王强等[31]的柚皮膳食纤维对高脂大鼠的体重影响结果类似。
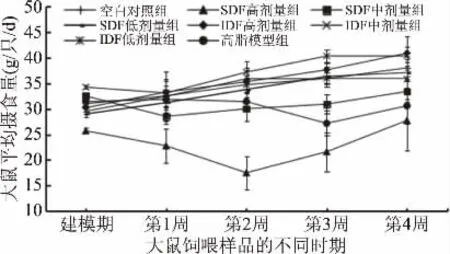
图1 各组大鼠日平均摄食量Fig.1 Average daily food intake of rats in each group
2.2 南瓜膳食纤维对大鼠粪便的影响
2.2.1 粪便外形观察 空白对照组粪便干而硬,颗粒小但规则完整;而各DF组和高脂模型组粪便湿润,尤其是SDF高剂量组粪便较湿且形状不规则。各组粪便量与高脂对照组差异显著(P<0.05),颗粒大且表面光滑。由此推论,南瓜膳食纤维能够在一定程度上促进大鼠排便,可能还增加了粪便中水分和脂肪的含量。
表3 南瓜膳食纤维对各组大鼠粪便湿重及粪脂含量的影响()Table 3 Effects of pumpkin dietary fiber on fecal weight and fat in feces of rats in each group)
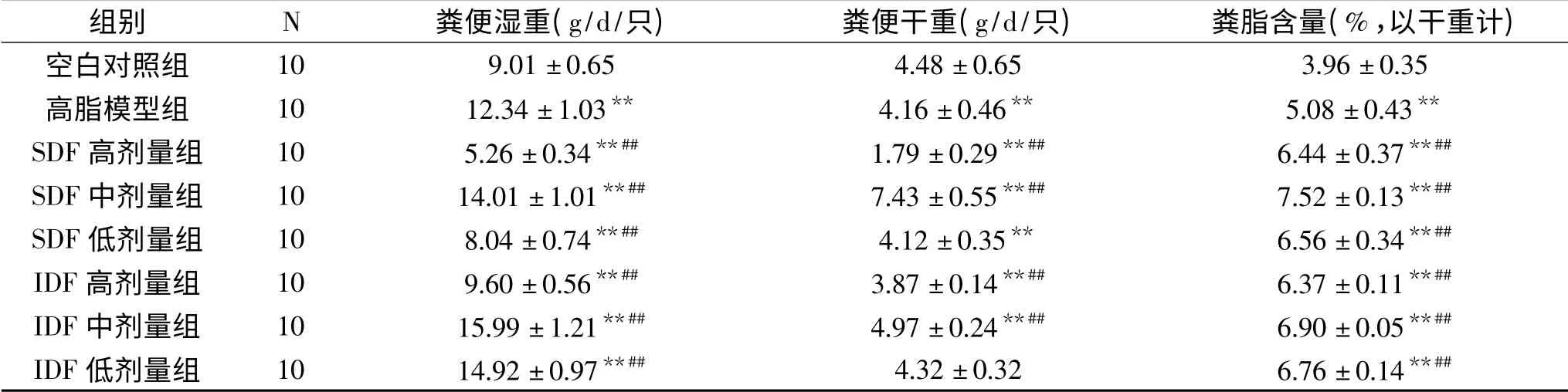
表3 南瓜膳食纤维对各组大鼠粪便湿重及粪脂含量的影响()Table 3 Effects of pumpkin dietary fiber on fecal weight and fat in feces of rats in each group)
注:**:与空白对照组相比差异极显著(P<0.01),*:与空白对照组相比差异显著(P<0.05);##:与高脂模型组相比差异极显著(P<0.01),#:与高脂模型组相比差异显著(P<0.05);表4、表6同。
组别 N 粪便湿重(g/d/只) 粪便干重(g/d/只) 粪脂含量(%,以干重计)10 9.01±0.65 4.48±0.65 3.96±0.35高脂模型组 10 12.34±1.03** 4.16±0.46** 5.08±0.43**SDF高剂量组 10 5.26±0.34**## 1.79±0.29**## 6.44±0.37**##SDF中剂量组 10 14.01±1.01**## 7.43±0.55**## 7.52±0.13**##SDF低剂量组 10 8.04±0.74**## 4.12±0.35** 6.56±0.34**##IDF高剂量组 10 9.60±0.56**## 3.87±0.14**## 6.37±0.11**##IDF中剂量组 10 15.99±1.21**## 4.97±0.24**## 6.90±0.05**##IDF低剂量组 10 14.92±0.97**## 4.32±0.32 6.76±0.14**##空白对照组

图2 各组大鼠平均体重Fig.2 Average weight of rats in each group
2.2.2 粪便湿重及粪脂含量 由表3可知,与空白组相比,IDF低剂量粪便干重组无显著差异(P>0.05),其余各组差异极显著(P<0.01);与模型组对比,各组粪便湿重差异极显著(P<0.01),SDF、IDF低剂量组粪便干重差异不显著(P>0.05),其余各组差异极显著(P<0.01);与空白组和模型组比较,膳食纤维组粪脂含量差异极显著(P<0.01,比空白、模型组高)。这一结果可能与膳食纤维良好的持水性和持油性有关,膳食纤维能够减少肠道对胆汁酸和胆固醇等物质的重吸收,促进胆固醇代谢,从而起到降血脂的效果[9]。由此推论,南瓜膳食纤维能够增加大鼠的排便量、含水量和粪脂含量,起到加快肠胃蠕动、促进排便的作用。
2.3 南瓜膳食纤维对大鼠肝脏的影响
当机体发生脂代谢紊乱时,易使肝脏脂质代谢发生障碍,导致肝脏质量增加及肝脏中脂肪堆积。由表4可知,除高脂模型组的肝体比极显著高于空白对照组外(P<0.01),其余各DF干预组的脏体比与空白对照组相比无统计学差异(P>0.05),SDF高剂量组与高脂模型组差异极显著(P<0.01),其他DF剂量组与高脂模型组差异显著(P<0.05);相对于空白组,除IDF高剂量组大鼠肝脂肪含量差异显著(P<0.05)外,其余各组均极显著(P<0.01)升高,与高脂模型组比较,除SDF低剂量组差异显著(P<0.05)外,其余各组都极显著(P<0.01)降低,说明南瓜膳食纤维可降低大鼠的脏体比,促进肝脏脂肪代谢,可通过调节机体内脂肪水平来辅助控制血脂水平。
表4 南瓜膳食纤维对大鼠肝脏重及肝脂含量的影响()Table 4 Effects of pumpkin dietary fiber on liver weight and lipid content in rats()

表4 南瓜膳食纤维对大鼠肝脏重及肝脂含量的影响()Table 4 Effects of pumpkin dietary fiber on liver weight and lipid content in rats()
组别 N 脏体比(%)肝脏脂含量(%,以干重计)10 2.87±0.37 14.59±1.65高脂模型组 10 3.38±0.15** 35.61±1.78**SDF高剂量组 10 2.98±0.15## 29.78±2.82**##SDF中剂量组 10 3.08±0.21# 24.58±0.60**##SDF低剂量组 10 3.02±0.29# 31.33±2.05**#IDF高剂量组 10 3.02±0.18# 18.52±0.73*##IDF中剂量组 10 3.01±0.16# 26.32±2.51**##IDF低剂量组 10 3.03±0.27# 27.31±0.74**##空白对照组
2.4 南瓜膳食纤维对大鼠血脂的影响
2.4.1 南瓜膳食纤维对大鼠血脂水平的影响 由表5可知,建模后各组间大鼠血清TC值无显著性差异(P>0.05)。但以复合饲料饲喂四周后,膳食纤维组TC相比建模时显著降低(P<0.05),而高脂组相比建模时极显著上升(P<0.01)。各DF组与高脂组相比差异极显著(P<0.01)。结果显示,南瓜SDF和IDF能明显降低高胆固醇血症大鼠的血清总胆固醇;IDF的效果显著好于SDF(P<0.05),且IDF的效果与剂量呈正相关;而SDF的中剂量较其他两个剂量要好。
建模后,相比空白组,高脂组血清TG水平极显著升高(P<0.01),表明高脂血症大鼠造模成功。空白对照组的血清TG值在试验过程中未发生显著变化。与此相反,高脂模型组大鼠血清TG显著上升(P<0.05)。而相比高脂组,六个试验组大鼠血清TG均极显著降低(P<0.01)。实验结束时,DF组与高脂组呈现极显著差异(P<0.01),与初始值相比,都得到极显著的降低(P<0.01)。上述试验结果说明,南瓜IDF和SDF不仅能降低高脂大鼠的血清总胆固醇,还能同时有效地降低其血清总甘油三酯。
高脂饲料对大鼠血清LDL-C水平也有明显影响,高脂组大鼠血清LDL-C水平一直呈增加趋势。到实验结束时,除SDF高、中和模型组外,其余各组与空白组均无显著差异(P>0.05),SDF高和中剂量组的血清LDL-C均显著地低于高脂模型组(P<0.05),其余各组极显著低于高脂模型组(P<0.01),其中IDF组的效果更优于SDF组,实验结束时,LDL-C水平均显著低于SDF组(P<0.05)。与初始值相比,SDF中、低剂量组和IDF各剂量组均显著下降(P<0.01,P<0.05),证明南瓜膳食纤维有降低大鼠血清LDL-C水平的功能。
表5 南瓜膳食纤维对大鼠血脂的影响(,n=10)Table 5 Effects of pumpkin dietary fiber on serum lipids of rats in each group(,n=10)
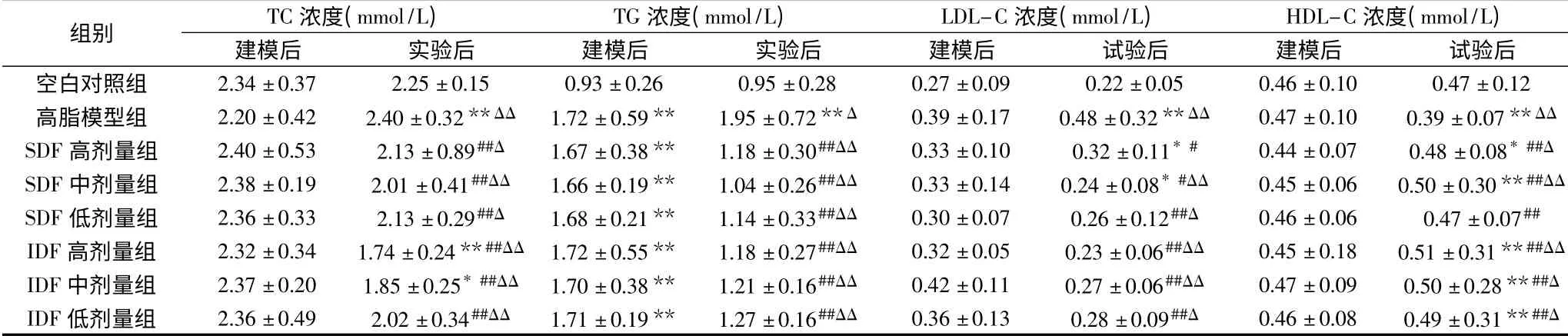
表5 南瓜膳食纤维对大鼠血脂的影响(,n=10)Table 5 Effects of pumpkin dietary fiber on serum lipids of rats in each group(,n=10)
注:**:与空白对照组相比差异极显著(P<0.01),*:与空白对照组相比差异显著(P<0.05);##:与高脂模型组相比差异极显著(P<0.01),#:与高脂模型组相比差异显著(P<0.05);ΔΔ:与建模后相比差异极显著(P<0.01);Δ:与建模后相比差异显著(P<0.05)。
组别 TC浓度(mmol/L) TG浓度(mmol/L) LDL-C浓度(mmol/L) HDL-C浓度(mmol/L)建模后 实验后 建模后 实验后 建模后 试验后 建模后 试验后空白对照组 2.34±0.37 2.25±0.15 0.93±0.26 0.95±0.28 0.2 7±0.09 0.22±0.05 0.46±0.10 0.47±0.12高脂模型组 2.20±0.42 2.40±0.32**ΔΔ 1.72±0.59** 1.95±0.72**Δ 0.39±0.17 0.48±0.32**ΔΔ 0.47±0.10 0.39±0.07**ΔΔ SDF高剂量组 2.40±0.53 2.13±0.89##Δ 1.67±0.38** 1.18±0.30##ΔΔ 0.33±0.10 0.32±0.11*# 0.44±0.07 0.48±0.08*##Δ SDF中剂量组 2.38±0.19 2.01±0.41##ΔΔ 1.66±0.19** 1.04±0.26##ΔΔ 0.33±0.14 0.24±0.08*#ΔΔ 0.45±0.06 0.50±0.30**##ΔΔ SDF低剂量组 2.36±0.33 2.13±0.29##Δ 1.68±0.21** 1.14±0.33##ΔΔ 0.30±0.07 0.26±0.12##Δ 0.46±0.06 0.47±0.07##IDF高剂量组 2.32±0.34 1.74±0.24**##ΔΔ 1.72±0.55** 1.18±0.27##ΔΔ 0.32±0.05 0.23±0.06##ΔΔ 0.45±0.18 0.51±0.31**##ΔΔ IDF中剂量组 2.37±0.20 1.85±0.25*##ΔΔ 1.70±0.38** 1.21±0.16##ΔΔ 0.42±0.11 0.27±0.06##ΔΔ 0.47±0.09 0.50±0.28**##Δ IDF低剂量组 2.36±0.49 2.02±0.34##ΔΔ 1.71±0.19** 1.27±0.16##ΔΔ 0.36±0.13 0.28±0.09##Δ 0.46±0.08 0.49±0.31**##Δ
建模后,各组间血清HDL-C无显著差异(P>0.05),而实验过程中,空白对照组血清HDL-C水平和DF各剂量组血清HDL-C水平一直呈上升趋势,高脂模型组呈下降趋势,且模型组极显著低于空白组(P<0.01)。除SDF低剂量组与空白组无显著差异(P>0.05)外,其余各组都极显著高于空白组(P<0.01,P<0.05),且各组血清HDL-C水平都极显著高于模型组(P<0.01)。上述结果表明,南瓜膳食纤维能够有效降低高脂饮食大鼠的血清TC、TG、LDL-C水平,提高血清HDL-C水平,对高脂饮食大鼠具有显著的降血脂作用。
2.4.2 南瓜膳食纤维对动脉硬化指数(AI)的影响 高血脂是引发动脉粥样硬化的重要因素之一,而动脉粥样硬化的程度和AI有密切相关性,AI的数值越大,说明动脉硬化程度越高,引发心血管疾病的可能也越大。由表6可知,高脂组大鼠的AI值极显著高于空白组(P<0.01),说明高脂大鼠的动脉硬化程度较高。除SDF低剂量组外,DF组的AI值极显著低于高脂模型组(P<0.01),除SDF低剂量组和IDF低剂量组与空白对照组差异显著外(P<0.01,P<0.05),其余各组跟空白组对比均无显著差异(P>0.05),IDF组的AI跟SDF组的比较,虽没有统计学差异(P>0.05),但IDF组的AI低于SDF组。可见,南瓜膳食纤维能够抑制大鼠AI的增加,有效减弱高脂饮食对动脉管壁的损伤,抑制动脉粥样硬化的发生与发展。
2.5 大鼠肝脏病理组织学观察
如图3所示,空白对照组大鼠的肝组织形态正常,肝脏细胞排列整齐、规则;而高脂模型组大鼠的肝组织出现了弥漫性肝细胞脂肪变性,胞浆内的脂滴多为大泡型,脂肪化程度高[32];SDF组大鼠肝脏的脂肪化程度较轻,多为小的脂肪空泡,且脂肪化程度高低排序为SDF中、SDF高、SDF低,三个剂量组均能见轻微灶状炎细胞浸润,但不及高脂模型组严重;IDF组大鼠肝脏的脂肪化程度较SDF组轻,低剂量组能见轻微灶状炎细胞浸润。病理组织学观察结果表明,长期的高脂饮食会造成大鼠脂肪肝的形成,而南瓜膳食纤维能在一定程度上延缓肝脏脂肪化,且IDF的降脂效果更为明显,这与上述实验结果中,与南瓜SDF相比,南瓜IDF能够更显著地降低高脂大鼠血清TC和LDL-C(P<0.05),南瓜IDF更能降低高脂大鼠AI值的结果一致(P>0.05)。
表6 南瓜膳食纤维对各组大鼠动脉硬化指数(AI)的影响()Table 6 Effects of pumpkin dietary fiber on AI of rats in each group()
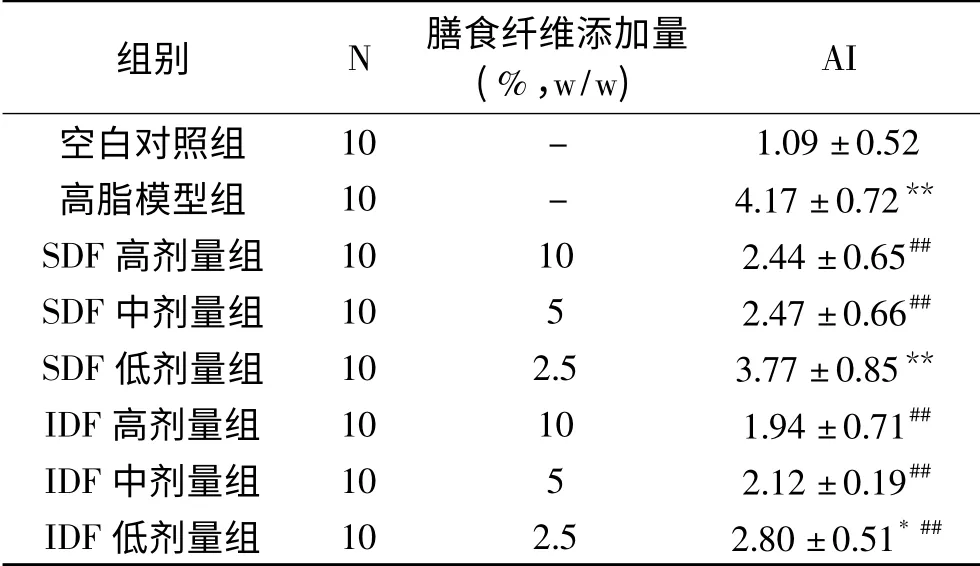
表6 南瓜膳食纤维对各组大鼠动脉硬化指数(AI)的影响()Table 6 Effects of pumpkin dietary fiber on AI of rats in each group()
组别 N 膳食纤维添加量(%,w/w)AI空白对照组10 - 1.09±0.52高脂模型组 10 - 4.17±0.72**SDF高剂量组 10 10 2.44±0.65##SDF中剂量组 10 5 2.47±0.66##SDF低剂量组 10 2.5 3.77±0.85**IDF高剂量组 10 10 1.94±0.71##IDF中剂量组 10 5 2.12±0.19##IDF低剂量组 10 2.5 2.80±0.51*##
3 结论
本研究以酶法提取的南瓜膳食纤维为原料,通过饲喂高脂饲料的方法建立高脂血症大鼠模型,发现南瓜IDF、SDF能增加大鼠的排便量、粪便的含水量及粪脂含量。各DF干预组脏体比要比高脂组小,肝脏脂肪含量也显著降低(P<0.05)。同时能显著降低大鼠血清中总胆固醇(TC)、总甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)水平,能升高血清中高密度脂蛋白胆固醇(HDL-C)水平,且IDF降低大鼠TC和LDL-C的效果较SDF显著(P<0.05)。除SDF低剂量组外,各DF干预组的AI值极显著低于高脂组(P<0.01)。这说明,南瓜膳食纤维具有辅助降血脂、预防动脉粥样硬化风险的作用效果。肝脏病理组织学实验结果显示,南瓜DF组肝脏脂肪空泡少,肝细胞脂肪化程度低,表明南瓜膳食纤维可改善高脂血症大鼠的肝脏脂肪化程度,具一定的保肝效果。
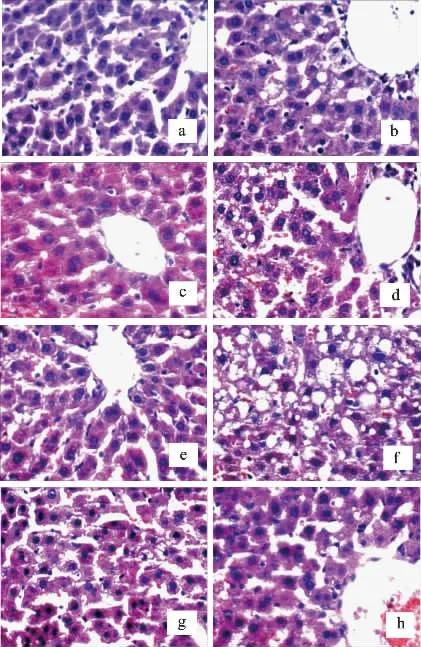
图3 不同剂量南瓜膳食纤维对大鼠肝脏组织的影响Fig.3 Effects of pumpkin dietary fiber at different doses on liver tissues of rats
本实验为南瓜膳食纤维的降血脂作用提供了基本理论依据,为其进一步开发和深加工提供了新的研究方向,但其降血脂机制和机理有待进一步研究,后续研究拟通过Western和qPCR的方法对相关的基因和蛋白表达水平进行研究,为南瓜膳食纤维在功能食品中的开发提供进一步的理论支持。
