体外消化对三文鱼皮胶原低聚肽抗氧化活性的影响
2021-06-22刘文颖张铭晧高丽辉冯晓文李国明谷瑞增
刘文颖,张铭晧,高丽辉,冯晓文,李国明,谷瑞增
(1.浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波315832;2.中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京100015;3.北京林业大学生物科学与技术学院,北京100083;4.北京农学院食品科学与工程学院,北京102206)
三文鱼皮是水产加工的副产物,除少数用于生产鱼粉、作为饲料和肥料外,大多数被丢弃,造成很大的资源浪费[1]。三文鱼皮中蛋白含量很高,其中胶原蛋白含量最高可超过其蛋白质总量的80%[2],较鱼体其它部位的胶原蛋白要高许多,并且具有安全性高,无疯牛病及口蹄疫隐患等优点[3]。三文鱼皮胶原低聚肽是以三文鱼皮为主要原料,经过酶解、分离纯化等生产的分子量在1000 u以下的小肽混合物。本中心前期研究表明,三文鱼皮胶原低聚肽中蛋白质含量很高(92.2%),必需氨基酸含量丰富(33.7%),主要为二肽、三肽(69.3%),具有抗氧化、降血压、降胆固醇、血管舒张等作用[1,3-4]。
人体内产生的自由基会引起体内脂类氧化、脑部损伤,产生黄褐斑,增加阿尔茨海默症发病率,诱发癌症等[5-7]。目前常用的抗氧化剂大多属于人工合成物,虽然有较强的抗氧化能力,但其潜在的危害使人们越来越关注安全、无毒的新型天然抗氧化剂[8]。许多研究证实,肽类物质具有较好的抗氧化活性,但其经口服进入人体后,受胃肠道中各种消化酶的作用,可能会造成生物活性的降低[9-10]。目前,关于三文鱼皮胶原低聚肽消化前后抗氧化活性的研究鲜见报道。
本研究采用胃蛋白酶和胰蛋白酶对三文鱼皮胶原低聚肽进行体外模拟消化,探讨消化前后三文鱼皮胶原低聚肽分子量的变化;通过DPPH自由基清除能力、羟自由基清除能力、总抗氧化能力(ABTS法)以及人肝星状细胞(HSC)活性氧ROS实验,考察三文鱼皮胶原低聚肽消化前后抗氧化能力的变化,为其在抗氧化功能性食品的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
三文鱼皮 北京中食海氏生物技术有限公司;胃蛋白酶(≥250 U/mg)、2',7'-二氢二氯荧光黄双乙酸钠(DCFH-DA)、偶氮二异丁脒盐酸盐(AAPH)、1,1-二苯基-2-三硝基苯肼(DPPH)、分子量标准品 美国Sigma公司;胰蛋白酶(≥250 NFU/mg) 美国Solarbio公司;乙腈(色谱纯) 美国Fisher公司产品;总抗氧化能力检测试剂盒 碧云天生物技术研究所;人肝星状细胞(HSC)上海冠导生物工程公司;DMEM培养基 Hyclon公司;胎牛血清 杭州四季青公司;其他试剂 分析纯,北京化工厂。
HF90 CO2培养箱 上海力申科学仪器有限公司;Spectra MR多功能酶标仪 美国Dynex;FACSCalibur流式细胞仪 美国BD公司;LC-20A高效液相色谱仪 日本Shimadzu公司。
1.2 实验方法
1.2.1 三文鱼皮胶原低聚肽的制备 将三文鱼皮用蒸馏水洗净,称取600 g绞碎,加入蒸馏水进行匀浆。90℃加热15 min后,降温至50℃,调节pH至8.5,以每克原料2500单位的酶量加入碱性蛋白酶,酶解2 h后,再以每克原料3000单位的酶量加入木瓜蛋白酶,继续酶解2 h。其间用0.1 mol/L的HCl或NaOH调节水解液,保持pH不变。酶解结束后在100℃沸水浴条件下灭酶,10000 r/min离心20 min,取上清液,经超滤和离子交换树脂分级分离,然后进行喷雾干燥,得到三文鱼皮胶原低聚肽干粉[11]。
1.2.2 体外模拟消化实验
1.2.2.1 体外模拟胃液消化实验 将5.0 g三文鱼皮胶原低聚肽和0.2 g NaCl溶解于去离子水中,用1.0 mol/L的HCl调节pH至2.0,37℃水浴,加入0.05 g胃蛋白酶恒温消化2 h,100℃沸水浴灭酶,冷却至室温,用1.0 mol/L NaOH溶液调节p H至7.5,定容至100 mL。空白对照采用相同处理方法,不加胃蛋白酶[12-13]。
1.2.2.2 体外模拟肠液消化实验 将5.0 g三文鱼皮胶原低聚肽和0.68 g KH2PO4溶解于去离子水中,用1.0 mol/L NaOH调节pH至7.5,37℃水浴,加入0.05 g胰蛋白酶恒温消化4 h,100℃沸水浴灭酶,冷却至室温,定容至100 mL。空白对照采用相同处理方法,不加胰蛋白酶[12-13]。
1.2.3 分子量分布测定 采用高效液相凝胶色谱法进行分子量分布分析。色谱柱:TSKgel G2000 SWXL 300 mm×7.8 mm;流动相:乙腈∶水∶三氟乙酸,45∶55∶0.1(体积比);流速:0.5 mL/min;进样体积:10μL;检测波长:220 nm;柱温:30℃。用流动相将样品浓度配制为1.0 mg/mL,经孔径0.2μm聚四氟乙烯滤膜过滤后,用高效液相色谱仪进行凝胶过滤,紫外检测器进行检测,最后通过GPC软件处理色谱数据。同时以乙氨酸-乙氨酸-乙氨酸(分子量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子量451 u)、杆菌酶(分子量1450 u)和细胞色素C(分子量12500 u)为标准品溶液,配制成0.1%(M/V)的浓度,制作分子量标准曲线[11],方程为:lgMW=6.880023-0.2122526t,R2=0.996。
1.2.4 DPPH自由基清除率测定 将不同浓度的样品溶液分别与0.1 mmol/L DPPH-无水乙醇溶液等体积比混合均匀,室温避光反应30 min,于波长517 nm处测定吸光值AX;以不同浓度的样品溶液与无水乙醇等体积混合,测得吸光值A0;以蒸馏水代替样品作为空白对照,与同体积0.1 mmol/L DPPH-无水乙醇溶液混合,测得吸光值A1[14]。
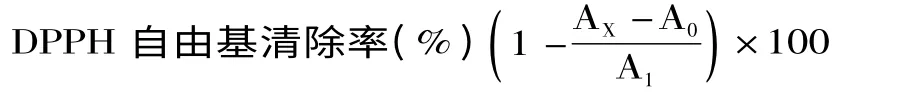
1.2.5 羟基自由基清除率测定 将不同浓度的样品溶液与5.0 mmol/L FeSO4溶液、5.0 mmol/L水杨酸-无水乙醇溶液以1∶2∶2的体积均匀混合。实验组以1体积5.0 mmol/L H2O2溶液开启反应;对照组以1体积蒸馏水开启反应;空白对照组以蒸馏水代替样品。37℃恒温孵育1 h后于510 nm处测量吸光值,实验组、对照组和空白对照组的吸光值分别记为AX、A0、A1[15]。

表1 不同处理的三文鱼皮胶原低聚肽分子量分布Table 1 Molecular weight distribution of SSCPwith different treatments
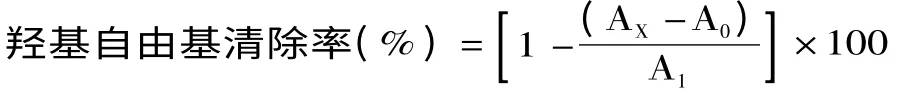
1.2.6 总抗氧化能力测定 将ABTS溶液与过硫酸钾发生反应生成墨绿色ABTS+工作液,静置12 h后备用。每个孔中加入200μL稀释35倍的工作液。向标准曲线检测孔中加入10μL 0.15、0.30、0.60、0.90、1.20、1.50 mmol/L的Trolox(水溶性维生素E)标准溶液,向样品检测孔加入样品10μL,轻轻混匀后室温孵育6 min,于734 nm处测定吸光值。最终样品的抗氧化能力以mmol/L Trolox表示[16]。
1.2.7 细胞活性氧ROS测定 将HSC细胞接入6孔板,放入37℃、5%CO2的培养箱中培养48 h。将细胞随机分为空白组对照组、模型对照组、胃(胰)蛋白酶消化组、胃(胰)蛋白酶对照组,用DMEM培养基稀释样品至400μg/mL,将1.0 mL样品加入细胞中,于37℃、5%CO2的培养箱中培养1 d后,向6孔板中加入1.0 mL DCFH-DA,37℃处理30 min,再加入1.0 mL AAPH,建立ROS诱导的HSC细胞氧化应激模型,空白对照则不加,反应20 min,用流式细胞仪测定细胞荧光值的变化[17]。
1.3 数据处理
每组数据平行测定3次,使用Origin 8.0软件处理数据。实验数据用平均值±标准偏差表示。
2 结果与分析
2.1 消化前后三文鱼皮胶原低聚肽相对分子质量分布
分子量分布分析结果表明,三文鱼皮胶原低聚肽的相对分子量主要在1000 u以下,占总比例的87%以上,大多由小于八个氨基酸的短肽组成,具有良好的水溶性、消化吸收性。三文鱼皮胶原低聚肽经胃蛋白酶和胰蛋白酶消化后,部分肽段会生成小肽和氨基酸,使得分子量变小,但从表1可知,三文鱼皮胶原低聚肽的重均分子量仅轻微减少,变化不超过4%,这表明三文鱼皮胶原低聚肽有较强的抗消化能力,小肽尤其是抗氧化性短肽基本不受蛋白酶作用的影响。
2.2 消化前后三文鱼皮胶原低聚肽的DPPH自由基清除能力
胃蛋白酶和胰蛋白酶消化前后,三文鱼皮胶原低聚肽对DPPH自由基清除能力的变化见图1。由图1可知,三文鱼皮胶原低聚肽的DPPH自由基清除能力呈量效关系,随着浓度的提高,DPPH自由基清除能力增强。未经处理的低聚肽抗氧化能力稍强于消化后的肽,胃蛋白酶消化前后,IC50值分别为11.1、12.3 mg/mL,胰蛋白酶消化前后,IC50值分别为12.5、14.6 mg/mL。因此,经模拟消化后,三文鱼皮胶原低聚肽的抗氧化性略有下降,但仍可保持较高的水平。郑婷婷等[18]通过模拟胃肠道消化对鱼鳔胶原肽的DPPH自由基清除能力进行了考察,发现鱼鳔胶原肽的抗氧化活性保持率无明显变化,具有较好的消化稳定性,与本研究结果相符。
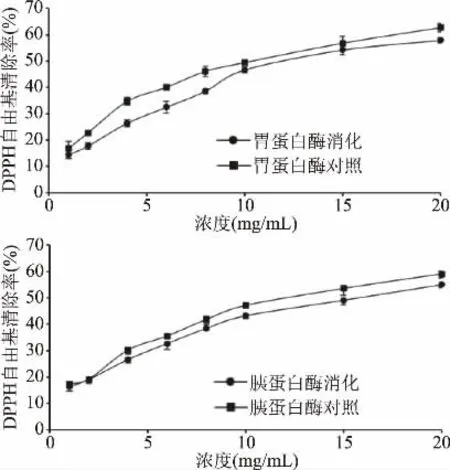
图1 不同处理的三文鱼皮胶原低聚肽对DPPH自由基清除作用Fig.1 DPPH free radical scavenging effect of SSCPwith different treatments
2.3 消化前后三文鱼皮胶原低聚肽的羟自由基清除能力
图2 显示了胃蛋白酶和胰蛋白酶消化前后三文鱼皮胶原低聚肽对羟自由基清除能力的变化。三文鱼皮胶原低聚肽的羟自由基清除能力随浓度的升高而加强。经蛋白酶消化后,低聚肽的羟自由基清除能力与未处理的基本相同,仅有轻微下降。胃蛋白酶消化前后,IC50值分别为12.2、13.2 mg/mL,胰蛋白酶消化前后,IC50值分别为10.7、11.5 mg/mL,说明三文鱼皮胶原低聚肽对羟自由基清除能力具有较好的消化稳定性。有研究考察了体外模拟消化对鱼鳔胶原肽羟自由基清除能力变化的影响,结果与本研究一致,消化酶对其羟自由基清除能力无显著性影响[19]。
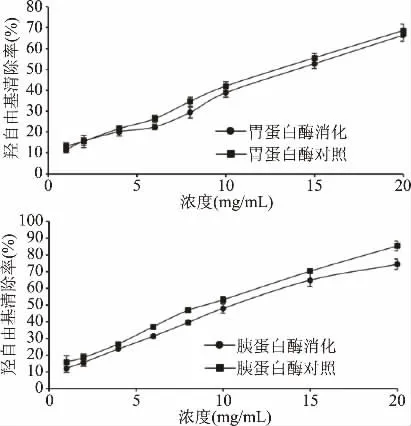
图2 不同处理的三文鱼皮胶原低聚肽对·OH清除作用Fig.2 Hydroxyl radical scavenging effect of SSCPwith different treatments
2.4 消化前后三文鱼皮胶原低聚肽的总抗氧化能力
以Trolox标准品绘制的ABTS标准曲线由图3所示,消化酶处理前后三文鱼皮胶原低聚肽的ABTS自由基抑制能力由图4所示。胃蛋白酶消化后,三文鱼皮胶原低聚肽对ABTS自由基的抑制能力下降不超过13%;胰蛋白酶消化后,对ABTS自由基的抑制能力下降不超过19%。这是由于胃、胰蛋白酶会使一些具有抗氧化活性的肽段结构被降解,导致消化产物的抗氧化活性有所降低,但是本研究中三文鱼皮胶原低聚肽仍然保留了较多的ABTS自由基抑制能力,这表明其在ABTS自由基抑制活性方面具有一定的消化稳定性。刘珊珊等[19]利用胃蛋白酶消化酪蛋白抗氧化肽,结果表明消化后对其ABTS自由基抑制能力无显著性影响,与本文结果一致。
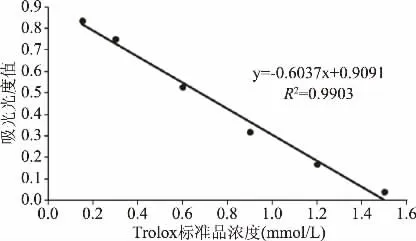
图3 ABTS标准曲线Fig.3 ABTSstandard curve
2.5 消化前后三文鱼皮胶原低聚肽对HSC中ROS清除能力
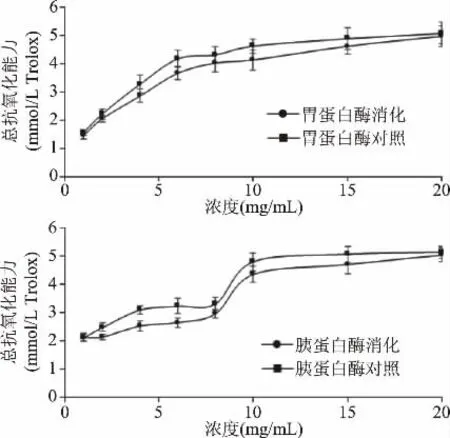
图4 不同处理的三文鱼皮胶原低聚肽的总抗氧化能力Fig.4 Total antioxidant capacity of SSCPwith different treatments
细胞荧光值越低,表明ROS清除能力越强。由图5可知,与模型对照相比,消化前后三文鱼皮胶原低聚肽均能显著地清除HSC中ROS(P<0.05)。消化前后对细胞内ROS的清除能力基本持平,胃、胰蛋白酶消化后ROS清除能力略有提高,但胃蛋白酶消化后提高不超过3%,胰蛋白酶消化后提高不超过5%,消化前后对比没有显著性差异(P>0.05)。低聚肽在消化阶段可能暴露出较多的活性基团,与活性氧发生反应的机会增加,从而增强其抗氧化能力[19-20]。由此可知,在体外模拟消化条件下,蛋白酶对三文鱼皮胶原低聚肽的ROS清除率影响并不大,消化后可较好地保持生物活性,这为该类肽作为保健食品主要功能成分的应用奠定了一定基础。
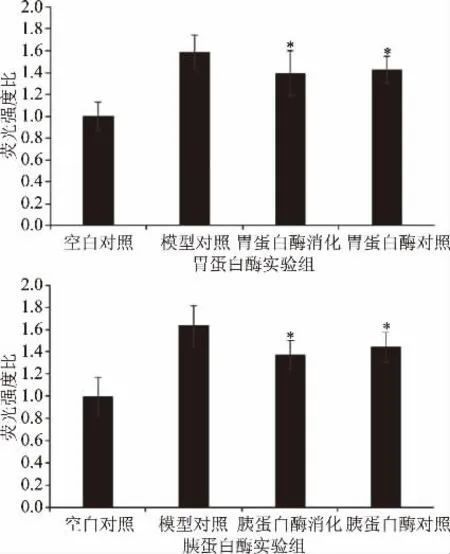
图5 不同处理的三文鱼皮胶原低聚肽对HSC中ROS清除能力的影响Fig.5 Effect of SSCPwith different treatments on ROSscavenging activity in HSC
3 结论
以三文鱼皮为原料通过两步酶解法制备三文鱼皮胶原低聚肽,通过分子量分布分析、DPPH自由基清除能力、羟自由基清除能力、总抗氧化能力以及HSC细胞ROS实验,研究了体外模拟消化对三文鱼皮胶原低聚肽抗氧化活性的影响。结果表明,经模拟消化实验后,三文鱼皮胶原低聚肽的重均分子量变化很小,不超过4%;胃蛋白酶消化前后,DPPH自由基清除能力IC50值分别为11.1、12.3 mg/mL,胰蛋白酶消化前后,IC50值分别为12.5、14.6 mg/mL;胃蛋白酶消化前后,羟自由基清除能力IC50值分别为12.2、13.2 mg/mL,胰蛋白酶消化前后,IC50值分别为10.7、11.5 mg/mL;胃蛋白酶消化前后,总抗氧化能力下降不超过13%,胰蛋白酶消化前后,总抗氧化能力下降不超过19%;胃蛋白酶消化前后,ROS清除能力提高不超过3%,胰蛋白酶消化前后,ROS清除能力提高不超过5%。本研究证实了三文鱼皮胶原低聚肽具有较强的消化稳定性和抗氧化活性,为其在天然功能性保健食品中的应用提供了思路和理论支持。
