黑果枸杞花色苷p H和氨气敏感性及其抗氧化活性
2021-06-22张美清曾繁森叶妍琦郑诗钰
张美清,曾繁森,叶妍琦,郑诗钰,李 洁,费 鹏,*
(1.闽南师范大学生物科学技术学院,福建漳州363000;2.闽南师范大学闽台特色园林植物福建省高校重点实验室,福建漳州363000)
黑果枸杞(Lycium ruthenicum)在中国西北干旱地区分布较为广泛,作为茄科(Solanceae)枸杞属(Lycium)的植物[1],其果实一般呈黑色,在成熟的浆果中含有丰富的花色苷,其种类有矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷、矮牵牛素-5-O-葡萄糖苷和飞燕草素-3-O-葡萄糖苷等八种[2]。花色苷类色素在不同p H条件下苯并吡喃氧鎓离子结构会转变成其它结构形式,酸性环境中以红色的氧鎓阳离子呈现,碱性环境中以蓝色的醌型结构呈现[3],花色苷具有较高的营养价值和良好的功效作用,当今国内外大部分专家学者已经接受并认可其抗氧化性以及防治心脑血管和预防癌症等疾病的功效[4-5]。
肉类食品中挥发性盐基氮的含量能够客观地反映其腐败程度,目前理化检验中挥发性盐基氮检测法检测准确度较高,但需要在实验室中操作,过程繁琐且耗时较长,不能高效、简便地进行检测[6],难以广泛应用于生产生活中。花色苷对于挥发性盐基氮具有良好的响应,且其颜色变化和肉类的腐败程度呈现出一定的相关性[7],因此,通过花色苷溶液颜色的变化可以直观反映肉制品的新鲜程度。
目前,对于黑枸杞中花色苷的pH敏感性、对不同浓度氨气和肉类腐败气味的响应、及其抗氧化活性等方面研究鲜见,这使黑果枸杞的功效及价值得不到充分利用,资源开发不够全面。因此,本研究采用溶剂浸提及旋转蒸发浓缩的方法,提取黑果枸杞中的花色苷。通过观测花色苷颜色在不同pH下的变化,分析其p H敏感性;不同浓度氨气及对肉类腐败气味的响应测试,探究其对腐败气体的敏感度;将VC溶液作为花色苷溶液的对照品,通过测定其羟基自由基清除率来探讨黑果枸杞花色苷的抗氧化性。全文研究结果能够为黑果枸杞资源开发利用提供一定的科学理论依据,也为其是否能应用于气敏性及抗氧化性食品包装材料的制备作为参考。
1 材料与方法
1.1 材料与仪器
黑果枸杞干 特级,宁夏;猪肉、牛肉 购于漳州市芗城区新华都超市;本文所用无水乙醇、乙酸、浓盐酸(37%)、浓氨水(28%)、柠檬酸、磷酸二氢钠、水杨酸、VC(抗坏血酸)等试剂 均为AR级,西陇科学股份有限公司。
MultiSkan Go全波长酶标仪 美国赛默飞世尔有限公司;FW 100高速万能粉碎机 天津市泰斯特仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;NICOLET IS 10傅里叶紫外分光光度计 美国赛默飞世尔有限公司。
1.2 实验方法
1.2.1 黑果枸杞花色苷的提取 将适量干燥黑果枸杞放于粉碎机中粉碎,随后过40目筛以得到颗粒适当的枸杞粉末,将其置于阴暗干燥的低温环境中保存。将同等体积的无水乙醇和2%乙酸溶液均匀混合作为提取剂,将其与黑果枸杞粉末按20∶1 mL/g加入提取瓶混合均匀,随后将其用超声振荡0.5 h,接着将浸提液放于50℃水浴锅中浸提3 h后取出进行抽滤,得到色素粗提液[8-9]。将色素粗提液放在50℃旋转蒸发仪中蒸发浓缩,最终得到花色苷浓缩液,将其保存在密封试剂瓶且放于黑暗低温环境中,备用。
1.2.2 花色苷含量测定 总花色苷含量采用pH示差法测定[10]。分别测定黑果枸杞花色苷在p H1.0盐酸-柠檬酸标准缓冲液和p H4.5柠檬酸-磷酸氢二钠标准缓冲液中于紫外分光光度计400~800 nm范围内扫描情况,可知相应的最大吸收波长和最大吸收波长处的吸光度值Amax。总花色苷含量(以矢车菊素-3-葡萄糖苷计)用以下公式计算:
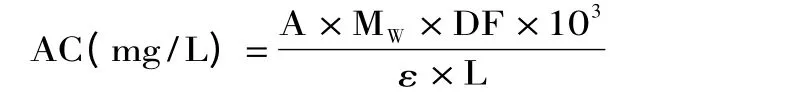
式中,吸光度值:A:(A523nm-A700nm)pH1.0-(A540nm-A700nm)pH4.5;MW:矢车菊-3-葡萄糖的分子质量(449.2 g/mol);DF:稀释因子(V/Wt=10);ε:摩尔消光系数(26900 L·mol-1·cm-1),L:光路长度(0.51995 cm)。
1.2.3 黑果枸杞花色苷对p H的响应测试 分别配制pH1.0~p H13.0的标准pH缓冲液备用;每次取1 mL花色苷溶液分别加入13支10 mL的容量瓶中,取上述pH1.0~pH13.0的缓冲液定容至10 mL,混合均匀后将其放于全波长酶标仪中作全波长扫描。测定黑果枸杞花色苷提取物的吸光度及pH敏感性。
1.2.4 黑果枸杞花色苷的智能指示
1.2.4.1 黑果枸杞花色苷对挥发氨的响应试验 配制浓度分别为0.297、0.371、0.495、0.742、1.484 mol/L浓度的氨水溶液;取25 mL花色苷溶于100 mL容量瓶,用水定容,混合均匀备用;依次取上述花色苷溶液5 mL分别加入五个康威式扩散皿内室中,再分别取已配制的各浓度氨水5 mL加入扩散皿外室,将其放于通风橱中反应1 h,在此期间每隔10 min将其进行全波长扫描。分析黑果枸杞花色苷溶液随着时间延长对挥发氨的响应。
1.2.4.2 黑果枸杞花色苷对肉类新鲜程度的响应试验 称取25 g猪肉和25 g牛肉,将其剁碎成肉末状后分别放于康威式扩散皿外室中,取25 mL花色苷浓缩液,用水定容至100 mL,向上述扩散皿内室中分别加入5 mL花色苷稀释液,做三组平行,存放于常温下干燥通风环境,每天相同时间放于紫外分光光度计中测定其吸光度,连续测5 d判定黑果枸杞花色苷对不同新鲜程度的肉类食品的响应。
1.2.5 羟基自由基清除率测定 参照高亮等[11]的方法作了适当变动,采用水杨酸法测定花色苷浓缩液羟基自由基清除能力,分别配制2 mmol/L的FeSO4溶液和H2O2溶液、100 mg/L的VC溶液;用无水乙醇作溶剂配制2 mmol/L水杨酸溶液;取10 mL花色苷浓缩液,定容至100 mL;分别取3 mL FeSO4溶液和水杨酸乙醇溶液依次加入到20支10 mL离心管中,混合均匀;分别取0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8和2.0 mL的VC溶液和0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8和2.0 mL的花色苷浓缩液加入到上述离心管中,将离心管置于37℃水浴中加热0.5 h,进行全波长扫描,测定各个吸光度。羟基自由基清除率计算公式为:
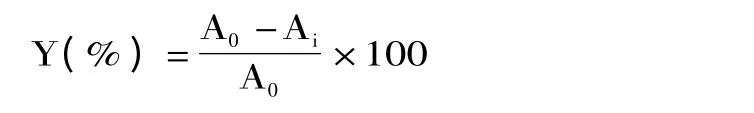
式中,Y:羟基自由基清除能力,%;Ai:加入样品后的吸光度;A0:样品本身的吸光度值。
1.3 数据处理
本研究中涉及的实验内容均重复3次并采用SPSS Statistics 22.0计算标准差;所有分析图运用Origin 2017和Adobe Photoshop CC2019进行绘制。
2 结果与分析
2.1 黑果枸杞花色苷浓缩液中花色苷的含量
图1反映了在波长400~800 nm范围内,黑果枸杞花色苷溶液pH=1和pH=4.5时的光谱情况。实验采用pH示差法测定黑果枸杞浓缩液中总花色苷的含量,由图1可知,黑果枸杞花色苷在p H=1时,在523和700 nm处分别有最大吸光度1.020和最小吸光度0.012,当pH=4.5时在540和700 nm处有最大吸光度0.120和最小吸光度0.021,将数据代入1.2.2公式中可得,此次实验中黑果枸杞花色苷浓缩液中花色苷含量为291.93 mg/L。
2.2 黑果枸杞花色苷颜色对pH的响应
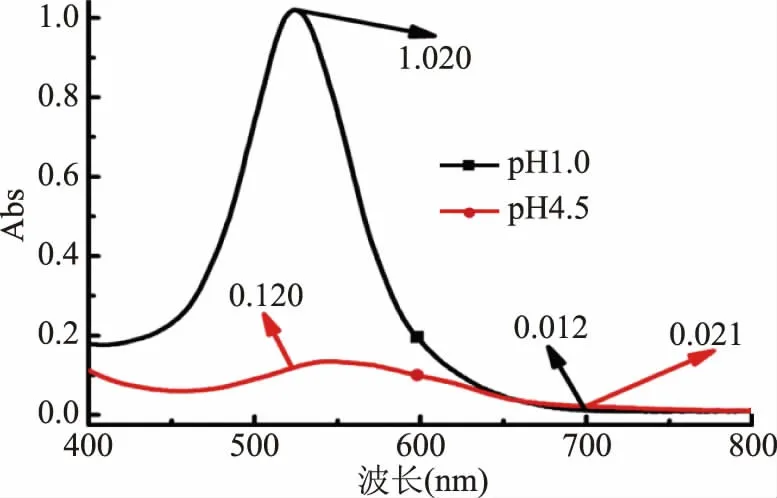
图1 黑果枸杞花色苷在pH1.0和pH4.5时可见光区全波段光谱图Fig.1 Full-band spectra of anthocyanins from Lycium barbarum at pH1.0 and pH4.5
图2 反映了不同p H下黑果枸杞花色苷颜色的变化(左)和可见光区全波段光谱图的情况(右),以此探究其pH敏感性。由图2(左)可知,在p H1.0~pH13.0变化范围内,随着p H的增大,黑果枸杞花色苷颜色从紫粉色最终变为黄色。在pH1.0~p H4.0范围内,其颜色由粉紫色逐渐变淡为无色;在p H5.0~pH8.0范围内,颜色由无色逐渐转变为绿色;在p H9.0~p H13.0范围内,暗黄色逐渐变亮。由图2(右)可知,在pH1.0~p H4.0范围内,p H1.0时花色苷的最大吸收波长为522 nm,当p H逐渐增大到4.0时,其最大吸收波长向533 nm方向移动,同时,其最大吸收峰不断减小;在p H5.0~pH8.0范围内,其最大吸收峰所处波长发生红移,由533 nm到619 nm,pH8.0时出现最大吸收峰,此时对应波长在619 nm附近。花色苷颜色之所以在不同的pH中呈现出颜色明显差别,是因为在不同的p H环境中,具有不同的化学结构[12]。在pH1.0~pH4.0间,强酸性环境使花色苷主要以黄烊盐离子的形式存在,随着酸性减弱,其结构转化为假碱、查耳酮[13],其最大吸收峰不断减小,粉色随之消失直到成无色状态[14];p H5.0~p H8.0间,花色苷结构逐渐变成醌式碱[15],引起黄烊盐离子浓度和溶液光泽一同降低,各个pH对应的最大吸收峰明显增大,溶液颜色呈现绿色[16];在pH9.0~p H13.0间,随着碱性增强,花色苷结构继续发生某些化学转变[17],溶液颜色实现从浅绿色、黄绿色、棕黄色、鲜黄色的转变。以上结果皆表明,花色苷溶液能够在不同p H中发生显著的颜色反应,有较强的pH敏感性。
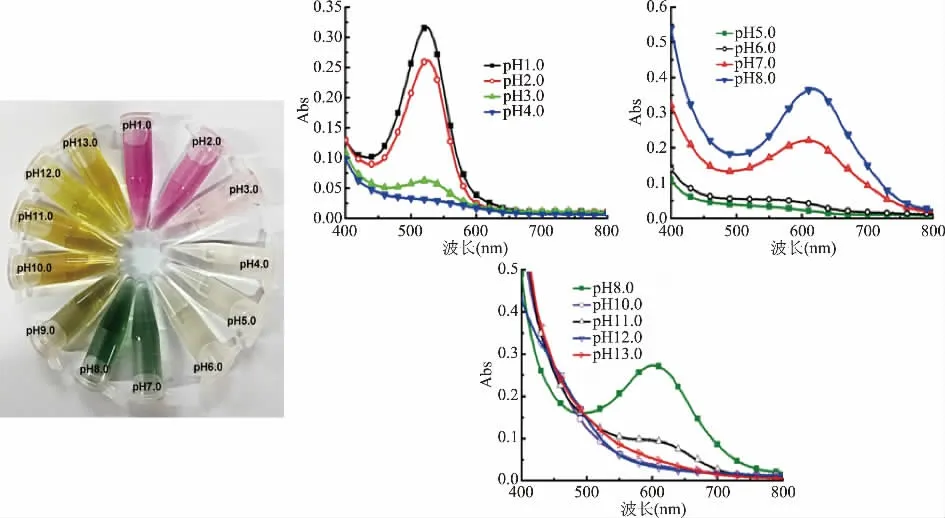
图2 不同pH下黑果枸杞花色苷的颜色和可见光区全波段光谱图Fig.2 The color of anthocyanin and its full band spectrum in visible region of Lycium barbarum under different pH values
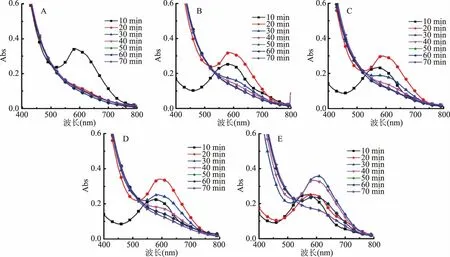
图3 不同浓度氨水挥发下黑果枸杞花色苷70 min内可见光区全波段光谱图Fig.3 The full band spectrum of anthocyanin in visible light region in 70 minutes under different ammonia concentration volatilization
2.3 黑果枸杞花色苷的智能指示
挥发性盐基氮是指由于细菌及有关酶的影响,动物食品在变腐败过程中,因为蛋白质分解产生的氨以及胺类等碱性含氮物质[18]。因而,能够通过挥发性盐基氮的含量判断动物性食品的新鲜程度。本实验在常温常压条件下进行,用猪肉、牛肉两种生活中常见肉类为样品,氨气为腐败特征气体[19],用以模拟肉类食品在新鲜程度发生改变时含氮化合物的挥发,实验反映了黑果枸杞花色苷对氨气、肉类样品不同新鲜程度的颜色响应及其灵敏度情况。以此判定是否能够用黑果枸杞花色苷来即时检测食品的新鲜程度。
2.3.1 黑果枸杞花色苷对挥发氨的响应测试 图3反映了在70 min内每间隔10 min在不同浓度氨水下,黑果枸杞花色苷的可见光区全波段图谱扫描。由图3可知,随着时间延长,花色苷溶液吸收峰不断减小,且氨水浓度越大变化越快,在30 min时,氨水浓度为0.297、0.371、0.495、0.742 mol/L所对应花色苷溶液最大吸光值分别为0.36、0.26、0.19、0.17;当氨水浓度为1.484 mol/L时,在20 min处,其最大吸收峰已完全消失;随着时间推移,花色苷溶液出现最大吸收波长红移情况,从585 nm向603 nm迁移。初始状态下,溶液呈紫色,对应吸收峰最强。随着反应进行,溶液中氨气浓度升高,颜色发生明显变化,实现从粉色到黄绿色最终为黄色的转变,吸收峰变弱且最大吸收波长发生红移的现象。这些现象发生的原因是,样品酸性强度高时,花色苷分子结构主要以黄烊盐离子的形式存在[20],随着NH3浓度增大,溶液碱性增强,花色苷结构转化为蓝色醌式碱,此时黄烊盐离子的浓度及色泽强度降低[21],导致最大吸收峰减小,最大吸收波长红移,颜色呈黄绿色[22];反应达一定程度时,花色苷结构极其不稳定最终被分解,吸收峰随之消失,颜色变黄[23]。以上结果说明,花色苷溶液能够和氨水反应,当反应时间相同时,氨水浓度越大,花色苷对NH3的响应速度越快,能够根据花色苷溶液的颜色变化判断食品腐败气体的产生且灵敏性较好。
2.3.2 黑果枸杞花色苷对肉类腐败气味的响应测试 图4反映了黑果枸杞花色苷溶液连续5 d放于存有猪肉和牛肉的密闭环境中,其吸光值的变化。由图4可知,花色苷于猪肉和牛肉环境中变化情况几乎一致,随着时间推移,花色苷溶液最大吸收峰逐渐变小,同时,也伴随着花色苷颜色的改变。第3 d时,其最大吸收波长发生红移,从第1、2 d时525 nm迁移到538 nm,其吸收峰继续变小,此时,花色苷颜色已转化成黄绿色,到第4 d吸收峰开始消失,颜色向黄色转变。原因是随着时间的延长,猪肉和牛肉新鲜度不断下降,肉质逐渐腐败,蛋白质发生变性[24],此时,伴随着氨以及胺类等碱性含氮物质的产生,这直接导致花色苷的红色烊阳离子结构减少且向着无色的假碱、查耳酮转变[25]。在第3 d及以后,因猪肉和牛肉腐败程度加深,含氮物质挥发量达一定限度,花色苷结构被破坏[26],溶液颜色变黄。以上表明,肉类食品新鲜程度可以通过观察黑果枸杞花色苷颜色的变化,这对食品质量优劣起到一定的指示作用。
2.4 黑果枸杞花色苷的羟基自由基清除能力
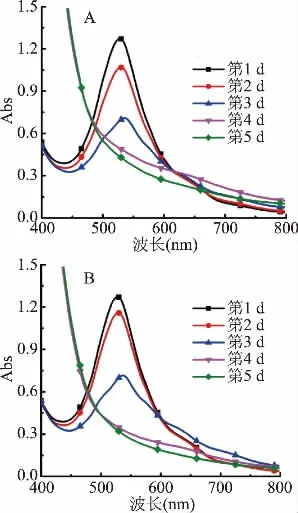
图4不同新鲜度猪肉(A)与牛肉(B)对黑果枸杞花色苷的影响Fig.4 Effects of pork(A)and beef(B)with different freshness on anthocyanins of Lycium barbarum
图5 反映不同VC和花色苷添加量对羟基自由基的清除能力。Hochestein等[27]研究结果显示,羟基自由基作为生物体系生成的一种极具反映性的自由基,其在自由基病理学方面拥有强烈损伤性,它可能使细胞坏死或发生突变[28]。因此,能够通过羟基自由基的清除率来探究某些物质的抗氧化能力强弱[29]。
实验以相同体积的VC溶液为对照品。由图5可知,在实验浓度范围内,花色苷和VC溶液对羟基自由基均具有一定的清除能力,当花色苷含量为0.95 mg/L时,羟基自由基清除率为2.4%;当花色苷含量到7.30 mg/L时,其清除率达64.3%。对于VC,当其浓度为16.68 mg/L时,其清除率达100%。由图5可知,VC和黑果枸杞花色苷对应羟基自由基清除率的IC50分别为10.19和5.54 mg/L,由此可得,黑果枸杞花色苷的羟基自由基清除能力强于VC。原因是黑果枸杞花色苷中释放出的H能够较好地和·OH结合,生成相对稳定的自由基,从而消灭介质中存在的大量有害自由基[30]。以上结果说明,黑果枸杞花色苷具有较强的羟基自由基清除能力,且清除能力随含量呈正相关稳步升高,说明具有良好抗氧化性能。
3 结论
本实验将乙醇作为浸提液提取黑果枸杞花色苷浓缩液,测定了浓缩液中花色苷含量、不同p H响应、氨气及肉类腐败气体响应、羟基自由基清除率。结果表明,黑果枸杞提取液中花色苷含量较高,为291.93 mg/L;花色苷pH敏感性较强,在p H1.0~pH13.0环境中,其颜色发生显著变化,从紫粉色到无色再到绿色最终变为黄色,其最大吸收波长发生红移,从522 nm到533 nm再到619 nm;花色苷对肉类食品新鲜程度有良好的指示性,对氨气响应较为灵敏,且其反映速率随浓度增大而加快,花色苷溶液颜色从紫红色转变青黄色最终变为黄色,肉类食品腐败程度加深时,最大吸收峰逐渐减弱,波长在525~538 nm范围内变化;花色苷具备良好的抗氧化性能,花色苷IC50比VC小4.65 mg/L,清除氢基自由基效果明显,随着花色苷浓度的增大,其羟基自由基清除率呈稳定上升趋势。
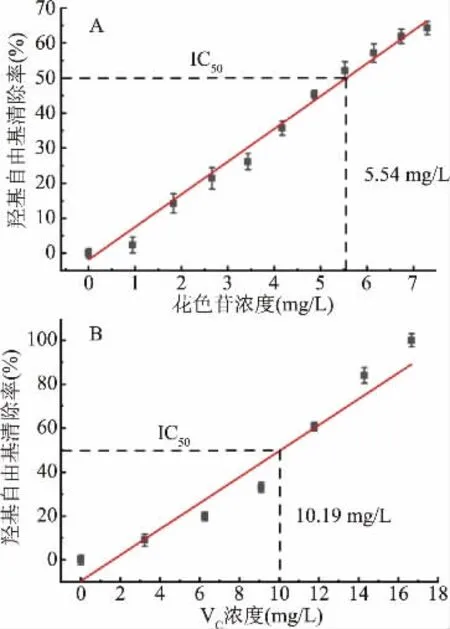
图5 不同浓度黑果枸杞花色苷(A)和VC(B)溶液的羟基自由基清除率Fig.5 Hydroxyl radical scavenging rates of Lycium barbarum anthocyanin(A)and VC(B)solutions with different concentrations
