木犀草素抑制ERK1/2与p38 MAPK的活化介导鼻咽癌CNE1细胞的生长、移动性和肿瘤干细胞样特性*
2021-06-21陈进芬刘平陈静吴志勇华清泉王兰
陈进芬,刘平,陈静,吴志勇,华清泉,王兰
1.应城市人民医院,湖北 应城432400;2.武汉大学人民医院,湖北 武汉430000;3.武汉科技大学附属医院,湖北 武汉430000
鼻咽癌是一种位于鼻咽部的上皮恶性肿瘤,在世界范围内仍保持较高的发病率[1]。鼻咽癌具有局部侵袭和早期远处转移的特点,遗传易感性、Epstein-Barr病毒(EBV)感染和环境因素是鼻咽癌的三大主要诱因[2]。目前,对于局部晚期的鼻咽癌,化学疗法、放射疗法无疑是标准的治疗方法,可将病死率降低18%,并将5年总生存率提高4~6%[3]。虽然鼻咽癌对放疗和化疗很敏感,但由于其具有很高的转移潜能,30~40%的鼻咽癌患者会在4年内发生远处转移,因此这些治疗方法的有效性受到严重影响,这也是鼻咽癌治疗失败的主要原因[4]。减少复发和预防转移是鼻咽癌成功治疗的关键。目前鼻咽癌的病理分子机制尚不清楚,了解鼻咽癌的病理机制,寻找新的治疗药物是非常必要的。木犀草素是黄酮类化合物家族中的一员,通常以糖基化形式存在于草本植物木犀草中。木犀草素可直接诱导大量人类癌细胞凋亡[5-7],并提高癌细胞对化疗或生物治疗药物的敏感性[8]。大量研究表明,木犀草素具有抗肿瘤的潜力,但其对鼻咽癌的作用及确切潜在机制仍不清楚。本研究探索木犀草素对鼻咽癌CNE1细胞生长、运动和肿瘤干细胞样特性的影响以及是否存在ERK1/2和p38 MAPK信号通路的参与,检测该通路相关蛋白的表达情况,从而确定新的治疗靶点,以期为木犀草素应用于鼻咽癌的防治提供实验依据。
1 材料
1.1 细胞CNE1细胞株(中国科学院典型培养物保藏委员会细胞库,GDC0208),培养于含10%胎牛血清的DMEM培养基中,放置于37℃、5%CO2培养箱中培养。
1.2 试剂与药物DMEM培养基、胎牛血清、胰酶、B27、bFGF、EGF(美国Gibco公司,批号:11039021、12483020、15400054、12587010、13256-029、PHG0311);RIPA裂解液(P0013HD,碧云天,上海);二喹啉甲酸BCA蛋白浓度测定试剂盒(PA115,天根生物公司,北京);5-ethynyl-2′-deoxyuridine(EdU)检测试剂盒(C00053,锐博生物,广州);MatrigelTM底膜基质(3356234,BD公司,美国);Super RT cDNA试剂盒(CW0741M,康为世纪,北京);Quantifast®SYBR®Green PCR Kit(204054,QIAGEN,德国);Ki67、Bcl-2、Bax、Survivin、c-Myc、vascular endothelial growth factor(VEGF)、Vimentin、Fibronectin、ERK1/2抗体、p38 MAPK抗体(批号:ab92742、ab32124、ab182734、ab76424、ab32072、ab72807、ab16700、ab32419、ab17942、ab4822,Abcam公司,美国);HRP标记的山羊抗小鼠以及羊抗兔二抗(批号:sc-2005、sc-2040,Santa Cruz公司,美国);细胞凋亡检测试剂盒(批号:KGA1016,南京凯基生物有限公司,中国);木犀草素(批号:L9283,纯度:98%,Sigma公司,美国)。
1.3 仪器高速低温离心机(Beckman公司,美国);CO2培养箱、ABI 7500实时荧光定量PCR仪(Thermo公司,美国);电泳槽、电转仪(Bio-Rad公司,美国);27145型低黏附6孔板(诺为生物,北京);流式细胞仪(Beckman公司,美国);电热恒温水浴箱(Grant公司,英国);GDS-800凝胶成像系统(UVP公司,美国);ChemiDoc XRS凝胶/发光图像分析仪(Bio-Rad公司,美国)。
2 方法
2.1 细胞培养CNE1细胞株在含10%胎牛血清的培养基中生长,当细胞汇合率达到80%以上时用0.25%胰酶进行消化传代,取3~8代细胞用于实验。药物干预前,将细胞调整至适当密度,接种于96孔、24孔或6孔培养板中,待细胞生长至融合状态,用1%低血清培养基培养12 h使细胞同歩化。
2.2 分组与给药将CNE1细胞分4组处理:对照组:在细胞融合后,用含正常血清的DMEM培养基培养48 h后,换为无血清DMEM培养基培养;药物处理组:在细胞融合后,用含低、中、高剂量(5、10、20 mg·L-1)木犀草素及正常血清的DMEM培养基培养48 h后,换为不加药物的无血清DMEM培养基培养。
2.3 Ed U染色检测细胞增殖状态严格按照试剂盒说明书操作,具体如下:将处理过的各组细胞用50μmol·L-1的EdU培养12 h,用4%的多聚甲醛固定细胞30 min,然后用5%的甘氨酸孵育5 min,磷酸盐缓冲液(PBS)洗涤。0.5%Triton X-100破膜后,用抗-EdU抗体孵育30 min,再用5 mg·L-1Hoechst 33342染色30 min,荧光显微镜观察并照相。
2.4 免疫印迹法检测相关蛋白的表达使用裂解缓冲液裂解细胞样品,并用BCA蛋白质测定试剂盒定量蛋白质浓度。含有20μg蛋白质的10μL样品在10%SDS-PAGE中分离,然后转移到聚偏二氟乙烯(PVDF)膜上。用5%脱脂牛奶室温封闭蛋白2 h,随后加入一抗(Ki67、Bcl-2/Bax、Survivin、c-Myc、VEGF、Vimentin、Fibronectin、ERK1/2、p-ERK1/2、p38 MAPK、p-p38 MAPK,1∶1 000)于4℃封闭过夜,第2天加入对应二抗室温封闭1 h,最后滴加ECL,设置曝光参数,检测目的条带化学发光强弱。
2.5 Transwell检测CNE1细胞的侵袭能力将木犀草素处理过的细胞消化离心,无血清培养基重悬细胞,以每孔1×104个细胞数量种入上室,下室加入有血清的培养基。48 h后用无菌棉签擦去小室上层细胞,将transwell小室倒置风干,并放入含有500μL染色液(0.1%结晶紫)的12孔板中,染色20 min,PBS清洗3次,风干。在transwell小室直径上,取5个视野,在显微镜下拍照计数。
2.6 成球实验检测肿瘤干细胞样特性收集对数生长期的CNE1细胞,用DMEM培养基洗1次并重悬,血细胞计数器统计细胞密度。在低黏附6孔板中加2%B27、20μg·L-1bFGF和20μg·L-1EGF的DMEM培养基,每孔接种1 000个细胞,置于5%CO2恒温培养箱中。每隔2 d补加新鲜培养基,分别加药处理14 d,于倒置显微镜下拍照并统计成球直径和成球率。
2.7 RT-PCR检测相关基因的mRNA表达使用TRIzol试剂提取总RNA,并通过超微紫外光分光光度计在260和280 nm处测定吸光度。按照试剂盒说明书,使用Super RT cDNA试剂盒合成cDNA。使用Quantifast®SYBR®GreenPCR Kit进行PCR,分别在95℃15 s和60℃60 s条件下使用ABI 7500将反应激活。用于该反应的CD33、SOX-2、OCT4及β-actin的引物信息见表1。
2.8 统计学方法使用SPSS 21.0(SPSS,Inc,Chicago,IL,USA)分析所有数据。所有实验至少独立重复3次,每个独立重复检测3次。测量数据表示为平均值±标准偏差。使用LSD方法进行成对比较,采用t检验比较两组间符合正态分布的数据。P<0.05为差异有统计学意义。
3 结果
3.1 木犀草素抑制鼻咽癌CNE1细胞的增殖与对照组比较,中、高剂量木犀草素处理后,EdU红色标记的细胞明显减少,即增殖细胞占比减少。结果见图1。

表1 RT-PCR的引物序列
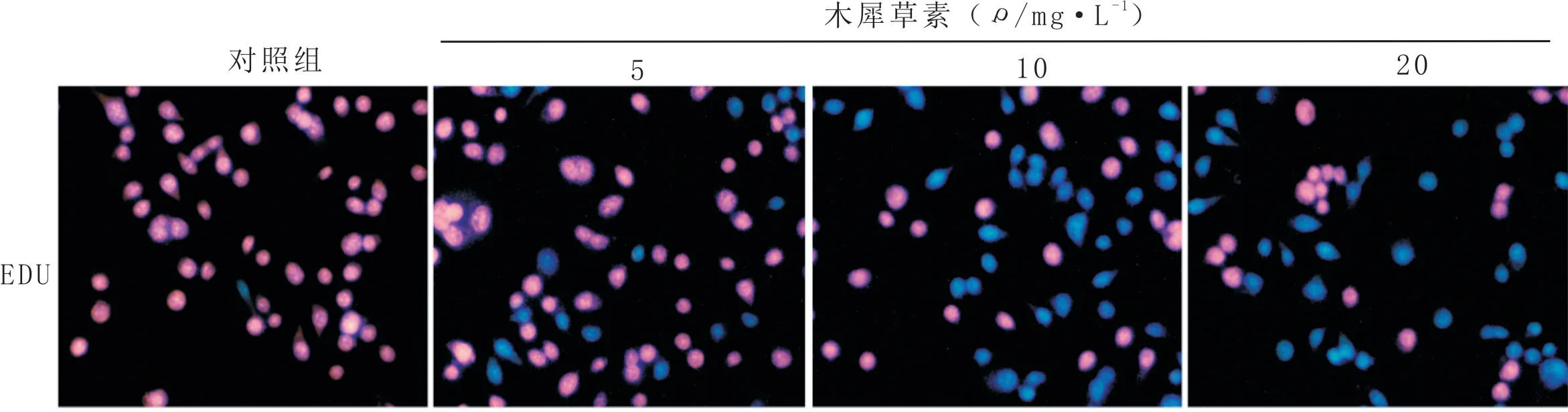
图1 鼻咽癌CNE1细胞的增殖变化(EdU染色,×400)
3.2 木犀草素抑制Ki67、Bcl-2/Bax、Survivin、c-Myc的蛋白表达与对照组比较,低剂量组Ki67和Bcl-2/Bax蛋白表达水平显著降低(P<0.05),中、高剂量组Ki67、Bcl-2/Bax、Survivin、c-Myc蛋白表达水平均显著降低(P<0.05),提示木犀草素可抑制鼻咽癌CNE1细胞中Ki67、Bcl-2/Bax、Survivin、c-Myc蛋白的表达。结果见图2,表2。
3.3 木犀草素抑制鼻咽癌CNE1细胞的侵袭能力
与对照组比较,中、高剂量的木犀草素处理后侵入到小室膜底侧的CNE1细胞数量明显减少,即侵袭性细胞数减少。结果见图3。
表2 不同浓度木犀草素处理后Ki67、Bcl-2/Bax、Survivin、c-Myc的蛋白表达 (±s)

表2 不同浓度木犀草素处理后Ki67、Bcl-2/Bax、Survivin、c-Myc的蛋白表达 (±s)
注:与对照组比较,*P<0.05
Myc/GAPDH/%对照组组别 Ki67/GAPDH/% Bcl-2/Bax Survivin/GAPDH/% c-23.26±3.05 6.93±0.92 14.21±2.54 18.06±3.25低剂量木犀草素组 19.41±5.46* 3.81±0.28* 14.02±1.93 16.32±3.84中剂量木犀草素组 6.26±1.03* 0.18±0.04* 5.19±1.22* 6.87±1.47*高剂量木犀草素组 3.85±1.64* 0.04±0.01* 1.28±0.58* 1.02±0.94*

图3 不同浓度木犀草素处理后CNE1细胞侵袭能力的变化
3.4 木犀草素抑制VEGF、Vimentin、Fibronectin的蛋白表达与对照组比较,中、高剂量组VEGF、Vimentin、Fibronectin蛋白表达水平均显著降低(P<0.05)。结果见图4,表3。
3.5 木犀草素降低鼻咽癌干细胞特性与对照组比较,低、中、高剂量组肿瘤干细胞成球直径和数目均显著减少(P<0.05)。结果见图5,表4。
表3 不同浓度木犀草素处理后VEGF、Vimentin、Fibronectin的蛋白表达 (±s)

表3 不同浓度木犀草素处理后VEGF、Vimentin、Fibronectin的蛋白表达 (±s)
注:与对照组比较,*P<0.05
组别 VEGF/GAPDH/%Vimentin/GAPDH/%Fibronectin/GAPDH/%对照组66.29±9.64 42.41±8.05 93.45±10.24低剂量木犀草素组 63.11±8.05 41.45±7.26 89.14±12.53中剂量木犀草素组 19.25±5.42*13.43±4.92*22.77±6.42*高剂量木犀草素组 7.17±3.19*10.15±3.67*16.84±5.17*

图4 不同浓度木犀草素处理后VEGF、Vimentin、Fibronectin的蛋白表达
3.6 木犀草素抑制CD33、SOX-2、OCT4 mRNA的表达与对照组比较,低剂量组OCT4 mRNA表达量显著降低(P<0.05);中、高剂量组CD33 mRNA、SOX-2 mRNA、OCT4 mRNA表达量均显著降低(P<0.05)。结果见表5。
表4 不同浓度木犀草素处理后肿瘤干细胞成球体积和数目的变化 (±s)

表4 不同浓度木犀草素处理后肿瘤干细胞成球体积和数目的变化 (±s)
注:与对照组比较,*P<0.05
组别 成球直径(l/μm)成球数目/100个细胞对照组128.64±19.06 87.29±16.41低剂量木犀草素组 95.31±12.85* 73.16±14.27*中剂量木犀草素组 28.14±6.93* 28.07±9.03*高剂量木犀草素组 10.27±4.62* 23.91±8.81*
表5 不同浓度木犀草素处理后CD33、SOX-2、OCT4的mRNA表达 (±s)

表5 不同浓度木犀草素处理后CD33、SOX-2、OCT4的mRNA表达 (±s)
注:与对照组比较,*P<0.05
组别 CD33 mRNA(2-ΔΔCt)SOX-2 mRNA(2-ΔΔCt)OCT4 mRNA(2-ΔΔCt )对照组1 1 1低剂量木犀草素组0.93±0.07 0.94±0.06 0.82±0.08*中剂量木犀草素组0.61±0.03*0.58±0.03*0.44±0.06*高剂量木犀草素组0.25±0.04*0.23±0.05*0.13±0.02*

图5 不同浓度木犀草素处理后肿瘤干细胞成球体积和数目的变化
3.7 木犀草素抑制ERK1/2和p38 MAPK的磷酸化水平与对照组比较,低剂量组p-ERK1/2蛋白表达水平显著降低(P<0.05);中、高剂量组p-ERK1/2和p-p38 MAPK蛋白表达水平均显著降低(P<0.05)。结果见图6,表6。
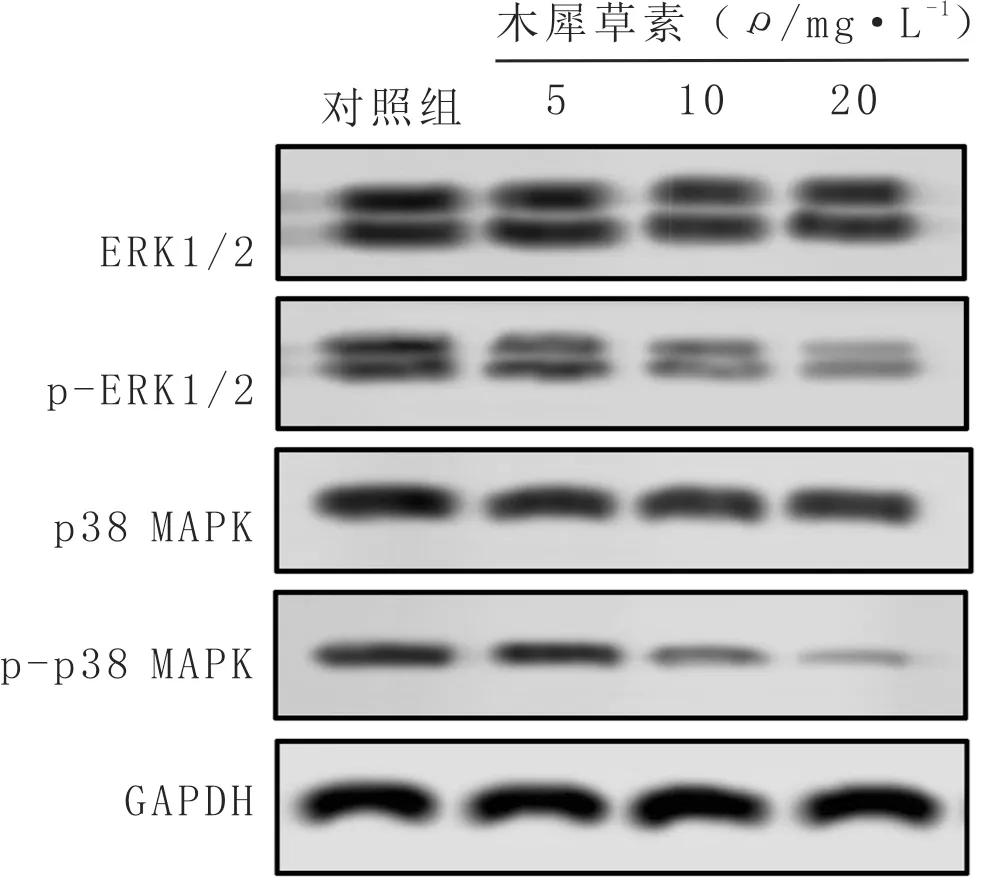
图6 不同浓度木犀草素处理后ERK1/2和p38 MAPK磷酸化水平的变化
表6 不同浓度木犀草素处理后ERK1/2和p38 MAPK磷酸化水平的变化 (±s)

表6 不同浓度木犀草素处理后ERK1/2和p38 MAPK磷酸化水平的变化 (±s)
注:与对照组比较,*P<0.05
p-ERK1/2/ERK1/2 p-p38 MAPK/p38 MAPK对照组组别0.88±0.05 0.36±0.05低剂量木犀草素组 0.69±0.06* 0.35±0.04中剂量木犀草素组 0.14±0.02* 0.07±0.03*高剂量木犀草素组 0.08±0.03* 0.02±0.01*
4 讨论
鼻咽癌是起源于鼻咽部黏膜上皮的肿瘤,常发生在鼻咽部咽隐窝和顶前壁部位,是我国南部和东南亚地区最常见的头颈部恶性肿瘤之一。鼻咽癌浸润生长快,恶性程度高,且其解剖部位特殊,早期病灶小,症状不典型,临床上易忽略及误诊,发病早期就可能发生颈部淋巴结转移,甚至远处转移[9]。放疗是主要的治疗手段,但目前放射疗法和化学疗法不能完全根除肿瘤[10]。鼻咽癌放疗后局部复发和远处转移是制约其疗效,影响其预后的主要原因[11]。因此,研究鼻咽癌的分子机理,寻找新的鼻咽癌治疗方法已成为鼻咽癌防治的关键所在。
抑制细胞生长和诱导细胞死亡是抑制肿瘤生长的两种主要手段[12]。细胞凋亡对于维持组织稳态和预防癌症发展至关重要[13]。研究发现,木犀草素可通过下调Bcl-2和Survivin蛋白的表达,上调Bax蛋白的表达,以剂量依赖性的方式有效抑制骨肉瘤细胞的增殖,诱导细胞凋亡[14]。木犀草素抑制过表达cMet的PDTX模型肿瘤生长,诱导细胞凋亡,并显著下调MMP9、Ki-67和cMet的表达[15]。Wang等[16]研究发现,木犀草素可以抑制Eca109的增殖,下调c-Myc的mRNA水平,降低c-Myc在Eca109细胞中的蛋白表达。与前人研究结果一致,本研究发现,木犀草素可抑制CNE1的增殖,下调Ki67、Bcl-2/Bax、Survivin、c-Myc蛋白表达水平,表明木犀草素能促进鼻咽癌CNE1细胞的凋亡,抑制其生长。
癌症具有高侵袭转移潜能,这是导致治疗失败的主要原因[17]。研究发现,木犀草素对CAOV3/DDP细胞的侵袭具有剂量依赖性的抑制作用[18]。Zang等[19]通过Transwell实验发现,木犀草素处理可显著抑制胃癌细胞的侵袭,间质生物标志物Vimentin的蛋白水平呈剂量依赖性降低。研究证实在木犀草素处理后,Vimentin和VEGF的蛋白水平均明显降低,抑制结直肠癌细胞的上皮间质转化[20]。同样,木犀草素能够抑制U87细胞的侵袭,抑制人胶瘤细胞对Fibronectin的黏附[21]。与之前的研究结果相似,本研究发现,木犀草素抑制鼻咽癌CNE1细胞的侵袭,显著下调VEGF、Vimentin、Fibronectin蛋白表达水平,表明木犀草素具有抑制鼻咽癌CNE1细胞侵袭和运动的作用。
鼻咽癌肿瘤干细胞能产生异质肿瘤细胞,具有很强的自我更新能力,促进肿瘤的发生发展,与鼻咽癌的耐药、复发和转移密切相关。Wang等[22]使用Hoechst 33342从NPC细胞系CNE-2中分选出的侧群细胞具有干细胞特性,对体内和体外的化学疗法和放射疗法具有抗性。研究发现,给予mTOR信号抑制剂后,mTOR信号激活被抑制,CD133、SOX2、OCT4表达减少,雷帕霉素处理后,鼻咽癌肿瘤干细胞样活性被抑制[23]。本研究发现,木犀草素能够明显抑制在成球实验中CNE1的成球能力,降低其中肿瘤干细胞的比例,下调CD33 mRNA、SOX-2 mRNA、OCT4 mRNA的表达量,表明木犀草素能降低鼻咽癌肿瘤干细胞活性。
ERK1/2和p38 MAPK信号通路在肿瘤的发生和发展过程中发挥着重要作用。Shen等[24]研究发现,p38 MAPK和ERK1/2磷酸化水平的降低参与了木犀草素介导的UPEC入侵抑制,木犀草素预处理细胞可明显抑制p38 MAPK和ERK1/2的激活。木犀草素在EGF诱导的MCF-7乳腺癌细胞中具有抑制MAPK和p-ERK1/2信号通路活性的潜力[15]。本研究发现,木犀草素明显降低ERK1/2和p38 MAPK的磷酸化水平,推测木犀草素可通过抑制ERK1/2和p38 MAPK的活性抑制鼻咽癌的发生发展。
综上所述,木犀草素可抑制鼻咽癌CNE1细胞的生长和运动,降低鼻咽癌干细胞样特性,其机制可能与抑制ERK1/2和p38 MAPK的磷酸化有关。
