南蛇藤提取物对ERK/MAPK通路介导的人胃癌MKN45细胞侵袭转移的研究*
2021-06-21马霜向亮亮文佩宇刘延庆
马霜,向亮亮,文佩宇,刘延庆
扬州大学医学院,江苏 扬州225009
胃癌(gastric cancer,GC)是世界上最致命的恶性肿瘤之一,在众癌症中发病率排第五,病死率排第三。除非在早期发现,否则很难通过手术、化疗和放疗等方法治愈[1]。患者局部复发或远处转移,或在肿瘤播散时确诊为胃癌,生存期很少超过12个月,5年生存期小于10%[2]。肿瘤细胞的侵袭和转移是影响胃癌治疗的最主要原因之一[3]。因此,抑制胃癌的转移过程是胃癌治疗的重要环节。目前,普遍认为基质金属蛋白酶[4](matrix metalloproteinases,MMPs)及上皮间质转化[5](epithelial-mesenchymal transitions,EMT)等是包括胃癌在内的多种恶性肿瘤获得侵袭转移能力的重要调节因素,已成为抗肿瘤药物研究的重要方向。南蛇藤为卫矛科南蛇藤属植物,具有清热解毒的功效。课题组前期研究发现,南蛇藤乙酸乙酯提取物(celastrus orbiculatus extracts,COE)有显著的抗肿瘤活性,可抑制多种恶性肿瘤细胞的增殖、侵袭转移、血管生成[6-7]及促进凋亡[8]。但COE抑制胃癌MKN45细胞侵袭转移的研究及内在可能分子机制还未清楚,在国内外未见报道。本研究拟探讨COE对人胃癌细胞MKN45侵袭和迁移的影响及其可能的作用机制。
1 材料
1.1 细胞人胃癌MKN45细胞株(中科院上海细胞库)。
1.2 药物与试剂南蛇藤(广州致信药业有限公司,批号:070510);5-氟尿嘧啶注射液(5-fluorouracil,5-fu)(上海旭东海普药业有限公司,批号:170724)。RPMI 1640培养基(Gibco公司,批号:12633012);胎牛血清(Gibco公司,批号:10099-141);胰酶细胞消化液(碧云天公司,批号:C0201);MTT粉剂(美国Sigma公司,批号:M2128);Matrigel胶(北京索莱宝科技有限公司,批号:M8370);MMP-2、MMP-9、EMT、Ras、Raf、MEK、ERK、β-actin(美国CST公司,货号分别为:4022S、3852S、9782S、3339S、9422S、4694S、4695S、4970S);增强型化学发光试剂盒(英国Amersham Life Science公司,货号:RPN2232)。
1.3 仪器Heracell 150i型CO2培养箱(美国Thermo公司);MSC1.2型生物安全柜(美国Thermo公司);EnSpire型多功能酶标仪(美国PerkinElmer公司);电泳槽、凝胶成像分析仪(美国Bio-Rad公司);倒置荧光显微镜(日本Olympus公司)。
2 方法
2.1 药物的制备南蛇藤由秦民坚教授(中国药科大学中药资源研究室)鉴定,后由王强教授课题组(中国药科大学)完成对南蛇藤的提取、纯化和鉴定[9-10]。将南蛇藤茎充分粉碎后,经95%乙醇加热回流提取3次,回收溶剂得到浸膏后用硅藻土拌匀,再进行真空低温抽干,用乙酸乙酯热水浴回流加热、过滤,即得到南蛇藤乙酸乙酯提取物(COE),其中,萜类化合物含量约为68%[11]。该制备法已取国家发明专利(专利号:ZL200710025343.3)。
2.2 MTT比色法检测细胞增殖取对数生长期的MKN45细胞用胰酶消化,收集单细胞悬液,计数后调整浓度为每孔约5×104个,接种于96孔板。待细胞贴壁生长后换入无血清培养基配制的COE(20 mg·L-1、40 mg·L-1、80 mg·L-1、160 mg·L-1、320 mg·L-1)200μL,继续孵育24 h、48 h、72 h后,分别加入0.5%MTT溶液继续培养4 h,弃上清,每孔中加150μL DMSO溶剂,置酶标仪内低速振荡10 min,充分溶解后在490 nm处检测各孔吸光度值。每组设5个复孔,重复3次。
2.3 划痕实验细胞制备同上,均匀接种于6孔板中。待细胞贴壁并生长良好后,用枪头在每孔中轻轻刮出2 mm左右刮痕,无菌PBS冲洗划痕中部漂浮细胞,置倒置显微镜下确认刮痕内无细胞后拍照。设立 对 照组、COE(20 mg·L-1、40 mg·L-1、80 mg·L-1)组、5-fu组。继续培养24 h后,于倒置显微镜下观察拍照,记录各孔中划痕距离。每组设3个复孔。
2.4 细胞侵袭实验Matrigel胶用培养基按1∶6稀释后,均匀铺在Transwell小室的上室底部孵育待用。设对照组、COE组(20 mg·L-1、40 mg·L-1、80 mg·L-1)、5-fu组,培养24 h后,将各组细胞消化,用无血清RPMI 1640培养基制成浓度为每1 mL含5×105个细胞。在Transwell的上室加入200μL各组单细胞悬液,下室加入500μL含20%FBS的RPMI 1640培养基,继续培养24 h后,取出Transwell小室用无菌PBS清洗3次,用棉签拭去上室膜表面的细胞后,甲醇固定20 min,0.1%结晶紫常温下染色20 min,再洗脱结晶紫。每组设置3个复孔。倒置显微镜下计数中间和四周5个视野侵袭的细胞数目,取平均值。
2.5 细胞迁移实验除了Transwell小室上室底面不用Matrigel胶稀释包被外,其余步骤均同2.4。
2.6 Western Blot法检测蛋白的表达取对数期细胞,分组同上,经不同药物处理24 h后,提取总蛋白,并进行浓度定量分析,电泳、转膜、封闭、抗体孵育,一抗浓度设为1∶1 000,二抗浓度为1∶2 000,ECL发光,采集并分析图像。
2.7 统计学方法采用SPSS 20.0软件统计分析,计量数据以均数±标准差(±s)表示,组间比较用单因素方差分析。以P<0.05为差异有统计学意义。
3 结果
3.1 CEO对MKN45细胞增殖的影响采用MTT法探讨不同浓度的COE(10 mg·L-1、20 mg·L-1、40 mg·L-1、80 mg·L-1、160 mg·L-1、320 mg·L-1)作用后对MKN45细胞增殖能力的影响。药物作用24 h、48 h、72 h后,细胞生长呈现出不同程度的增殖抑制,且呈浓度及时间依赖性。在药物作用24 h条件下,计算CEO对MKN45细胞作用的半数抑制浓度(IC50)为129.5 mg·L-1。为排除COE对细胞的毒性作用影响,后续实验中COE质量浓度设置为20 mg·L-1、40 mg·L-1、80 mg·L-1远低于IC50的浓度,时间设置为24 h。见表1。
表1 CEO对MKN45细胞增殖的影响 (±s,n=5)
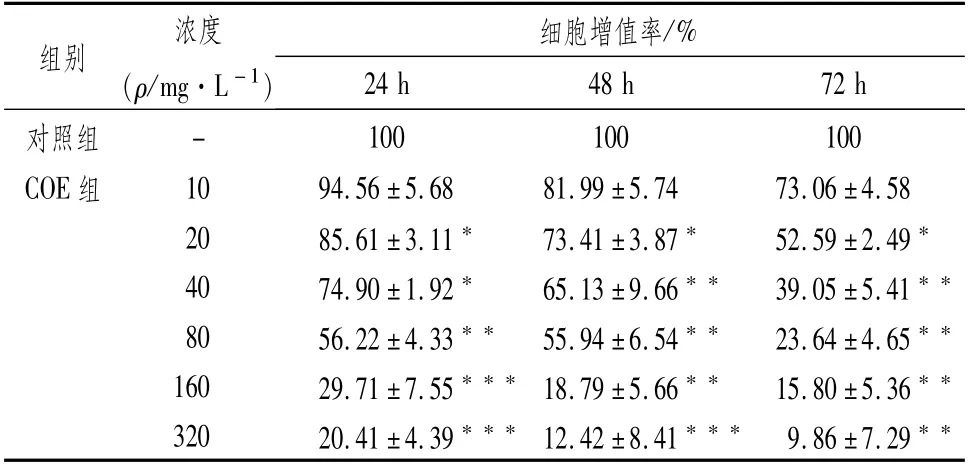
表1 CEO对MKN45细胞增殖的影响 (±s,n=5)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
组别浓度(ρ/mg·L-1)细胞增值率/%24 h 48 h 72 h对照组100 100 100 COE组 10 94.56±5.68 81.99±5.74 73.06±4.58 20 85.61±3.11* 73.41±3.87* 52.59±2.49*40 74.90±1.92* 65.13±9.66** 39.05±5.41**80 56.22±4.33** 55.94±6.54** 23.64±4.65**160 29.71±7.55***18.79±5.66** 15.80±5.36**320 20.41±4.39***12.42±8.41*** 9.86±7.29-**
3.2 CEO对MKN45细胞迁移能力经不同浓度COE处理24 h后,观察细胞往划痕中心迁移的距离。与对照组相比,浓度越高的COE处理24 h后,迁移的距离越小,提示迁移速率变慢,表明CEO可显著抑制MKN45细胞的迁移。见图1,表2。
表2 各组细胞迁移距离 (±s,n=3)

表2 各组细胞迁移距离 (±s,n=3)
注:与对照组比较,*P<0.05,**P<0.01
组别 浓度(ρ/mg·L-1)迁移距离对照组-0.53±0.11**COE组 20 0.31±0.05**40 0.18±0.03*80 0.05±0.02 5-fu组32 0.04±0.01
3.3 CEO对MKN45细胞侵袭与迁移能力的影响
与对照组相比,经COE干预后,侵袭细胞数量和迁移细胞数量明显减少(P<0.05),且与药物浓度呈相关性。即COE可显著抑制MKN45细胞的侵袭和迁移。见表3,图2。
表3 各组Transwell小室穿膜细胞数目 (±s,n=5)
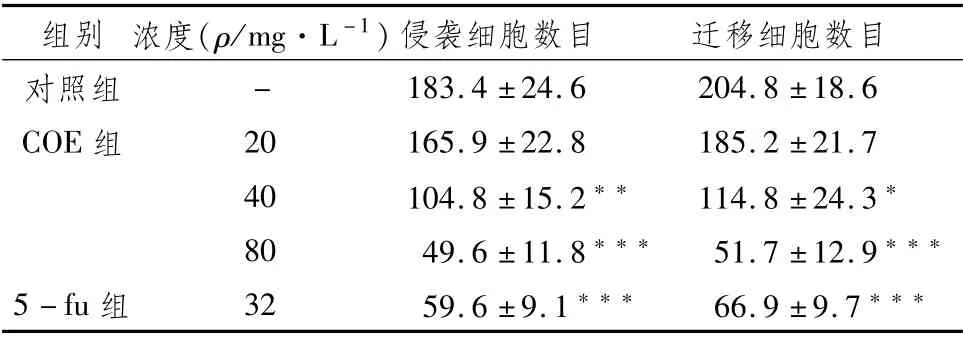
表3 各组Transwell小室穿膜细胞数目 (±s,n=5)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
组别 浓度(ρ/mg·L-1)侵袭细胞数目 迁移细胞数目对照组- 183.4±24.6 204.8±18.6 COE组 20 165.9±22.8 185.2±21.7 40 104.8±15.2** 114.8±24.3*80 49.6±11.8*** 51.7±12.9***5-fu组 32 59.6±9.1*** 66.9±9.7***
3.4 CEO对MKN45细胞中MMP2、MMP9及EMT相关蛋白表达的影响与对照组比较,随着CEO浓度的增加,细胞中MMP-2、MMP-9、Ncadherin、Vimentin蛋白表达降低(P<0.05),Ecadherin蛋白表达升高(P<0.05)。即COE可下调胃癌MKN45细胞中MMP-2、MMP-9、N-cadherin、Vimention蛋白表达,上调E-cadherin蛋白表达。见图3。
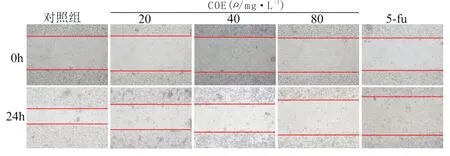
图1 CEO对MKN45细胞迁移能力的影响(×200)
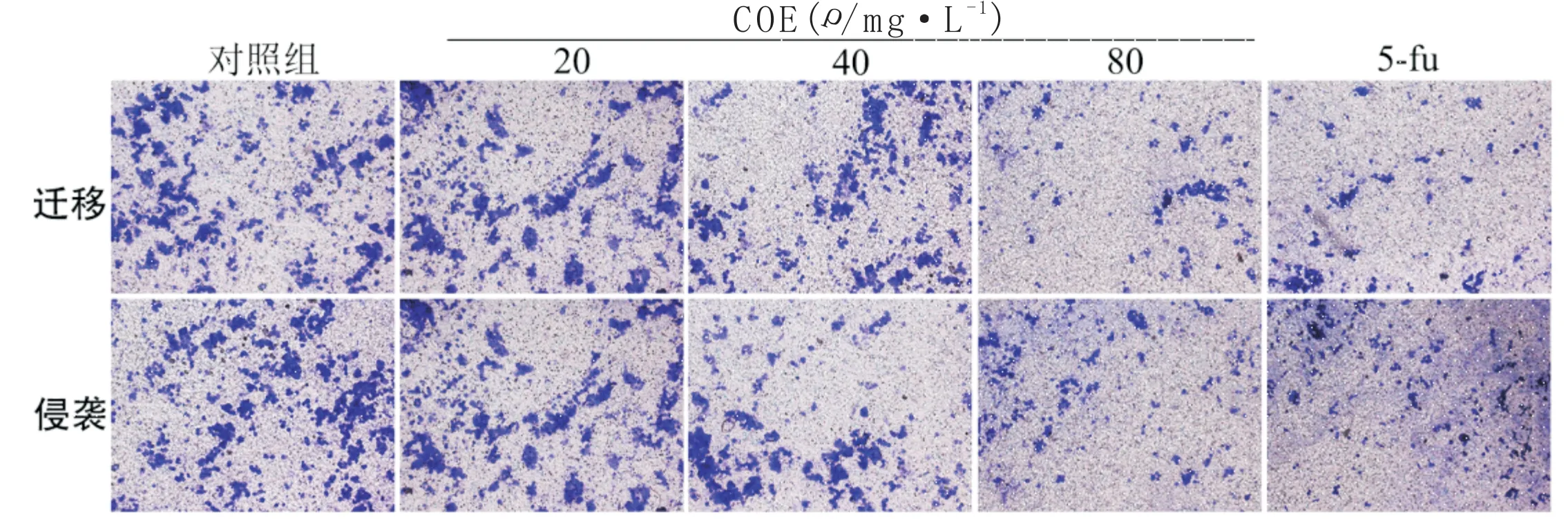
图2 CEO对MKN45细胞侵袭与迁移的影响(×200)
3.5 CEO对MKN45细胞中ERK/MAPK信号通路相关蛋白表达的影响与对照组比较,随着CEO浓度的增加,细胞中Ras、Raf、MEK及ERK1/2蛋白表达降低(P<0.05)。即COE可通过抑制ERK/MAPK信号通路来抑制胃癌细胞的侵袭转移。见图4。
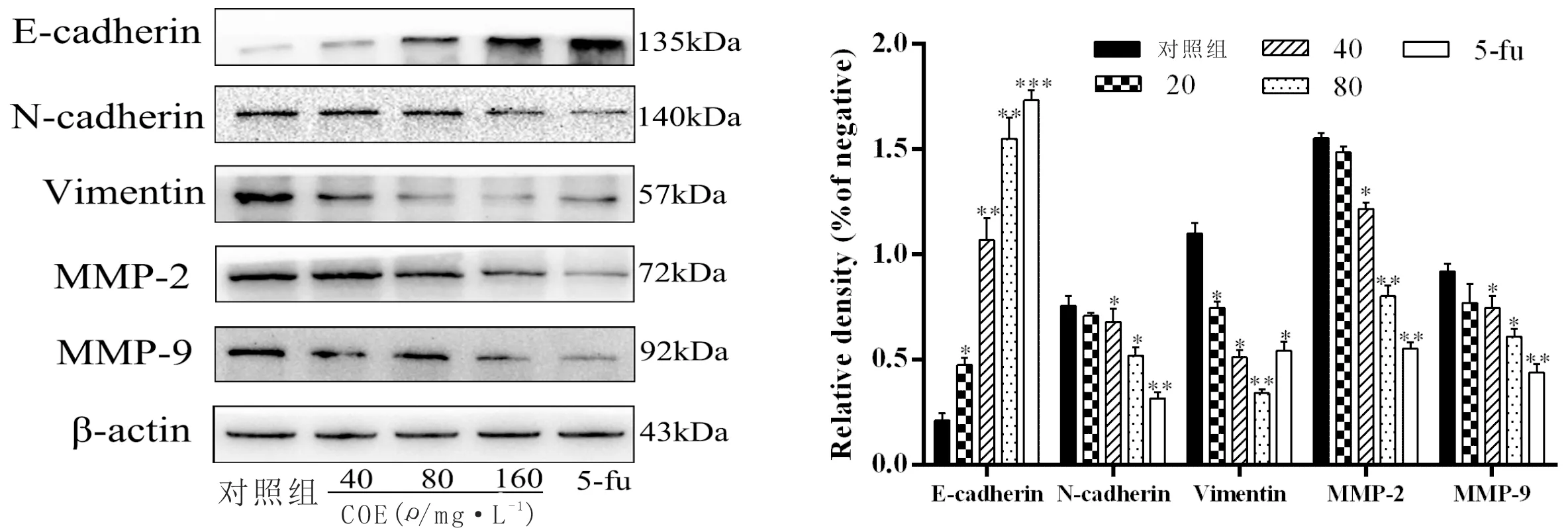
图3 CEO对MKN45细胞MMP2、MMP9及EMT蛋白表达的影响
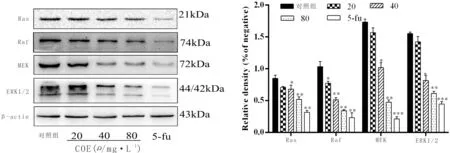
图4 CEO对MKN45细胞中ERK/MAPK信号通路相关蛋白表达的影响
4 讨论
胃癌是一种高度异质性的疾病,即使在临床和病理特征相似的患者中,其结果也可能存在较大差异。肿瘤的复发和转移是影响生存率的主要因素之一。上皮间质转化[12]、相关信号通路激活[13]等已被公认为肿瘤复发和转移的关键因素。研究发现,中药在防治癌前病变、抑制胃癌的侵袭和转移、改善化疗不良反应等方面有良好的作用[14-17]。
恶性肿瘤细胞侵袭与转移的重要原因之一是肿瘤微环境中的细胞外基质(extracellular matrix,ECM)的降解和基底膜(basement membrane,BM)的破坏[18]。基质金属蛋白酶(matrix metalloproteinases,MMPs)在许多生物过程中具有重要作用,包括细胞增殖、迁移和分化、血管生成及ECM重塑等。在肿瘤微环境中,MMPs以酶原形式分泌,在各种蛋白酶作用下裂解为活性形式,激活后形成的明胶酶类MMPs可降解肿瘤细胞ECM的主要成分,使肿瘤细胞沿缺失的BM向周围组织浸润[19-20]。MMP2、MMP9是MMPs家族中两个重要组成因子,已有研究表明,其与胃癌的侵袭、转移关系密切[21]。EMT是上皮细胞上皮样特征减少并获得间充质细胞特性的生理过程,是肿瘤细胞侵袭转移所必要的初始步骤[22-23]。E-cadherin是上皮细胞的标志分子,Ncadherin和Vimentin是间质细胞的标志分子,它们共同作用下,可减少细胞间黏附、增加细胞的转移[24]。MMPs与EMT的关系密切,MMPs是间质细胞的标志性蛋白之一,是EMT发生的标志,当细胞微环境中MMPs表达异常时可诱导EMT的发生[25-26]。ERK/MAPK信号通路在控制细胞的生长、发育、分裂和死亡等各种生理过程中起重要的作用,是调控细胞生长、发育和分裂的信号网络核心[27]。有研究表明,ERK在人多种肿瘤细胞中高表达,如乳腺癌、胃癌、肠癌等,说明ERK/MAPK信号通路在肿瘤的侵袭转移中起重要作用[28-29]。
本研究通过划痕实验及细胞迁移实验验证了COE可显著抑制胃癌细胞侵袭与转移的作用。Western Blot结果显示,CEO可下调MMP2和MMP9蛋白表达,从而降低人胃癌MKN45细胞侵袭和转移能力,同时也可上调E-cadherin、下调N-cadherin、Vimentin蛋白表达,进而抑制胃癌细胞的侵袭转移。提示COE可抑制ERK/MAPK信号通路来抑制人胃癌细胞的侵袭与转移。
综上,本研究表明COE可抑制胃癌MKN45细胞侵袭与转移,其作用机制可能与直接下调MMP2和MMP9蛋白,激活ERK/MAPK信号通路有关。本实验揭示了COE抗胃癌侵袭、转移的可能作用机制,为抗胃癌转移的新中药开发提供了理论依据。但是,目前还没有充分的研究,故需要进行体内实验进一步论证。
