纸片协同试验用于肠杆菌科细菌碳青霉烯酶检测的价值
2021-06-19张逸朱钱迎张青陈霜夏菲戴其锋钱定良
张逸 朱钱迎 张青 陈霜 夏菲 戴其锋 钱定良
碳青霉烯酶是指可以水解碳青霉烯类抗菌药物如美罗培南(MEM)和亚胺培南的一类β-内酰氨酶,它包括Ambler分子结构分类的A、B、D三类酶。其中A类酶、D类酶为丝氨酸酶,B类酶为金属酶,A类酶的活性可以被硼酸类化合物所抑制;B类酶分布广泛,活性可被乙二胺四乙酸钠(EDTA)所抑制;D类酶主要为OXA型碳青霉烯酶[1],其活性不被酶抑制剂和EDTA抑制。近年来,耐碳青霉烯类肠杆菌科细菌(carbapenem-resistant Enterobacteriaceae,CRE)遍布全球,由于逐年升高的检出率和高归因死亡率,已构成了重大的公共卫生威胁[2]。CRE对碳青霉烯类药物的耐药机制分为两类:一为产碳青霉烯酶,二为一些非产酶的机制,产碳青霉烯酶是CRE最常见的耐药机制,且已有文献证实产碳青霉烯酶肠杆菌科细菌(carbapenemase-producing Enterobacteriaceae,CPE)比非产碳霉烯酶肠杆菌科细菌毒性大、预后差、易传播且病死率高[3],因此,临床需要一种快速、准确的方法来检测碳青霉烯酶并区分类型而指导临床用药。本研究参考2017年欧洲药敏试验委员会(EUCAST)推荐的碳青霉烯酶表型检测试验,以PCR耐药基因序列分析为金标准,评估纸片协同试验用于CPE检测的价值。
1 材料和方法
1.1 菌株来源 收集2015年1月至2018年12月瑞安市人民医院从各种临床标本中分离非重复送检的可疑CPE共75株,其中肺炎克雷伯菌51株,大肠埃希菌17株,阴沟肠杆菌3株,霍氏肠杆菌1株,产气肠杆菌1株,产酸克雷伯菌1株,布氏柠檬酸杆菌1株;来自血液24株(32.0%),尿液20株(26.7%),痰液12株(16.0%),其他无菌体液胸腹水、胆汁、分泌物等19株(25.3%)。来自男性患者54株(占72.0%),女性患者21株(占28.0%),患者平均年龄64岁。同时选取非CPE 10株作为阴性对照组。
1.2 主要试剂与仪器 Vitek 2 Compact全自动微生物鉴定药敏仪、Vitek-MS及其配套板卡购自法国生物梅里埃公司;PCR扩增仪、凝胶成像仪和电泳仪购自美国Bio-Rad公司;PCR扩增试剂盒购自上海生工生物有限公司;2×Taq Master Mix及DNA marker购自上海生工生物有限公司;50×TAE、琼脂糖、GoldViewTM核酸染料购自上海赛百威基因技术有限公司;苯基硼酸(PBA)购自美国Sigma公司;氯唑西林购自上海抚生实业有限公司;EDTA购自上海生工生物有限公司;MEM纸片(10 μg)、哌拉西林-他唑巴坦(TZP)纸片(110 μg)购自英国Oxid公司;替莫西林纸片(30 μg)购自意大利Liofilchem公司;哥伦比亚血琼脂平板、M-H培养基购自广州迪景微生物科技有限公司;引物由上海生工生物有限公司合成。
1.3 方法
1.3.1 菌株筛选、鉴定及药敏 将收集到的菌株进行MEM、TZP纸片扩散法,药敏结果参照CLSI2017年标准。根据EUCAST指南,MEM抑菌圈直径<28 mm(除外25~27 mm且TZP敏感或中介)为可疑CPE(流程见图1)。所有筛选出的CPE菌株均采用法国梅里埃公司ViteK MS质谱仪进行菌株鉴定并采用Vitek2 Compact微生物分析仪进行药敏试验。药敏试验所用质控菌株为大肠埃希菌ATCC25922,由中国疾病预防控制中心提供。

图1 CPE检测流程图(1:没有协同,也可能是菌株体内存在几种碳青霉烯酶,此时需要分子方法;2:MBL为B类金属酶;3:替莫西林高水平耐药是MIC>128 mg/L,或抑菌圈≤10 mm。这是OXA-48的表型标志;4:R代表耐药;5:S代表敏感)
1.3.2 碳青霉烯酶耐药基因的检测 35℃培养24 h复苏待测菌株,用煮沸法提取细菌基因组DNA待用。采用PCR扩增法扩增碳青霉烯酶基因(blaKPC、blaVIM、blaIMP、blaNDM-1、blaOXA-48)、ESBL 基因 (blaCTXM-1、blaCTX-M-9)、AmpC 酶基因(blaDHA、blaEBC)。所用引物序列及退火温度见表1。PCR扩增产物经1.2%琼脂糖凝胶电泳,凝胶成像系统成像并记录。

表1 耐药基因PCR引物
1.3.3 碳青霉烯酶表型确认试验
1.3.3.1 抑制剂纸片的制备 用打孔器制作直径6 mm的圆形滤纸,分装、高压灭菌备用。取PBA 60 mg溶解于1.5 ml的二甲基亚砜中,加入1.5 ml蒸馏水,配成20 mg/ml的溶液[4];取氯唑西林75 mg溶解于1 ml蒸馏水中,配成75 mg/ml的溶液[5];称取3.72 g EDTA-Na2加入200 ml的干净烧杯中,加入75 ml蒸馏水,边搅拌边用氢氧化钠调pH至8.0,定容至1 000 ml,配成浓度为0.1 mmol/L的溶液[6],配置完成后,均高压灭菌后备用。将20 mg/ml PBA、75 mg/ml氯唑西林、0.1 mmol/L EDTA各取10 μl分别滴加于空白纸片制成抑制剂纸片,干燥30、60 min内使用。
1.3.3.2 纸片协同试验 根据CLSI指南进行纸片药敏试验,挑取血平皿上35℃培养18~24 h的待测菌落,用无菌生理盐水制备成0.5麦氏浊度的菌悬液;将菌悬液均匀涂布于MH琼脂平皿上,静置10 min待干燥;每个接种受试菌的MH平板平均分成两部分,其中一部分贴上MEM纸片,在MEM纸片左右两侧贴上PBA、氯唑西林纸片,与MEM纸片距离均为1~2 cm,另一部分MEM纸片周边贴EDTA纸片,与MEM纸片距离为1~2 cm;当结果显示PBA和EDTA协同试验均无协同作用时,再进行替莫西林纸片扩散法。MEM抑菌圈靠近抑制剂纸片一侧明显扩大者为阳性,协同试验的结果判读标准见表2。
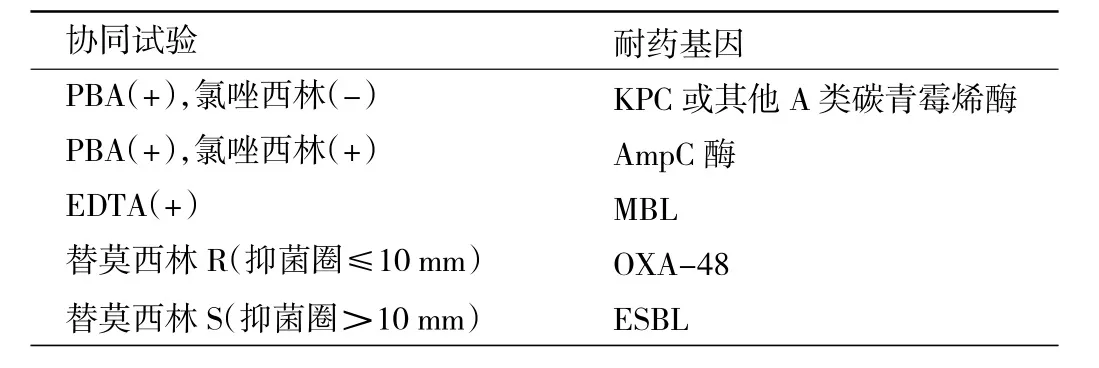
表2 PBA、氯唑西林、EDTA协同试验和替莫西林纸片扩散结果判定
1.4 统计学处理 采用SPSS 22.0统计软件。以PCR结果为金标准,计算PBA协同试验、EDTA协同试验检测碳青霉烯酶的灵敏度、特异度、准确度、阳性预测值和阴性预测值,分别与基因检测结果进行Kappa一致性检验分析:Kappa值>0.75,说明两种方法诊断结果一致性较好;Kappa值在0.4~0.75,说明一致性一般;Kappa值<0.4,说明一致性较差。P<0.05为差异有统计学意义。
2 结果
2.1 菌株药敏试验结果 可疑CPE对大部分β-内酰胺类药物呈高度耐药,耐药率接近100.0%,对阿米卡星的耐药率为48.0%。不同菌属中CPE菌株对不同抗菌药物的耐药率见表3。10株非CPE中大肠埃希菌8株,阴沟肠肝菌2株,对亚胺培南均敏感,对厄他培南的耐药率为30.0%。
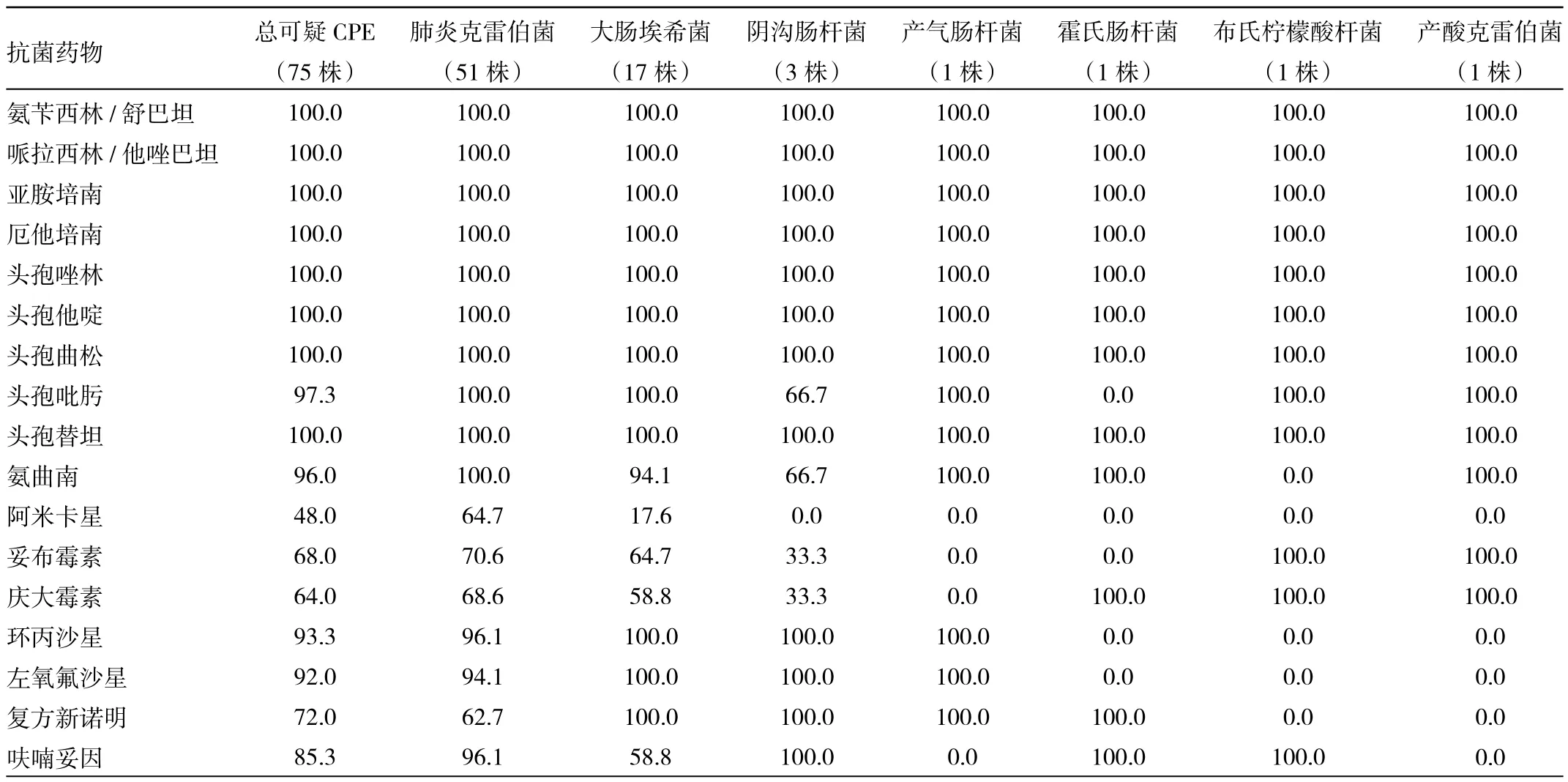
表3 75株可疑CPE对抗菌药物的耐药率(%)
2.2 耐药基因的检测结果 75株可疑CPE经PCR扩增,共检出66株产碳青霉烯酶(其中产KPC 46株,产NDM-1 18株,产IMP 1株,产VIM 1株,无产OXA-48基因型),6株产超广谱 β-内酰胺酶(ESBLs)(CTX-M-1 1株,CTX-M-1+CTX-M-1 2株,CTX-M-9 3株),3株未检测出基因。部分电泳结果见图2-3;10株非CPE均未检出碳青霉烯酶耐药基因。

图2 NDM-1和KPC基因部分电泳图(M为分子量标准,7、14分别为NDM-1和KPC基因的阳性对照,6、13分别为NDM-1和KPC基因的阴性对照)

图3 VIM和IMP基因部分电泳图(M为分子量标准,7、14分别为VIM和IMP基因的阳性对照,6、13分别为VIM和IMP基因的阴性对照)
2.3 纸片协同试验检测结果 依据上述方法中介绍的判定依据,纸片协同试验部分结果见图4,性能评价见表4~6。PBA协同试验阳性菌株有48株,氯唑西林协同均阴性,结合PCR的结果有1株阴沟肠杆菌和1株大肠埃希菌未检测出耐药基因,结果显示假阳性。对KPC碳青霉烯酶的检测,PBA协同试验灵敏度为100.0%(46/46),特异度为93.1%(27/29),准确度为97.3%(73/75),阳性预测值为 95.8%(46/48),阴性预测值为100.0%(27/27),Kappa值为 0.943(P<0.001),提示与基因检测结果一致性高。对于B类碳青霉烯酶的检测,EDTA协同试验阳性菌株有20株,PCR结果也为20株,灵敏度和特异度均为100.0%,准确度为100.0%,阳性预测值为100.0%,阴性预测值为100.0%,Kappa值为1(P<0.001),与基因检测结果一致性较好。10株非CPE中,纸片协同试验均阴性。
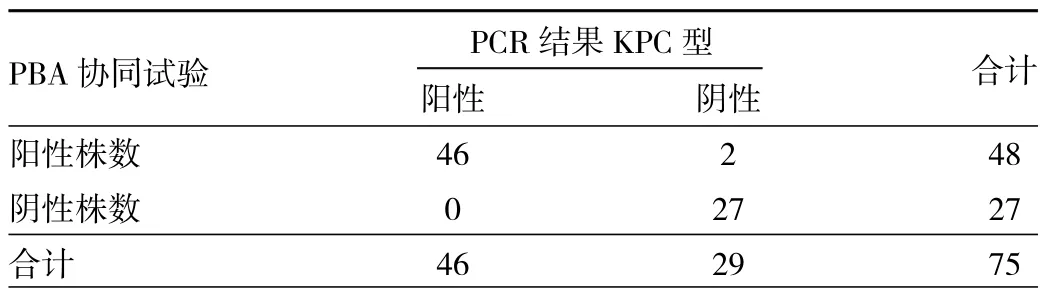
表4 PBA协同试验检测肠杆菌科KPC型碳青霉烯酶(株)
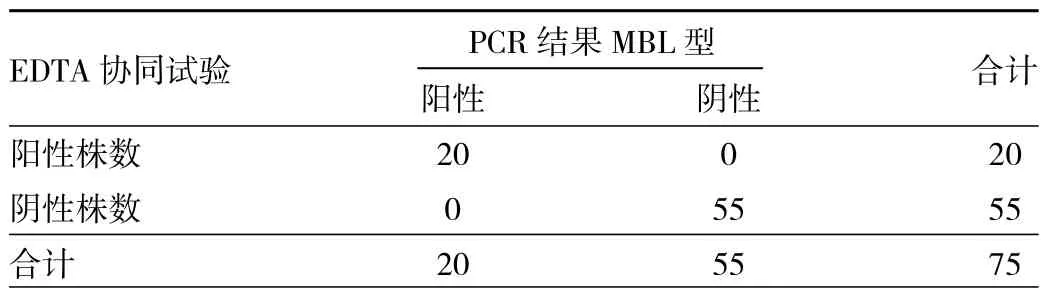
表5 EDTA协同试验检测肠肝菌科MBL(株)

表6 纸片协同试验用于CPE检测的整体性能评价

图4 纸片协同试验表型结果(a:产NDM-1型大肠埃希菌;b:产KPC型肺炎克雷伯菌;c:产CTX-M型大肠埃希菌)
3 讨论
自1993年首次在阴沟肠杆菌科细菌中发现由染色体编码的NmcA碳青霉烯酶以来,CRE在世界范围内广泛出现,其主要机制是产碳青霉烯酶,这种酶现多由质粒介导,容易在细菌间传播[7]。CPE的流行传播给临床治疗和感染控制带来极大的挑战,故快速准确检测CPE对有效控制感染、预防产酶菌株传播有重要的价值。基于PCR检测方法成本高,操作复杂及需要专业的仪器和技术人员,更重要的是,该法无法检测出新的碳青霉烯酶基因,故临床应用受到限制。本研究采用碳青霉烯酶表型检测方法,该法操作简便、成本低且能够有效地区分不同类型的碳青霉烯酶,可以更好地指导临床对抗菌药物的选择,对临床治疗和感染控制具有重大意义。
PBA和氨基苯硼酸(APBA)协同试验均能检测出产A类碳青霉烯酶肠杆菌科细菌,但有研究表明PBA对产KPC等A类酶的检测性能要优于APBA[8]。本研究使用200 μg PBA进行PBA协同试验,可检测出所有产KPC肠肝菌科细菌,灵敏度达100.0%,有2株分离菌株出现假阳性结果,可能与试验只扩增了KPC基因,并未对其他A类碳青霉烯酶如GES、IMI、SIM等进行研究有关。此外PBA协同试验在产AmpC合并孔蛋白缺失菌株中也能出现阳性,有研究表明,使用氯唑西林(AmpC酶抑制剂)可区分两者[7-9]。
对于产MBL(即B类金属酶)肠肝菌科细菌,EDTA协同试验灵敏度和特异度均达到100.0%,这与Teethaisong等[10]研究结果一致。Giske等[11]研究发现吡啶二羧酸对产MBL肺炎克雷伯菌的检测特异度要高于EDTA,灵敏度相似,本研究中EDTA协同试验特异度达100.0%,但本研究的阳性例数不多,在今后还将继续研究。此外,有研究报道纸片协同试验对于检测同时存在KPC和MBL的菌株,结果会出现假阴性,只有在纸片上同时滴加PBA和EDTA时才出现阳性结果[12],但由于本研究收集的菌株均为单个产KPC或MBL,所以对该结论还有待进一步研究。
有研究报道替莫西林抑菌圈直径≤10 mm且MEM与EDTA或PBA无协同作用可检测出所有产OXA-48肠杆菌科细菌,灵敏度和特异度均达100.0%[10,13]。本研究所收集的75株肠杆菌科细菌均未检测到OXA-48,主要是因为这类碳青霉烯酶在国内非常罕见,迄今为止,中国所报道OXA阳性的CRE不到50株[14-15]。故无法对该方法进行评价。
协同试验与目前微生物实验室常用的改良Hodge试验相比,特异度更高,研究指出改良Hodge试验对高产Ampc酶或CTX-M类型ESBL的肠肝菌科细菌容易产生假阳性[15-17];与Carba NP、mCIM及MALDI-TOF质谱分析法相比,灵敏度和特异度相差不大。但目前没有可用的表型检测方法被证明是完全具有灵敏度和特异度[18],要根据每个实验室的流行病学情况和可用资源选择合适的方法。
综上所述,PBA和EDTA协同试验对于检测产A类和B类碳青霉烯酶肠杆菌科细菌来说是一种方便、经济、准确的表型确认试验,并且操作简便、成本低,适合在临床微生物学实验室、医院感染管理科及疾病预防控制中心等单位普及应用。
