失巢环境下肿瘤源性外泌体调控结肠癌细胞的增殖和凋亡相关机制研究
2021-06-19金霞云柴华朱忠权李晓飞蓝志坚
金霞云 柴华 朱忠权 李晓飞 蓝志坚
1 材料和方法
1.1 材料 结肠癌细胞系SW480由中国科学院上海生命科学研究院生物化学与细胞生物学研究所惠赠。改良 Eagle培养基(DMEM)培养液(批号:10829018,500 ml)购自美国 Gibco公司;Trizol试剂(批号:10296028,100 ml)和荧光定量 PCR试剂盒(批号:KK4611,10 ml)均购自日本 TaKaRa公司;CCK-8试剂盒(批号:AC11L113,1ml)、Edu试剂盒(批号:KTA2031,500T)和 AVPI检测试剂盒(批号:40302ES20,200T)均购自北京碧云天试剂公司。细胞外信号调节激酶5(ERK5)抗体(批号:ab196609,100 μl)、凋亡相关因子 B 淋巴细胞瘤-2 基因(Bcl-2)(批号:ab117115,100 μl)、B淋巴细胞瘤-2基因相关启动子(Bad)(批号:ab90435,100 μl)和半胱氨酸蛋白酶-3(Caspase-3)(批号:ab13847,50 μl)均购自美国 Abcam 公司。polyHEMA试剂(批号:P3932,10G)购自瑞禧生物有限公司。
1.2 结肠癌抗失巢凋亡细胞株的获取 采用95%乙醇溶液配置浓度为10 mg/ml的polyHEMA试剂。37℃水浴箱预热处理,充分溶解polyHEMA试剂,然后将工作液均匀铺在细胞培养板表面,形成表面的包被膜,然后置于65℃烤箱烘干。利用紫外线灯进行消毒处理以备用。待结肠癌细胞的融合率达80%时,利用EDTA胰蛋白酶收集细胞,制备细胞悬液。按照1×105个/ml的细胞量接种于低黏附六孔板中,置于37℃、5% CO2的细胞培养箱中,培养3 d后收集悬浮的结肠癌细胞,5 000 r/min,离心5 min,弃上清液,加入PBS溶液,制备单细胞悬液。按照1×105个/ml的细胞量接种于低黏附六孔板中,置于37℃、5% CO2的细胞培养箱中进行培养。如此反复培养7次后,最终获得结肠癌的抗失巢凋亡细胞株。于悬浮培养12 h和24 h后利用显微镜下观察抗失巢凋亡细胞株。
1.3 细胞凝集能力检测 选取常规结肠癌细胞和抗失巢凋亡细胞株制备细胞悬液,按照1×105个/ml接种于低黏附六孔板中,置于37℃、5% CO2的细胞培养箱中,6 h后利用光学显微镜观察细胞的凝集团细胞数量,计算凝集率,凝集率=视野下凝集细胞数/(视野下凝集细胞+单个细胞)×100%。
1.4 外泌体的提取 采用超速离心法收集抗失巢凋亡细胞和常规结肠癌细胞的外泌体。将抗失巢凋亡细胞和常规结肠癌细胞处理24 h后,弃上清液,利用PBS溶液清洗3次,更换无FBS的DMEM培养基,孵育48 h,收集细胞上清液,4℃、300 r/min,离心10 min,弃掉细胞碎片,收集上清液后再次离心,4℃、2000r/min,离心20 min,取上清液弃沉淀,重悬后经0.22 μm滤器过滤,转移至超速离心管中,4℃、10 000 r/min,离心70 min,取沉淀。PBS冲洗沉淀物,4 ℃、10 000 r/min,离心 70 min,重复3次,将得到的外泌体悬液于-80℃冰箱中保存。
1.5 透射电镜观察外泌体形态 取30 μl外泌体悬液,放置于栽样铜网上,室温下静置3 min,加入3%磷钨酸溶液30 μl,室温下负染 5 min,室温下孵育直至铜网干燥,然后透射电镜观察外泌体形态。
1.6 外泌体标志物CD63和CD81表达的检测 采用Western blot法。将100 μl外泌体置于EP管中,利用1 ml PBS溶液进行稀释,冰上预冷10 s,加入RIPA裂解液后,提取总蛋白,利用BCA试剂盒确定蛋白浓度。按照SDS-PAGE说明书要求配置10%分离胶和5%浓缩胶,加入分离胶后加入分子梳。取30 μg蛋白质上样,先使用80 V电压进行电泳,待条带跑至浓缩胶和分离胶的交接点后,改为120 V电压。待条带跑至分离胶底部,停止电泳。利用PVDF膜和滤纸进行转膜,设置转膜电流为200 mA,转膜槽放至冰袋中低温处理。转膜成功后浸入封闭液中,摇床封闭2 h,加入CD63和CD81一抗稀释液(1:10 000),4℃ 孵育过夜,TBST溶液清洗3次,5 min/次,加入稀释好的 HRP二抗溶液(1:2 000),孵育二抗,TBST溶液清洗3次,5 min/次,加入Supersignal west femto试剂盒显影液,分光发光成像分析仪显影,出现蛋白条带则为阳性。
1.7 结肠癌细胞摄取及内化外泌体 将超速离心法提取的外泌体沉淀与1 ml的PBS溶液混合,利用超声搅拌器重悬后保存。将4 μl的PKH67加入0.5 ml混悬液中,在室温下孵育10 min。然后加入1 ml的10%BSA溶液,利用PBS溶液清洗3次,5 min/次。然后利用超速离心法收集PKH67标记的外泌体以备用。将结肠癌细胞接种于预先铺有盖玻片的24孔板中,接种细胞量为3×105个/孔,待爬片细胞融合率>60%时,利用PBS溶液清洗3次,5 min/次。然后加入0.5 ml PKH67标记的外泌体混悬液,放置在37℃、5% CO2的细胞培养箱中培养24 h,再采用4%多聚甲醛溶液固定30 min,加入红色CY3染液进行细胞染色,避光孵育20 min后利用PBS溶液清洗3次,5 min/次。再利用10 μg/ml的DAPI染液进行染色,避光孵育15 min。利用PBS溶液清洗3次,5 min/次。利用指甲油封片,加入防淬灭剂。利用荧光显微镜进行观察。
包容性:中原文化具有兼容众善、合而成体的特点。中原文化通过经济、战争、宗教、人口迁徙等众多方式,实现了物质文化、制度文化和思想观念的全面融合与不断升华。郑州大河村遗址中出土的一些富有山东大汶口文化特征的陶器,说明中原文化在那时就开始吸收周边文化成果,熔铸到自己的文化之中。胡服、胡乐、胡舞、胡食在汉唐间传入中原,也都被吸收到中原文化之中。
1.8 细胞行为学检测
1.8.1 细胞增殖率检测 采用CCK-8法。将100 μl的外泌体悬液分别加入常规结肠癌细胞和抗失巢凋亡结肠癌细胞中,在同一培养瓶中进行共培养,待细胞融合率>50%后,将上述两组细胞接种于96孔板中,100 μl/孔,在37℃、5% CO2的培养箱中培养5 h,然后每孔加入100 μl CCK-8试剂,37℃培养箱中孵育10 min,酶标仪测定在450 nm处的吸光度(OD值)。检测处理4、8、12、24 h后各组细胞的增殖率,细胞增殖率=[(As-Ab)/(Ac-Ab)]×100%(As为实验孔 OD 值,Ac为对照孔 OD值,Ab为空白孔OD值)。
1.8.2 细胞增殖检测 采用EdU法。外泌体与结肠癌细胞共培养后,接种于预先铺有玻璃片的96孔板中,100 μl/孔,在 37 ℃、5% CO2的培养箱中培养 24 h 后,加入50 μM的EdU试剂。避光孵育24 h后利用PBS溶液进行清洗3次,5 min/次。加入100 μl的4%多聚甲醛溶液,室温条件下孵育30 min,利用PBS溶液进行清洗,5 min/次。加入 100 μl的 0.5% TritonX-100,用于对细胞膜的渗透。用PBS溶液清洗3次,5 min/次。加入100 μl的20%DAPI染液进行核染处理。荧光显微镜下进行观察细胞增殖情况,计算细胞增殖率,细胞增殖率=视野下Edu染色阳性/视野下DAPI染色阳性×100%。
1.8.3 细胞凋亡检测 采用双染法细胞凋亡检测试剂盒(AnnexinV FITC-PI,AV-PI)检测细胞凋亡。外泌体与结肠癌细胞共培养后,利用EDTA蛋白酶收集各组细胞,预冷PBS溶液清洗3次,5 min/次,300 r/min离心后取细胞沉淀,加入100 μl Bingding buffer进行重置,然后根据AV-PI试剂盒说明书要求加入5 μl Annexin VFITC和10 μl PI染液。避光孵育30 min后,利用流式细胞仪进行检测细胞凋亡,结果包括四个象限:Q1:坏死细胞区;Q2:晚期凋亡细胞区;Q3:早期凋亡细胞区;Q4:活细胞区。细胞凋亡率=早期凋亡+晚期凋亡(Q2+Q3)。
1.8.4 ERK5和凋亡相关基因Bcl-2、Bad和Caspase-3 mRNA表达的检测 采用RT-PCR。外泌体与结肠癌细胞共培养后,利用胰蛋白酶收集上述各组细胞,经PBS溶液清洗3次,5 min/次,常温离心机1 500 r/min离心5 min,取沉淀,加入1 ml Trizol溶剂,提取细胞总RNA,保证RNA纯度范围为1.8~2.1,然后利用逆转录试剂盒的要求,采用20 μl反应体系逆转录为cDNA,-80℃保存,采用RT-PCR试剂盒的要求,采用FTC-2000 RTPCR系统和50 μg反应体系对样本DNA进行分析,溶解曲线确定Tm值为53.7℃,统计并记录各组样本的CT 值,采用 2-ΔΔCt法对 ERK5 和凋亡相关基因 Bcl-2、Bad、Caspase-3 mRNA的表达水平进行统计。引物设计由上海生工公司设计,见表1。

表1 ERK5和凋亡相关基因Bcl-2、Bad、Caspase-3的引物序列
1.8.5 ERK5和凋亡相关因子Bcl-2、Bad和Caspase-3蛋白表达的检测 采用Western blot法。外泌体与结肠癌细胞共培养后,收集各组细胞,加入1 ml RIPA细胞裂解液,各组细胞在冰上裂解30 min,收集入1.5 ml的离心管中,在预冷4℃的离心机中离心,预设:5 000 r/min,5 min后提取上清液,经95℃煮沸后,收集蛋白备用。按照说明书制备浓缩胶10 ml,分离胶20 ml。上样后电泳分离,转膜后在4℃冰箱避光孵育过夜(>12 h)。ERK5和Bcl-2、Bad、Caspase-3一抗经一抗稀释液1:5 000稀释后加入样本离子膜。第2天用PBST稀释液洗膜,重复3次,加用山羊抗小鼠IgG二抗经二抗稀释液1:1 000稀释后孵育二抗1.5 h,用PBST稀释液洗膜,重复3次,而后用DAB显影液处理样本。采用Image J软件分析蛋白条带的灰度值进行蛋白表达水平的统计和分析。
1.9 统计学处理 采用SPSS 21.0统计软件。计量资料以表示,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 失巢环境下结肠癌细胞的培养结果 结果显示,利用悬浮细胞培养法可以培养失巢环境下的抗失巢凋亡细胞,并且随着培养时间的延长,可见细胞凝集成团。见图1(插页)。

图1 失巢环境下结肠癌细胞的培养结果(a:贴壁培养中的结肠癌细胞;b:悬浮培养12 h后结肠癌细胞;c:悬浮培养24 h后结肠癌细胞)
2.2 两组细胞凝集能力的比较 结果显示,抗失巢凋亡结肠癌细胞组细胞凝集率为(68.15±4.89)%,常规结肠癌细胞组为(23.21±3.46)%,抗失巢凋亡结肠癌细胞组细胞凝集能力要明显高于常规结肠癌细胞,差异有统计学意义(P<0.05),见图 2(插页)。
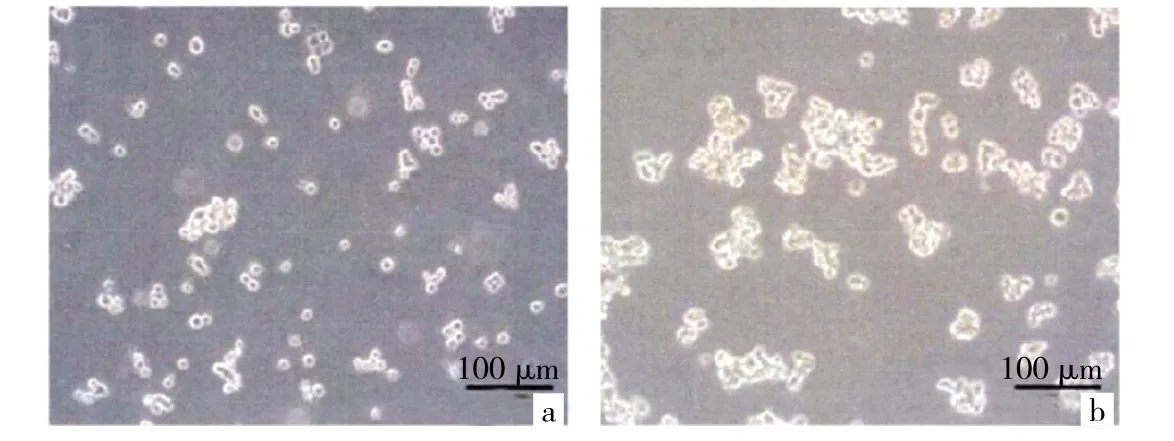
图2 抗失巢凋亡细胞的凝集能力检测(a:常规结肠癌细胞组的凝集率检测;b:抗失常凋亡结肠癌细胞组的凝集率检测)
2.3 失巢环境培养下结肠癌细胞的外泌体鉴定结果 结果显示,外泌体为直径50~150 nm的双层膜囊泡状结构。Western blot结果显示,外泌体的分子标志物CD63和CD81表达阳性。见图3。

图3 失巢环境培养下结肠癌细胞外泌体鉴定结果(a:电子显微镜下常规结肠癌细胞来源外泌体和抗失巢凋亡结肠癌细胞来源外泌体的形态,×800;b:常规结肠癌细胞来源外泌体和抗失巢凋亡结肠癌细胞来源外泌体中CD63和CD81的表达)
2.4 结肠癌细胞摄取及内化PKH67标记的外泌体鉴定结果 结果显示,失巢环境下提取的外泌体与结肠癌细胞共培养的过程中,可见结肠癌细胞可以摄取并内化PKH67标记的外泌体。见图4(插页)。

图4 结肠癌细胞摄取及内化PKH67标记的外泌体鉴定结果(a:结肠癌细胞染色;b:绿色PKH67标记的外泌体;c:合并图层)
2.5 两组细胞增殖率的比较 结果显示,处理4、8、12、24 h后,抗失巢凋亡结肠癌细胞来源外泌体与结肠癌细胞共培养后细胞的增殖率明显高于常规结肠癌细胞组(均 P<0.05),见表 2。

表2 两组细胞增殖率的比较(%)
2.6 两组细胞增殖能力的比较 结果显示,抗失巢凋亡结肠癌细胞外泌体与结肠癌细胞共培养后细胞的增殖能力[(23.76±2.57)%]明显高于常规结肠癌细胞组[(9.04±0.32)%](P<0.05),见图5(插页)。

图5 Edu染色结果(a:常规结肠癌细胞组细胞的DAPI染色,Edu染色和合并图层;b:抗失巢凋亡结肠癌细胞组细胞的DAPI染色,Edu染色和合并图层)
2.7 两组细胞凋亡率的比较 结果显示,抗失巢凋亡结肠癌细胞组的凋亡率为(0.080±0.030)%,常规结肠癌细胞组的凋亡率为(0.253±0.121)%,抗失巢凋亡结肠癌细胞组细胞凋亡率明显低于常规结肠癌细胞组,差异有统计学意义(t=2.891,P<0.05),见图 6(插页)。

图6 AV-PI试剂盒检测结果(a:常规结肠癌细胞组的细胞凋亡率;b:抗失巢凋亡结肠癌细胞组的细胞凋亡率)
2.8 两组细胞ERK5和凋亡相关基因Bcl-2、Bad和Caspase-3的mRNA相对表达水平的比较 结果显示,抗失巢凋亡结肠癌细胞组的ERK5、Bad和Caspase-3的mRNA相对表达水平要明显低于常规结肠癌细胞组(均P<0.05),而抗凋亡因子Bcl-2高于常规结肠癌细胞组(P<0.05),见表 3。2.9 两组细胞ERK5和凋亡相关基因Bcl-2、Bad和Caspase-3的蛋白表达水平的比较 结果显示,抗失巢凋亡结肠癌细胞组的ERK5、Bad和Caspase-3的蛋白表达水平要明显低于常规结肠癌细胞组(均P<0.05),而抗凋亡因子Bcl-2高于常规结肠癌细胞组(P<0.05),见表4。
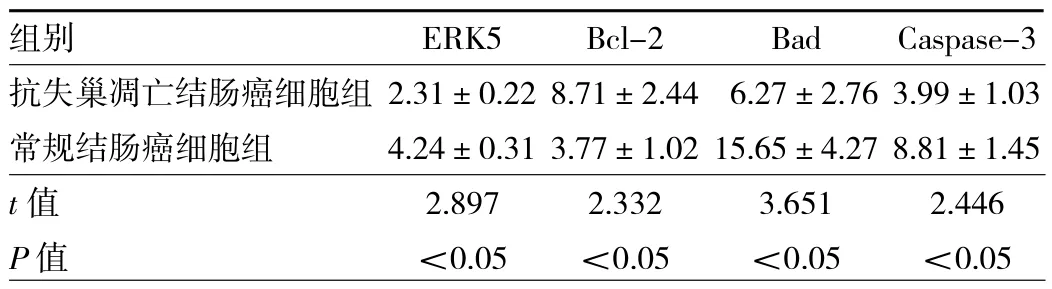
表3 两组细胞ERK5和凋亡相关基因Bcl-2、Bad和Caspase-3的mRNA相对表达水平的比较
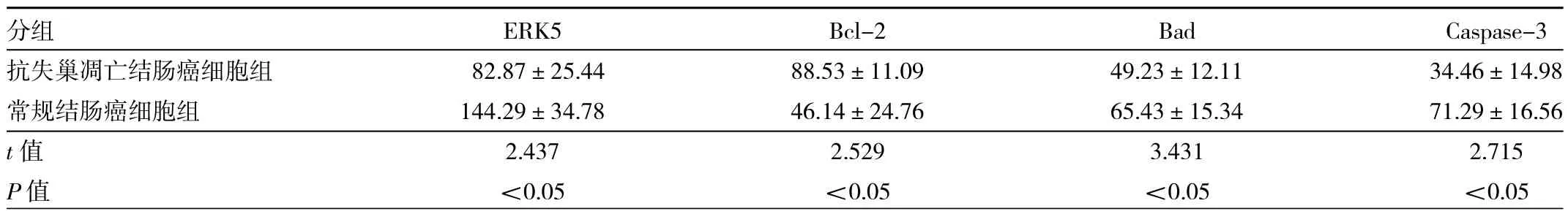
表4 两组细胞ERK5和凋亡相关基因Bcl-2、Bad和Caspase-3的蛋白相对表达量的比较(灰度值)
3 讨论
肿瘤的复发与多种因素密切相关,比如癌基因和抑癌基因的突变,细胞外基质的降解和免疫因素等[6-7]。但是,在肿瘤复发的过程中,肿瘤细胞会脱离原来的基质环境,失去基质黏附,处于失巢环境中,从而造成“失巢凋亡”[8-9]。既往研究表明,失巢环境中细胞凋亡率明显改变,姜黄素、藤梨根等对于结肠癌的干预作用正是通过干预其失巢环境来调控结肠癌的复发与耐药性[10-11]。外泌体是一类双层脂质结构的囊泡结构,可以由细胞分泌,携带大量的遗传物质,包括miRNA、lincRNA和各类基因等,通过膜融合和胞吞的方式,将遗传信息传递至受体细胞中,从而影响受体细胞的生物学行为[12-13]。有研究表明,肿瘤细胞和基底细胞之间可以通过外泌体进行遗传信息的交换[14]。因此,本研究主要目的是探究失巢环境来源的外泌体对结肠癌细胞生物学行为的影响,以期为结肠癌的临床治疗提供新的思路和靶点。
肿瘤微环境与肿瘤细胞的生物功能密切相关,肿瘤微环境的变化可以影响肿瘤细胞的增殖、凋亡和侵袭等。随着对肿瘤的进一步研究,肿瘤所处的微环境也逐渐引起学者的关注[15-16]。肿瘤的复发与肿瘤微环境密切相关,包括基质降解、肿瘤细胞游走和肿瘤细胞再黏附。而在基质降解、细胞游走的过程中,贴壁细胞会转变为悬浮细胞,造成“失巢”的微环境[17]。有研究表明,在失巢环境下,肿瘤细胞会发生聚集,并且对细胞凋亡的程序性启动产生一定的抵抗能力,叫做“抗失巢凋亡”[18]。直至细胞游走到新的附着环境中,然后重新附着后造成肿瘤的复发和转移[19]。本研究证明,利用95%乙醇溶液配置浓度为10 mg/ml的polyHEMA试剂,形成表面的包被膜,构建“失巢环境”,得到抗失巢凋亡细胞系。利用细胞凝集率检测细胞的凝集能力,结果表明,抗失巢凋亡结肠癌细胞的细胞凝集能力明显高于常规结肠癌细胞。与之前的研究结果相同。
外泌体是目前研究的热点问题,细胞与细胞之间、细胞与环境之间的交流可以通过外泌体携带相关的信号分子来实现。有研究表明,外泌体可以在细胞和微环境之间构建一条“桥梁”,可以将微环境中的相关信息通过外泌体传递到细胞内,也可以将细胞内的遗传信号通过外泌体传递到细胞周围微环境中,从而实现细胞与周围微环境的信号交流[20]。本研究结果显示,失巢环境下提取的外泌体与结肠癌细胞共培养的过程中,可见结肠癌细胞可以摄取并内化PKH67标记的外泌体,说明结肠癌可以内吞外泌体,从而发挥作用。本研究利用CCK-8试剂盒、Edu试剂盒和AV-PI试剂盒检测在常规结肠癌细胞外泌体和抗失巢凋亡结肠癌细胞外泌体的刺激下结肠癌细胞的增殖和凋亡能力,结果表明,抗失巢凋亡结肠癌细胞外泌体可以促进结肠癌细胞的增殖,抑制细胞的凋亡。
Bcl-2和Bad与凋亡密切相关的基因,其中,Bad是促凋亡因子,而Bcl-2是抑制凋亡因子。而且,Caspase-3蛋白有“死亡蛋白”的说法,Caspase-3的激活可以促进细胞的凋亡[21-22]。本研究通过RT-PCR和Western blot结果发现,缺氧环境中的外泌体可以从mRNA和蛋白两个层面上抑制凋亡相关因子Bad和Caspase-3的表达,促进抗凋亡因子Bcl-2的表达,结果说明,抗失巢凋亡结肠癌组外泌体可以抑制细胞的凋亡。本研究还利用AV-PI试剂盒检测细胞的凋亡率,结果发现,抗失巢凋亡结肠癌组外泌体可以抑制细胞的凋亡。另外,笔者发现,MAPK/ERK5的表达水平在抗失巢凋亡结肠癌组外泌体刺激下,其mRNA表达水平和蛋白表达水平均明显下降。所以,笔者推测,外泌体对细胞增殖和凋亡的调控是通过ERK5信号通路。既往研究表明,ERK5信号通路可以介导细胞的增殖和凋亡通路,与本研究结果相同。
综上所述,抗失巢凋亡结肠癌细胞外泌体可以通过ERK5信号通路促进细胞的增殖,抑制细胞的凋亡。
