猪肠道微生物对饲料源氨基酸消失率的影响
2021-06-19刘金艳饶泽斌唐志如
胡 红,刘金艳,曾 艳,李 洋,饶泽斌,胡 萍,唐志如*
(1.西南大学动物科学技术学院,生物饲料与分子营养实验室,重庆 400715;2.湖南省微生物研究院,湖南长沙 410000)
饲粮蛋白质的消化率受蛋白质来源的氨基酸组成浓度与蛋白质源一起食用的其他饲料的营养物质等多种因素影响[1]。蛋白质在动物体内被分解为氨基酸,肠道微生物起重要作用。研究表明,仔猪蛋白质消化率更多地取决于蛋白质来源的氨基酸组成[2]。不同蛋白质来源的饲料氨基酸和粗蛋白质(CP)含量与组成存在很大差异,常见几种物质的CP 含量较高,豆粕CP 含量为42%~50%,菜粕为32%~44%,鱼粉为50%~65%,棉粕为43%~53%,其中豆粕需求量较大。不同蛋白质饲料各有优势劣势,不同情况可选择性地使用不同蛋白质饲料,因此其他几类蛋白质原料也常作为豆粕的替代品[3-7]。动物肠道是蛋白质和氨基酸代谢的主要产所,肠道微生物对动物肠道的蛋白质和氨基酸代谢十分重要[8]。微生物对CP 的利用是一个分解与合成的动态过程,即蛋白质的分解和氨基酸合成蛋白质的变化过程。由于蛋白质饲料源结构组成的差异,虽然饲料中的CP 含量相同,但饲料源蛋白质的氨基酸组成不同,其代谢方式也有较大差异,这些差异会造成微生物对其蛋白及游离氨基酸利用的差异。因此,研究猪肠道微生物对不同饲料源氨基酸利用的差异性,对于氮源的选择及配制具有重要参考价值[9]。为消除动物宿主的影响,本试验所取样本为肠道内容物中的微生物而非黏膜微生物,采用体外试验研究猪不同肠段内容物微生物对豆粕、棉粕、菜粕、鱼粉的代谢及不同饲料源氨基酸消失率的差异性。
1 材料与方法
1.1 试验材料 谷草转氨酶(Glutamic-Oxalacetic Transaminase,GOT)、谷丙转氨酶(Glutamic-Pyruvic Transaminase,GPT)、腺苷脱氨酶(Adenosine Deaminase,ADA)生化试剂盒均购于南京建成生物工程研究所,化学试剂购于上海生工生物工程股份有限公司。厌氧基础培养基参照Dai 等[10]的方法进行配制。
1.2 试验方法 选取3 头30 kg 左右健康杜×长×大生长猪屠宰,无菌操作以获得50 mL 空肠、回肠和盲肠内容物;用500 mL 基础培养基(pH 7.3)反复清洗内容物5 次,梯度离心后得到菌悬液。在250 mL 玻璃瓶中加入180 mL 基础培养基,先取5 mL 空肠微生物菌悬液接种于250 mL 预热的培养基中,培养4 h 后取5 mL培养液用于测定氨基酸含量及酶活力;再加入5 mL 回肠微生物悬混液继续培养4 h 后,取5 mL 培养液用于测定氨基酸含量及酶活力;最后加入5 mL 盲肠微生物悬混液继续培养4 h 后,取5 mL 培养液用于测定氨基酸含量及酶活力。试验分为豆粕组(基础培养基+豆粕+微生物)、棉粕组(基础培养基+棉粕+微生物)、菜粕组(基础培养基+菜粕+微生物)、鱼粉组(基础培养基+鱼粉+微生物)4 个组;另设1 个负对照组(基础培养基+微生物)与3 个正对照组(基础培养基+豆粕,基础培养基+棉粕,基础培养基+菜粕,基础培养基+鱼粉),每组3 个重复。各组培养基的组成及含量见表1。根据食糜在体内的停留时间(空肠4 h,回肠4 h,盲肠4 h)设置各个肠段的培养时间。

表1 各组培养基的组成及含量 mg/mL
生长猪饲粮组成:玉米58.6%,豆粕29%,麦麸7.8%,豆油1.55%,L-赖氨酸.HCl 0.18%,L-苏氨酸 0.01%,磷酸一钙0.69%,石灰石0.87%,盐0.3%,预混料1%(预混料为每千克饲粮提供维生素A 1 353 IU、维生素B11.000 mg、维生素B22.400 mg、维生素B61.000 mg、维生素B128.100 μg、维生素D 156 IU、维生素E 11 IU、维生素K 0.520 mg、胆碱 0.310 g、生物素0.050 mg、叶酸0.310 mg、泛酸7.900 mg、烟酸31.200 mg、铜3.900 mg、铁57.100 mg、锰2.100 mg、锌 58 mg、碘 0.150 mg、硒 0.185 mg)总计100%。
1.3 氨基酸含量的测定
1.3.1 样品前处理 准确量取样品1 mL 于15 mm×150 mm试管中,向盛有样品的试管中加入6 mol/L 盐酸10 mL,振荡混匀。用酒精喷灯把该试管口下1/3 处拉细到4~6 mm,抽真空10 min 后封管。处理过的试管置(110±1)℃恒温烘箱中沙浴水解22 h,拿出冷却至室温,摇匀过滤,取1 mL 滤液于50 mL 烧杯中,用60℃恒温水浴蒸干滤液,用 0.02 mol/L 盐酸将其稀释6 倍,用0.22 μm 滤膜过滤上机分析。
1.3.2 分析条件 采用日立L-8800 型全自动氨基酸分析仪测定氨基酸含量。一个样品分析周期为53 min。分离柱:(4.6 mm×60 mm)洗脱液流速0.4 mL/min,柱温70℃,柱压12.627 MPa;反应柱:茚三酮及茚三酮缓冲液流速0.35 mL/min,柱温135℃,柱压1.078 MPa。
1.4 氨基酸脱羧酶与转氨酶的测定 色氨酸脱羧酶、赖氨酸脱羧酶、精氨酸脱羧酶、组氨酸脱羧酶、甘氨酸脱羧酶、酪氨酸脱羧酶的活性测定参照唐志如等[11]和赖星等[12]报道的方法进行。根据南京建成生物工程研究所的试剂盒说明,采用比色法结合紫外分光光度计,测定GOT(谷草转氨酶)、GPT(谷丙转氨酶)、ADA(腺苷脱氨酶)酶活力。
1.5 统计分析 采用SAS 9.0 统计软件对测量数据进行单因素方差分析和显著性检验,Microsoft Excel 2010进行数据整理。试验结果用平均标准误表示,P<0.05为差异显著。氨基酸消失率Dt计算公式如下[13]:
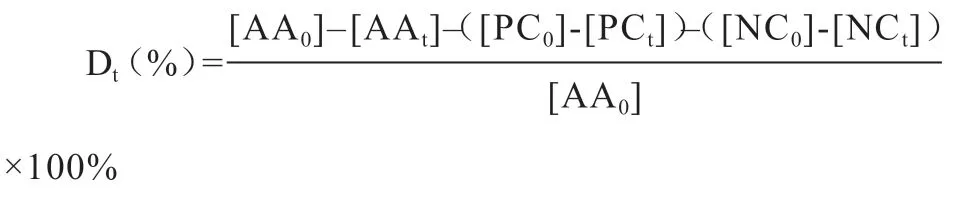
其中,Dt为t h 的氨基酸消失率,AA0为0 h 试验组氨基酸浓度,AAt为试验组t h 的氨基酸浓度,PC0为正对照组0 h 的氨基酸浓度,PCt为正对照组t h 的氨基酸浓度;NC0为负对照组0 h 的氨基酸浓度;NCt为负对照组t h 的氨基酸浓度。
2 结果
2.1 生长猪肠道微生物脱羧酶、转氨酶和脱氨酶对不同饲料源的响应规律 由表2 可知,接种空肠微生物培养4 h 后,菜粕组的色氨酸脱羧酶、赖氨酸脱羧酶、精氨酸脱羧酶、组氨酸脱羧酶、甘氨酸脱羧酶、酪氨酸脱羧酶和谷草转氨酶、谷丙转氨酶、腺苷脱氨酶酶活力均为最大。因此空肠微生物脱羧酶对不同饲料源的响应规律由高到低为菜粕、棉粕和鱼粉、豆粕。

表2 不同饲料源对肠道微生物酶活力的影响(n=3) U/mg prot
接种回肠微生物培养4 h 后,棉粕组的色氨酸脱羧酶、组氨酸脱羧酶、甘氨酸脱羧酶、谷草转氨酶、谷丙转氨酶、腺苷脱氨酶酶活力和鱼粉组的赖氨酸脱羧酶、精氨酸脱羧酶、甘氨酸脱羧酶、酪氨酸脱羧酶活力均为最大。因此回肠微生物氨基酸脱羧酶、转氨和脱氨酶对不同饲料源响应规律由高到低为棉粕和鱼粉、菜粕和豆粕。
接种盲肠微生物培养4 h 后,鱼粉组的组氨酸脱羧酶、甘氨酸脱羧酶、酪氨酸脱羧酶、谷草转氨酶和谷丙转氨酶活力均为最大。因此,盲肠微生物氨基酸脱羧酶和转氨和脱氨酶对不同饲料源响应规律由高到低为鱼粉和菜粕、棉粕和豆粕。
2.2 生长猪肠道微生物对不同饲料源的氨基酸消失率的利用规律 由表3 可知,在接种空肠微生物培养4 h 后,菜粕组氨基酸被微生物利用最大;菜粕组的苏氨酸、半胱氨酸、亮氨酸、苯丙氨酸、赖氨酸、组氨酸、脯氨酸的氨基酸消失率显著高于豆粕组;不同饲料源在空肠微生物作用下氨基酸消失程度从高到低表现为菜粕组、豆粕组、鱼粉组和棉粕组。

表3 猪肠道微生物对不同饲料源氨基酸消失率的影响(n=3) %

注:ND 代表没有消失。
接种回肠微生物培养4 h 后大部分氨基酸并未消失。不同饲料源在回肠微生物作用下氨基酸消失程度从高到低表现为棉粕组、鱼粉组、菜粕组和豆粕组。
接种盲肠微生物培养4 h 过后,各组氨基酸均出现大幅度消失。豆粕组天门冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、亮氨酸、酪氨酸、赖氨酸、组氨酸都显著低于其他3 组。而棉粕组可见除了半胱氨酸、缬氨酸、精氨酸外其他氨基酸都显著高于豆粕组而低于鱼粉组。除了半胱氨酸和精氨酸外,鱼粉组的其他氨基酸都显著低于菜粕组而高于棉粕组和豆粕组。除了半胱氨酸外,菜粕组的其他氨基酸消失率均在80% 以上,多数氨基酸消失率都是最高。总体上,各组空肠与回肠的氨基酸消失率较低,可见总氨基酸消失程度从高到低为菜粕组、鱼粉组、棉粕组、豆粕组。
整体可见,鱼粉组氨基酸在空肠微生物的作用下未消失,在回肠和盲肠微生物的作用下各氨基酸逐渐消失;豆粕组、棉粕组在盲肠微生物作用下氨基酸才开始消失;菜粕组氨基酸表现的规律为在空肠微生物作用下先消失,在回肠微生物作用后得到补偿,在盲肠微生物作用后又开始消失;不同饲料源在空肠和回肠微生物作用下氨基酸消失都较少,在盲肠微生物作用下大幅度消失。
3 讨 论
肠道微生物种群对饲料消化生物学过程有着极大影响,肠道微生物酶的差异源于微生物种群的差异[14]。本试验在体外进行,不考虑机体与微生物及物质的互作,只考虑微生物与营养物质的代谢互作,结果表明酶活力大小与氨基酸消失率存在一定关联,空肠微生物作用后的菜粕、回肠微生物作用后的棉粕组、盲肠微生物作用后的鱼粉组和菜粕组的各种酶活性与氨基酸消失率最大;整体可见不同肠道微生物作用下各组氨基酸消失率由高到低均为盲肠微生物、空肠微生物、回肠微生物,这与胡红等[23]研究得到的不同肠段大豆蛋白组的氨基酸消失率由高到低为盲肠微生物、空肠微生物、回肠微生物结果一致。刘艺端等[15]研究认为,在体外培养条件下,空肠和回肠微生物具有相似的发酵规律。本试验中空肠与回肠的氨基酸消失率在各个组都很低,与刘艺端等[15]研究结果存在一致性。赖星等[12]发现,饲粮粗蛋白质水平显著影响肠道微生物酶的活力,这是肠道微生物对氨基酸差异性降解和动物对蛋白质利用率低的原因之一;另外,邓欢等[16]研究发现,肠道微生物的蛋氨酸、组氨酸、赖氨酸、精氨酸、甘氨酸、酪氨酸、色氨酸、谷氨酸脱羧酶活力对饲粮高CP 水平响应明显,这些都证明酶活力与蛋白质及氨基酸代谢的密切关系,为本试验测定的相关酶活力指标提供有效参考。本试验也证明,微生物酶活力与氨基酸消失率存在一定联系,酶活力越大其代谢活动越强,但由于酶活力受环境条件影响较大,在不同肠道内pH[17]等条件不同会影响酶活力,从而形成不同氨基酸消失率。另一方面比较氨基酸的消失率与酶活力,可见在空肠与回肠中有大量氨基酸都未检测到其消失率,但依然能检测到微生物酶活力,说明氨基酸的消失率为0 并不代表没有氨基酸的代谢,氨基酸的合成大于或等于分解。
Dai 等[10]研究体外培养猪小肠微生物对氨基酸的利用中表明,在十二指肠、空肠或回肠中,赖氨酸、精氨酸、苏氨酸、谷氨酸、亮氨酸、异亮氨酸、缬氨酸和组氨酸在24 h 后消失率为50%~90%,而本结果中整体可见氨基酸在盲肠微生物加入后消失率最高,其原因可能是Dai 等的试验中只加入了游离氨基酸无其他可利用的氮源,并且本试验培养总共为12 h 没有其作用时间长,在最后阶段加入盲肠微生物,再加上前面两阶段加入的空肠、回肠微生物经过时间累积,其他可利用氮源已经消耗过了,再来利用的游离氨基酸,此时的微生物多样性丰度更高,也更有利于氨基酸代谢。
不同饲料源由于其物质本身组成(如蛋白质、脂肪、碳水化合物等)差异[18-19],微生物对其进行的代谢途径、主要代谢产物、优势菌株[20-21]的形成等都会存在较大差异。本试验中各组CP 含量相同,因饲料源的差异,其他粗纤维、粗脂肪等含量就会出现差异。饲粮中,豆粕的营养价值远远高于其他几类蛋白质饲料源,这点从蛋白质饲料源的营养物质组成上也可解释。马占霞等[19]研究发现,豆粕的纤维素复合物峰高、峰面积均极显著高于普通菜粕,豆粕中的酸性洗涤纤维、酸性洗涤木质素含量显著低于普通菜粕;碳水化合物组分剖分中,豆粕内不可利用的中性洗涤纤维含量显著低于普通菜粕。本试验中豆粕粗纤维低于菜粕和棉粕,从碳水化合物利用角度而言,豆粕饲用价值高于菜粕和棉粕,可见肠道内微生物对于可利用营养物质更多的豆粕的利用更多,菜粕与棉粕中的可利用营养物质少且不可利用营养物质多,从而使微生物对其中游离氨基酸的利用远远高于豆粕组。Santos 等[22]研究不同蛋白质源哺乳山羊的氮代谢影响,发现在CP 水平相同的情况下,以棉籽粉为蛋白质源的饲粮可增加尿液中的氮排泄量和负氮平衡,显著高于豆粕组,认为尿中氮的流失与瘤胃中可降解蛋白质含量有关,这种营养素的消耗量越大,产生氨的量就越大,可能超出瘤胃微生物的使用量,从而导致肝脏中尿素合成增加和尿液排泄量增加,从一定程度上解释了本试验结果,即微生物对棉粕组氨基酸的利用高于豆粕组,氮流失得更多。
另外,有研究从不同饲料饲料源物质的分子结构及组成的分析来评估其营养价值。唐春梅[4]对不同氮源的养分组成研究发现,菜粕的快速降解部分高于豆柏和棉粕,豆粕慢速降解部分高于棉粕和菜粕,菜粕的不可利用蛋白是豆粕和棉粕的3 倍以上,可见不同饲料源的CP 组成存在较大差异。虽然本试验原料中控制了各组中CP 含量相同,但其组成不同,同时由于豆粕的CP中快速降解部分低,因此豆粕组微生物慢速降解占主要部分,对游离氨基酸的降解力度小;而菜粕的快速降解部分高于豆柏和棉粕,且由于其不可利用蛋白都远远高于豆粕和棉粕,因此菜粕组微生物会优先利用游离氨基酸从而造成其TAA 的消失率相对更高。曹克飞[21]将猪肠道微生物于不同氮源培养基中培养后,得到的产蛋白酶菌株的蛋白酶活性及对蛋白的消化率均为豆粕最高,棉粕次之,鱼粉最低,可见猪肠道微生物的组成中,豆粕类型饲料源会更有利于产蛋白酶菌株生长,产生的蛋白酶活性也更高,从而使微生物首先利用豆粕中的物质,而对于游离氨基酸的利用相对于其他组更低,造成本试验中氨基酸消失率由高到低为菜粕组、鱼粉组、棉粕组、豆粕组,因此与本试验结果存在一致性,可见豆粕在猪饲粮中更适合作为饲料源物质。另外,在研究猪肠道微生物对游离氨基酸、小分子多肽、大豆蛋白的氨基酸利用时发现,微生物对大豆蛋白质组的TAA 消失率最高[23],说明微生物在利用氮源时,会优先利用CP,其次利用游离氨基酸,这一结果对本试验结果也进行了很好地解释。
氨基酸消失率的高低差异在于蛋白质饲料源中可利用物质与不可利用物质的比例、微生物优先利用CP 还是游离氨基酸、微生物种属差异。在豆粕组不可利用蛋白少可利用蛋白多,使微生物更易对CP 分解形成大量游离氨基酸,氨基酸的形成与分解同时进行,因此游离氨基酸的消失率很低;而与豆粕组相比,其他3 组的可利用营养物质少,不可利用营养物质多,对游离氨基酸的利用高于豆粕组,以及由于微生物动态变化,产蛋白酶菌株少,物质结构更不适合微生物对其进行利用,而更多利用游离氨基酸,产生更多氮排泄,氨基酸消失率远高于豆粕组。前人研究发现,豆粕较其他原料的营养价值更高,各方面限制性更小,是更为优质的猪饲料源[19,24-25]。
4 结 论
本研究发现,猪肠道微生物对豆粕、棉粕、菜粕、鱼粉4 种不同饲料源的利用存在差异性,对豆粕的氨基酸利用程度最小,对菜粕的氨基酸利用程度最大,对棉粕与鱼粉的氨基酸利用程度居中,这可能与不同饲料源的营养物质组成以及微生物种属有关。
