CRABP1 过表达载体的构建及其对猪卵泡颗粒细胞凋亡的影响
2021-06-19吴夏梦刘进辉周展波王水莲张虹亮
吴夏梦,刘进辉,王 英,雷 磊,周展波,王水莲*,张虹亮*
(1.湖南农业大学动物医学院,湖南长沙 410128;2.长沙市雨花区动物卫生监督所,湖南长沙 410014)
维甲酸(Retinoic Acid,RA)又称视黄酸,是体内存在的具有生物活性的维生素A 衍生物[1]。视黄酸在体内具有生物活性的代谢产物主要包括全反式视黄酸(All-trans Retinoic Acid,ATRA)、9-顺式视黄酸(9-cis retinoic acid,9-cis-RA)和13-顺式视黄酸(13-cis Retinoic Acid,13cRA)3 种[2]。视黄酸具有广泛的生物学功能,可参与调节细胞增殖生长、诱导细胞分化和凋亡及抑制恶性肿瘤细胞生成等[3-4]。视黄酸结合蛋白1(Cellular Retinoic Acid-Binding Protein1,CRABP1)是一种高度保守的细胞体蛋白[5],是细胞液中视黄酸分子与细胞核上视黄酸核受体互相作用的重要物质[6],其表达非常广泛,几乎存在于各种组织细胞中。CRABP1基因在各种生物过程中都起着至关重要的作用[7]。前期研究发现,CRABP1 可参与胚胎小鼠心脏发育和小鼠脂肪前体细胞的分化调控[8-9],在食蟹猕猴胚胎干细胞向神经干细胞分化的过程中CRABP1基因表达增加[10]。这些研究表明CRABP1 可能影响胚胎发育和细胞分化。CARBP1 主要功能是在胞浆中结合RA,限制其进入细胞核,在微粒体P450 氧化酶的作用下RA 可被氢化为水溶性无活性产物而丧失功能[11-12]。CRABP1 在RA 介导的细胞分化和增殖过程中起着重要的作用,被认为是RA 信号的重要调节因子[13-14]。但CRABP1 是否介导了ATRA 影响猪卵泡颗粒细胞凋亡尚不清楚。本研究旨在构建猪CRABP1 真核表达载体,并将其转染到猪卵泡颗粒细胞中,进一步研究CRABP1 能否介导ATRA 对猪卵泡颗粒细胞凋亡的影响,为研究CRABP1 在卵泡发育过程中的作用奠定基础。
1 材料与方法
1.1 实验材料 猪卵巢来自湖南红星盛业食品股份有限公司。ATRA 购自Sigma 公司;RNA 反转录试剂盒及qRT-PCR 试剂盒购自TaKaRa 公司;T4 DNA 连接酶、pGEM-T 质粒载体购于Promega 公司;PCR 产物纯化试剂盒、无内毒素质粒大提试剂盒购自OMEGA公司;DH5α 感受态细胞购自天根生化科技有限公司;脂质体转染试剂Lipofectamine 2 000 购自Invitrogen 公司;Opti-MEM 培养基、胎牛血清购自Gibco 公司;DMEM/F12(1X)培养基购自HyClone。
1.2 引物的设计与合成 根据GenBank 发布的相关编码区序列,利用Primer Premier 5.0 设计引物,送往华大基因科技股份有限公司合成。
1.3 目的基因的扩增 用传统Trizol 法提取猪卵巢RNA并反转录成cDNA,以cDNA 为模板进行目的基因扩增。
1.4 CRABP1 过表达载体的构建 本实验所用的真核表达载体为pcDNA3.1(+),载体图谱如图1 所示。

图1 pcDNA3.1(+)质粒图谱
根据NCBI 上GenBank 中公布的猪CRABP1mRNA全长序列,设计含有酶切位点引物。上游引物:5'-AAG CTTATGCCCAACTTCGCAGG-3';下游引物:5'-GAA TTCTCACTCCCGAACATAAATTCT-3',下划线指的是HindIII、EcoRI 的酶切位点。
以猪卵巢组织cDNA 为模板,通过设计含酶切位点引物进行PCR 扩增,胶回收产物与pGEM-T 载体4℃连接。将连接产物转化入DH5α感受态细胞,涂布于含氨苄西林的LB 固体培养基中,37℃正置1 h 后倒置培养过夜。次日,随机挑选单克隆菌落于具有氨苄西林的LB 液体培养基中振荡培养12~14 h,大量扩增并小提质粒。分别将上述含目的基因质粒(pGEM-T-CRABP1)和pcDNA3.1 载体应用相对应的限制性内切酶37℃酶切1 h。电泳后,胶回收酶切产物,利用T4 连接酶将目的片段回收产物与酶切后pcDNA3.1 载体回收产物4℃连接过夜。经转化、小提质粒、保菌、酶切及测序,确定过表达载体是否构建成功。按照无内毒素质粒大提试剂盒说明书进行质粒大提,并测定其浓度,-20℃保存。
1.5 猪卵泡颗粒细胞的分离培养 从屠宰场取卵巢,放入事先预热含1% 双抗生理盐水中,2~4 h 内运回试验室,用含1%青链霉素预热的生理盐水冲洗干净。抽吸卵巢上3~6 mm 的卵泡,将卵泡液37℃沉降15 min 后,取上清液1 000 r/min 离心7 min,弃上清,管底沉淀用红细胞裂解液37℃处理2 min,1 000 r/min 离心7 min,PBS 洗涤2 遍。将洗涤好的颗粒细胞移入培养瓶中,置于37℃、5%CO2、饱和湿度培养箱中培养。细胞成熟培养3 d 后,更换新鲜培养基直到细胞长满,胰酶消化转入细胞培养板中培养。
1.6 猪卵泡颗粒细胞转染CRABP1 过表达载体qRT-PCR检测相关基因表达 细胞转染步骤参照Lipofectamine TM2 000 说明书进行。对于基因过表达实验,要求转染时细胞密度达到70%~80%汇合;单独转染处理24 h以及转染后添加1 nmol/L ATRA 的猪卵泡颗粒细胞收样提取RNA 进行反转录;qRT-PCR 检测CRABP1基因的表达及凋亡相关基因XIAP、Bax、Caspase-3、Fas的表达。
qRT-PCR 反应:用ddH2O 将反转录产物稀释5倍,用TB GreenTMPremix Ex TaqTM试剂盒进行qRTPCR 反应,根据CT 值采用2-△△Ct法,以GAPDH为内参,计算目的基因的相对表达量。20 μL 反应体系:TB Green 10 μL,上、下游引物各0.4 μL(10 μmol/L),ROS 0.4 μL,cDNA 模版2 μL,加RNase free water 至20 μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火延伸30 s,共40 个循环;熔解曲线:95℃变性15 s,60 ℃退火延伸60 s,95 ℃终延伸15 s。qRTPCR 反应引物序列见表1。

表1 qRT-PCR 反应引物序列
1.7 统计分析 所有实验都独立重复至少3 次以上。两组之间的差异显著性比较用独立样本t 检验进行分析,3 组以上的比较用单因素方差分析(One-Way ANOVA)方法进行检验。所有数据统计分析都使用SPSS 19.0 软件程序进行分析,0.01<P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1CRABP1基因的扩增与鉴定 以猪卵巢组织cDNA为模板,使用上述引物扩增出卵巢CRABP1目的基因,经琼脂糖凝胶电泳检测,结果如图2 所示。扩增片段大小约414 bp,与预计片段长度相符,胶回收测序结果与NCBI GenBank 数据库中猪CRABP1mRNA 比对同源性为99%(图3)。结果表明,CRABP1是高表达于猪卵巢中。

图2 猪卵巢组织CRABP1 基因 PCR 产物的鉴定

图3 CRABP1 基因PCR 扩增产物测序比对结果
2.2 重组表达载体的PCR 鉴定与双酶切鉴定 利用限制性内切酶对阳性克隆质粒进行双酶切鉴定,质粒经琼脂糖凝胶电泳鉴定分别显示大小约414 bp 的CRABP1条带和5 428 bp 的pcDNA3.1(+)质粒条带(图4),其结果与预期相符。

图4 重组表达载体双酶切检测图
2.3 重组表达载体的测序鉴定 将重组表达载体送至华大基因进行测序鉴定,结果证明CRABP1基因已正确地插入到载体中(图5),测序结果与预期相符。

图5 CRABP1 过表达载体酶切测序结果图
2.4 转基因细胞qRT-PCR 检测
2.4.1 CRABP1 过表达影响猪卵泡颗粒细胞凋亡 如图6 显示,CRABP1 转染猪颗粒细胞24 h 后,过表达CRABP1 组CRABP1表达与pcDNA3.1 空载体组相比极显著升高;抗凋亡基因XIAP[15]与pcDNA3.1空载体组相比无显著性变化;促凋亡相关基因Bax、Caspase-3、Fas[16]与pcDNA3.1 空载体组相比极显著升高,表明CRABP1 过表达对猪颗粒细胞的凋亡有促作用。
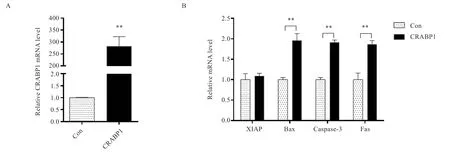
图6 CRABP1 过表达对猪卵泡颗粒细胞凋亡的影响
2.4.2 CRABP1 介导ATRA 调控猪卵泡颗粒细胞凋亡 图7 表明,pcDNA3.1 空载体转染后添加DMSO 组与pcDNA3.1 空载体转染后添加ATRA 组相比,CRABP1的表达变化不显著;CRABP1 过表达载体转染后添加ATRA 组CRABP1的表达极显著高于pcDNA3.1 空载体转染后添加ATRA 组。进一步研究显示,与pcDNA3.1空载体转染后添加ATRA 组相比,pcDNA3.1 空载体转染后添加DMSO 组抗凋亡基因XIAP变化不显著,而pcDNA3.1 空载体转染后添加ATRA 组促凋亡基 因Bax、Caspase-3、Fas则显著低于pcDNA3.1 空载体转染后添加DMSO 组;通过先转染CRABP1 过表达载体再添加ATRA 后,抗凋亡基因XIAP与促凋亡基因Bax、Caspase-3、Fas的表达均显著高于转染pcDNA3.1 空载体再添加ATRA 细胞组。

图7 CRABP1 介导ATRA 调控猪卵泡颗粒细胞凋亡
3 讨 论
细胞视黄酸结合蛋白(CRABP)属于细胞内脂质结合蛋白(ILBP)的多基因家族,有2 种高浓度的同源蛋白,分别是CRABP1 和CRABP2,参与视黄酸的转运和代谢等功能[8,17-18]。相关报道表明,在食管鳞状细胞癌细胞中CRABP1缺失可促进细胞生长[19]。CRABP1 通过激活非典型的ERK1/2 凋亡通路诱导癌细胞死亡[20]。但CRABP1是否参与猪卵泡颗粒细胞凋亡的调控尚无相关报道。本研究发现,过表达CRABP1能调控猪卵泡颗粒细胞相关凋亡基因的表达进而促进细胞凋亡。
颗粒细胞的凋亡是导致发育期卵泡发生闭锁的关键因素[21]。凋亡包括线粒体凋亡途径和外源性凋亡通路2 个主要通路,2 种通路最终导致半胱天冬蛋白酶(Caspase)家族激活,引起一系列级联反应,致使细胞凋亡。Bax、Caspase-3、Fas 均是细胞凋亡信号通路的关键细胞因子,其中Bax 在受到死亡信号的刺激后被激活进而促进细胞凋亡,Fas 是一个位于细胞表面诱导细胞凋亡的跨膜蛋白,而Caspase-3 是凋亡的关键蛋白酶,一旦被激活,即发生下游的级联反应,引发凋亡[22-24]。本研究结果显示,CRABP1 过表达载体转染颗粒细胞后,其Bax、Caspase-3、FasmRNA 表达量均显著增加。蒋鹏飞等[25]研究发现,密蒙花颗粒剂可通过抑制泪腺组织中凋亡因子Bax、Caspase-3、Fas 和FasL 表达从而抑制泪腺细胞凋亡;而张坤[26]研究发现,过量锰可诱导鸡脑组织和鸡胚神经细胞凋亡基因Bax、Caspase-3mRNA 以及FasmRNA 的表达,抑制抗凋亡基因Bcl-2mRNA 及Bcl-xmRNA 表达,引起细胞凋亡。裴岩岩等[27]实验发现,黄芪甲苷处理人乳腺癌MCF-7 细胞后Bax、Caspase-3mRNA 显著上调,Bcl-2mRNA 下调,表明黄芪甲苷可诱导人乳腺癌MCF-7 细胞凋亡。上述研究表明,通过检测凋亡相关基因表达变化可直接揭示细胞凋亡效应。细胞凋亡蛋白X 染色体连锁抑制剂(XIAP)可控制细胞在几种调节细胞死亡途径中的存活,可阻断Caspase 诱导的细胞凋亡,使细胞逃避凋亡[28-29]。本实验通过向猪卵泡颗粒细胞转染CRABP1 过表达载体后,检测出XIAP的表达与空载体组相比无显著性变化。以上结果表明,CRABP1 过表达可通过调控凋亡相关基因表达进而诱导猪卵泡颗粒细胞凋亡。
此外,有研究表明,CRABP1 能够通过结合ATRA后参与ATRA 分解代谢[30]。通过转染CRABP1 过表达载体至猪卵泡颗粒细胞后发现其可抵抗ATRA 对细胞Bax、Caspase-3、FasmRNA 表达的抑制作用,这与CRABP1 可介导ATRA 诱导绒山羊毛乳头细胞凋亡的研究结果相一致[31]。当转染CRABP1 过表达载体后再添加ATRA 也显著提高了XIAP在猪卵泡颗粒细胞中的表达,其原因可能与颗粒细胞维持体细胞内的稳态有关,但具体机制有待进一步研究。
4 结 论
本实验成功构建猪CRABP1 过表达载体,并确定其对猪卵泡颗粒细胞的促凋亡效应;通过进一步研究发现,CRABP1 可介导ATRA 调控猪卵泡颗粒细胞凋亡,提示CRABP1 可能在猪卵泡发育过程中发挥重要调控作用。
