脂滴包被蛋白的结构、功能及其与脂类疾病关联的研究进展
2021-06-19庞永佳翟桂影王宇祥
庞永佳,翟桂影,李 瑞,李 超,王宇祥*
(1.东北农业大学动物科学技术学院,黑龙江哈尔滨 150030;2.黑龙江省普通高等学校动物遗传育种与繁殖重点实验室,黑龙江哈尔滨 150030;3.农业农村部鸡遗传育种重点实验室,黑龙江哈尔滨 150030)
脂滴(Lipid Droplet,LD)是细胞内中性脂肪的主要贮存场所,广泛存在于细菌、酵母、植物、昆虫以及动物细胞中。作为一个活动旺盛的多功能细胞器,脂滴与其他细胞器相互作用,在脂质代谢与存储、膜转运、蛋白降解以及信号传导过程中发挥着重要作用。脂滴的动态变化维系着脂质代谢活动的稳定,若脂质代谢紊乱会导致诸如肥胖、炎症反应等多种疾病发生[1-3]。脂滴的核心由中性脂肪组成,主要包括甘油三酯(三酰基甘油,Triacylglycerols,TAG)和胆固醇酯(Cholesterol Ester,CE),核心外包裹着单层磷脂分子,磷脂分子内镶嵌着多种蛋白,这些蛋白对于脂滴的代谢和调节具有重要作用,称为脂滴相关蛋白。1991 年,Greenberg 等[4]发现了一种可被磷酸化的蛋白,其特异性地包围在脂滴表面,故称为围脂滴蛋白(或脂滴包被蛋白)(Perilipin,PLIN1)。PLIN1 是最早发现并研究最为透彻的一个脂滴包被蛋白,它在功能上所具有的调控脂解和促进脂滴融合的作用,使其在脂质代谢调节中具有重要意义。本文综述PLIN1 的命名、结构、表达调控、功能及其与脂类代谢疾病之间的联系,重点对PLIN1 发挥功能的分子机制进行总结。
1 PLIN1 的表达与结构
PLIN1 是分布于脂滴表面含量最多的脂滴包被蛋白,是PAT 家族的核心成员之一。PAT 家族成员是脂滴表面的主要蛋白,最初由围脂滴蛋白(Peripilin)、脂肪分化相关蛋白(ADRP)、尾连蛋白(TIP47)组成,由于它们的氨基酸序列相近,基因具有高度同源性,因此取首字母命名为“PAT 家族”。而后又增添了S3-12蛋白和MLDP/OXPAT 蛋白,依次命名为PLIN1、PLIN2、PLIN3、PLIN4 和PLIN5,统称为PLINs[5]。PLINs 在机体的各种组织中均有表达。迄今为止,尚未在哺乳动物细胞中发现缺乏PLINs 的胞质脂滴,但PLINs 成员有其独特的组织表达规律。PLIN1 主要表达在白色脂肪组织(WAT)中,少量在棕色脂肪组织(BAT)和心肌脂肪肉瘤中表达;PLIN2 主要在肝脏中表达,同时也在多种细胞类型(如未成熟的脂肪细胞、巨噬细胞、皮脂腺细胞、乳腺上皮细胞等)表达;PLIN3 则在骨骼肌细胞、中性粒细胞、视网膜色素上皮细胞、皮脂腺细胞等表达;PLIN4 存在于脂肪细胞、大脑、心脏和骨骼肌中;PLIN5 主要存在于氧化组织中,如心脏、BAT和骨骼肌[6-9]。
在“十二五”与“十三五”期间,北京印刷业实施绿色印刷践行清洁生产,在深化改革中坚持了结构调整转型升级的方向。北京市新闻出版广电局主导的北京市绿色印刷工程于2012年正式立项实施。截至2017年3月,北京地区取得绿色印刷资质的企业达到159家,连续5年居全国首位。绿色印刷工程实施五年来,北京市新闻出版广电局累计拨付了8497万元财政资金,用以支持和奖励教材和图书的绿色印刷,其中涉及到50家出版社和40家印刷企业。
在哺乳动物中,PLIN1 蛋白的N-末端与PLIN2、PLIN3 和PLIN5 相似,拥有一个称为PAT 域的保守结构域和11-mer 重复序列,11-mer 重复序列会形成双性α 螺旋,从而有利于PLINs 与脂滴结合[10];与其他成员不同,PLIN4 拥有独特的氨基酸序列,即不存在PAT结构域,并且多肽长度几乎是其他PLINs 蛋白的3 倍(图1)。在PLINs 与脂滴结合过程中,PLIN1、PLIN2、PLIN3 和PLIN5 主要利用其共同的PAT 域和11-mer 重复序列与脂滴交互,但非保守的C-末端元素也必不可少;PLIN4 虽缺少PAT 结构域,但超长的11-mer 重复序列有利于其定位于脂滴。

图1 哺乳动物PLINs 蛋白结构示意图[6]
由于mRNA 的剪切、拼接形式不同,PLIN1 可产生多种转录本,并翻译出不同的蛋白亚型。根据NCBI的Reference Sequences(RefSeq)数据库提供的数据,初步整理了几种常见实验动物中可能存在的PLIN1 转录本和蛋白亚型,从表1 可以看出,人和小鼠PLIN1主要存在3 种转录本,分别编码2 种蛋白亚型;猪PLIN1 存在1 种转录本,编码1 种蛋白亚型;牛PLIN1主要存在3 种转录本,分别编码2 种蛋白亚型;羊PLIN1 主要存在2 种转录本,分别编码2 种蛋白亚型;鸡PLIN1 主要存在4 种转录本,分别编码4 种蛋白亚型;鸭PLIN1 存在1 种转录本,编码1 种蛋白亚型。不同物种间PLIN1 转录本的长度差异较大,但蛋白亚型的长度差异不明显,说明PLIN1 蛋白的结构在进化上较为保守,暗示其功能在不同物种间基本一致。
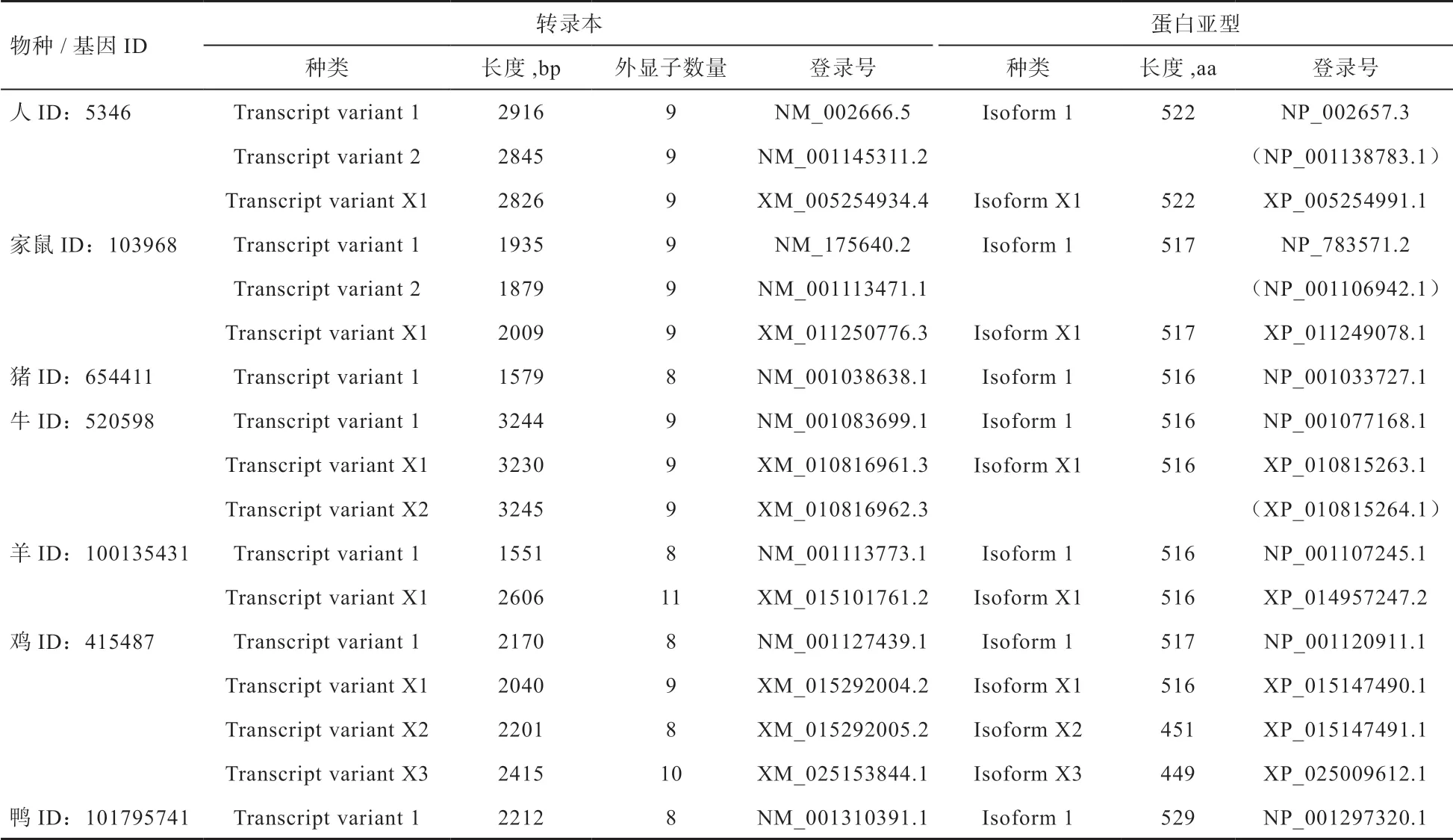
表1 NCBI RefSeq 数据库中各物种PLIN1 的转录本和蛋白亚型
然而,PLIN1 真实存在的转录本和蛋白亚型与NCBI 数据库中的信息有所不同。如在鼠中,Plin1基因可产生6 种转录本,共编码PLIN1a(57 ku)、PLIN1b(46 ku)、PLIN1c(38 ku)、PLIN1d(26 ku)4 种蛋白亚型[11](图2)。这4 种蛋白亚型具有诸多的异同点,如拥有共同的N-末端区域但C-末端长度不同,疏水性氨基酸残基在C-末端构成疏水性裂缝(图2);PLIN1a 具有6 个蛋白激酶A(PKA)磷酸化位点,分别位于81、222、276、433、492 和517 位的丝氨酸;PLIN1b 和PLIN1c 仅具有前3 个PKA 磷酸化位点,而PLIN1d 仅具有第1 个PKA 磷酸化位点。在表达规律上,PLIN1a 和PLIN1b 在白色脂肪组织(WAT)和棕色脂肪组织(BAT)中高度表达,而PLIN1c 和PLIN1d 优先存在于类固醇组织中。这些结构和表达模式的特性提示各个PLIN1 亚型可能具有功能专一性,在调节脂质代谢方面可能有所不同。

图2 小鼠PLIN1 蛋白亚型结构示意图(改自Kimmel 等[12])
2 PLIN1 的功能及作用机制
2.1 脂解作用 PLIN1 具有双向调控脂解的功能。一方面,PLIN1 对脂滴具有屏障作用,隔离甘油三酯脂肪酶(Adipose Triglyceride Lipase,ATGL)和激素敏感脂肪酶(Hormone-Sensitive Lipase,HSL)与TAG 接触,保护中性脂质不被水解;另一方面,在儿茶酚胺类激素刺激条件下,PLIN1 被PKA 磷酸化,ATGL 和HSL 转移至脂滴表面,加快脂解。这些功能已被多项研究所证实。研究表明,3T3-L1 脂肪细胞中Plin1基因被敲除后,脂滴表面失去保护屏障,中性脂质被水解,细胞脂解速度加快[13];另一项研究表明,在中国仓鼠卵巢细胞(CHO)中,过表达PLIN1a 可抑制脂解率达87%;在激素刺激条件下PKA 被激活,脂解速率升至原来的7 倍,而PLIN1a N-末端的PKA 位点突变,则使脂解作用下降[14]。
在炎性疾病中,动脉粥样硬化目前被认为是一种发生在动脉壁的复杂慢性炎性疾病,动脉粥样硬化发展的始终都伴随着炎症反应。脂滴及巨噬细胞中脂质的大量蓄积会导致动脉粥样硬化发生。机体中PLIN1 仅表达于脂肪组织及甾体生成组织的脂滴表面及巨噬细胞内,而PLIN2 在各类组织中广泛表达,暗示PLIN1 的缺失可减少动脉斑块形成[52]。Zhao 等[53]研究发现,小鼠骨髓来源细胞中PLIN1 的缺乏可减轻小鼠动脉粥样硬化病变;但另一项研究表明,巨噬细胞中过表达PLIN1对载脂蛋白E 基因敲除小鼠(ApoeKO)的动脉粥样硬化也具有减轻作用[54]。尽管2 次独立研究得到相反的结果,但至少表明PLIN1 与动脉粥样硬化的发生密切相关,PLIN1 可作为治疗动脉粥样硬化的一个重要靶点。
在哺乳动物中的研究表明,Plin1基因的转录主要受过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator-Activated Receptorγ,PPARγ)调控。PPAR有3 种亚型(α、β/δ和γ),它们以组织特异性的方式调控脂滴相关蛋白的表达进而调节脂质代谢[23]。视黄醇X 受体(RXR)属于配体激活型转录因子,现已发现了RXR 存在RXRα、RXRβ、RXRγ3 种亚型。有研究表明,在调控基因表达的过程中,配体激活的PPAR会与RXR 结合形成异源二聚体,识别并结合到靶基因启动子区的过氧化物酶体增殖物反应元件(PPRE)上发挥作用[24]。在哺乳动物中,PPARγ主要是以PPARγ2亚型与RXRα形成异源二聚体的形式上调Plin1基因表达的[25]。最新研究表明,在鸡上,RXRα可以通过不依赖PPARγ的方式正调控Plin1基因的表达并促进脂肪形成[26]。
在空腹或锻炼情况下,肾上腺素和去甲肾上腺素会与脂肪细胞膜上的β-肾上腺素受体结合,G 蛋白介导的信号通路启动,腺苷酸环化酶激活,细胞内的cAMP 水平增加,触发四聚体PKA 调控亚基的释放,进而激活催化亚基[16]。PKA 被激活后,PLIN1 和HSL被PKA 磷酸化,磷酸化的HSL 从细胞质向脂滴迁移,与高度磷酸化的PLIN1 相互作用进而获得脂质底物。脂肪细胞中PKA 的激活也促进了大量ATGL 向PLIN1包被的脂滴迁移[17]。同时,C-末端的磷酸化破坏了PLIN1 与ABHD5 的相互作用,ABHD5 与PLIN1 解离,启动结合并激活ATGL 的作用,使ATGL 催化脂肪分解,将TAG 转化为甘油二酯(Diglyceride,DAG)并释放游离脂肪酸(Free fatty Acid,FA),脂解被激活(图3-B)。总体来说,在脂肪细胞中,ATGL 从TAG 中分离脂肪酸并释放DAG,然后HSL 裂解DAG 释放出单酰基甘油(Monoacylglycerol,MAG);MAG 再由单酰基甘油脂肪酶(Monoacylglycerol Lipase,MAGL)水解释放,完成脂解过程。在此过程中,PLIN1 通过控制激活剂ABHD5 与ATGL 的结合来调节ATGL 的活性,并通过在脂滴上提供一定的空间来调节HSL 的活性,以便在特定条件下使其进入脂滴,促进脂解。
甲状旁腺正确辨认后其血供的保护是至关重要的。目前研究表明甲状腺全切术后暂时性甲状旁腺功能减退可能与甲状旁腺的血供障碍有关,因此推荐精细被膜解剖法。需要警惕的是,部分保留血供的甲状旁腺仍可因静脉回流障碍造成其淤血、坏死。对表面血管扩张、淤血明显者,需予以切除行I期自体移植。朱精强[10]强调对于A3型(完全位于甲状腺组织内)甲状旁腺及严重缺血、游离的甲状旁腺,自体移植是最后的弥补方法。
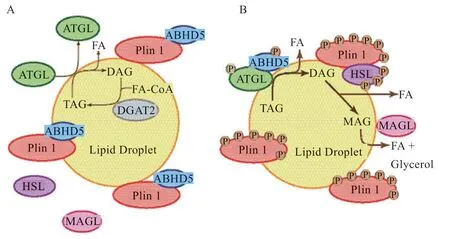
图3 基础状态和激素刺激条件下PLIN1 的作用机制示意图[18]
代谢综合征发病机制的主要因素是肥胖引起的慢性炎症,其共同的病理基础就是炎症因子通过抑制胰岛素信号转导,在WAT、骨骼肌和肝脏中引起胰岛素抵抗。非酒精性脂肪肝是代谢综合征在肝脏中的体现。研究表明,饮食诱导的大鼠非酒精性脂肪性肝模型中,高脂饮食组的PLIN1 蛋白表达增多,表明PLIN1 与脂质代谢紊乱相关,降低PLIN1 表达可能会阻止非酒精性脂肪性肝的发展[55]。
4.1 PLIN1 与肥胖 肥胖是一种由遗传和环境等因素共同引起的慢性代谢性疾病,其表现为机体脂肪总含量过多或局部含量增多及分布异常。肥胖会诱发多种代谢类疾病,如胰岛素抵抗、血脂异常和2 型糖尿病,对患者健康具有严重危害。一些研究发现,脂肪细胞中PLIN1 的表达与肥胖存在潜在联系。如非糖尿病肥胖个体的脂肪细胞PLIN1 蛋白水平高于较瘦个体,PLIN1与体脂百分比之间呈正相关[39]。而其他研究表明,在病态肥胖与非肥胖患者中,病态肥胖人群显示较低的PLIN1 水平[40];与此类似,与正常体重者相比,肥胖者PLIN1 呈现较低水平[41]。因此PLIN1 的表达水平与肥胖之间的关系尚无定论。同样,在小鼠中的研究表明,Plin1基因敲除小鼠表现瘦弱、体重正常,但WAT 储备却非常低,并且对饮食和遗传诱发的肥胖具有抵抗力;而出乎意料的是,WAT 特异性Plin1基因的过表达也导致瘦型和饮食诱发肥胖的抵抗[42]。推测其原因可能是,前者Plin1-/-脂肪细胞的基础脂解作用增强但受刺激的脂解作用减少,后者则是这些小鼠的全身能量消耗增加,WAT 转变为棕色脂肪组织样表型,进而调节TAG和FA 水平。可见PLIN1 表达水平与肥胖之间的联系受各种因素影响。
进一步的研究发现,在3T3-L1 前脂肪细胞中,PLIN1 与Fsp27 的共表达可增加Fsp27 介导的脂滴融合和生长,而在成熟的3T3-L1 脂肪细胞中敲除PLIN1则显著降低脂滴融合和脂滴大小[22],说明PLIN1 通过与Fsp27 的相互作用,增强Fsp27 所介导的脂滴融合。其可能原因:当2 个脂滴相互连接时,Fsp27 会积聚在LDCS 上,从而形成1 个通道,允许双向脂质转移交换。脂质转移通道的大小、内部压力差和脂滴表面张力都会影响Fsp27 介导的中性脂质从较小脂滴到较大脂滴的定向净转移速率。而PLIN1 的酸性结构域(氨基酸291-319)以及Fsp27 CIDE-N 结构域中的碱性氨基酸介导了PLIN1 与Fsp27 特异的相互作用,使得PLIN1 能够显著增强Fsp27 所介导的脂滴融合长大作用。如图4 所示,当CIDE-N 结构域处于单体构象时会形成自抑制作用,改变了CIDE-C 结构域在LDCS 处的构象,从而影响了通道的开合,阻断了中性脂的扩散作用,脂滴无法融合长大;当CIDE-N 结构域相互作用形成同源二聚体时,自抑制作用解除,通道得以开启,中性脂发生扩散,脂滴发生融合长大;而在PLIN1 存在的情况下,Fsp27/PLIN1 异源二聚体形成,这一结构可缓解或解除Fsp27 CIDE-N 结构域的自抑制作用,促进通道的形成或扩展,从而增加脂质的转移速率[22]。

图4 PLIN1 在调节Fsp27 介导的脂质转移和脂滴生长中的作用模型[22]
3 PLIN1 的表达调控
(1)High speed in the analysis and design(reducing design time and cost).
回想起来,白丽筠跟我说这么露骨的段子,其实当时已有勾引我的意思。只是我还没有明白过来。叶霭玲指责我跟白丽筠的关系,让我真的朝这方面动了心思。下次见了面,我问白丽筠,即使待遇不公,找一份银行外聘的工作也极不容易,你怎么又不做“卖银的”了呢?
此外,非编码RNA 对Plin1基因的表达也有一定的调控作用。研究发现,在体外培养的脂肪细胞中过表达miR-192*会使Plin1基因的表达降低[35];抑制miR-378 的表达减弱了激素刺激的脂解作用,同时减少了Plin1基因的表达[36]。牛前脂肪细胞成脂分化过程中,当miR224 过表达时,脂肪形成相关生物标志物Plin1mRNA 表达水平降低,而当抑制miR224 时,则相反[37]。长链非编码RNA ARAP1-AS1 可通过调控miR-2110/HDAC2/Plin1轴在大肠癌的发生,从而发挥促癌作用,这有望成为治疗大肠癌的新的有效靶点[38]。
在表观遗传调控方面,DNA 甲基化(包括高甲基化和低甲基化)对于调节转录因子、转录辅助因子和其他参与脂肪发育和脂肪生成基因的表达至关重要[30-32]。Bialesova 等[33]研究发现,肥胖女性的Plin1基因启动子甲基化与基础脂解呈负相关,这表明在肥胖等胰岛素抵抗状态下,Plin1基因的表观遗传调控对于增加脂肪细胞的脂解作用很重要。鸡上的研究发现,Plin1基因启动子-490 bp 处的DNA 甲基化对该基因的表达有一定影响,且Plin1基因的表观遗传调控可能对鸡脂肪发育中的脂肪细胞肥大有重要影响[34]。
除PPARγ以外,调控Plin1基因表达的转录因子还有雌激素受体相关受体α(ERRα)和肝X 受体α(LXRα)。研究表明,ERRα对Plin1基因的转录起调控作用[27],并且该调控受到PGC-1α(Peroxisome Proliferator-Activated ReceptorγCoactivator)和SHP(Small Heterodimer Partner)的激活或抑制;在基础条件下,LXRα的激活上调了人脂肪细胞的脂解作用,而这种作用一定程度上是通过LXRα与Plin1基因的启动子结合并下调Plin1基因的表达来实现的[28]。此外,E2F 转录因子1(E2F1)、CCAAT 增强子结合蛋白β(C/EBPβ)、多形性腺瘤基因1(PLAG1)和SMAD3也被确定为Plin1基因的转录调控因子,这些转录因子主要是通过与Plin1基因的核心启动子区域结合从而激活Plin1基因的表达[29]。
4 PLIN1 与疾病
龚婧怡[20]研究发现,PLIN1 与Fsp27 所介导的脂滴融合有关。Fsp27 是CIDE 家族蛋白中的一员,CIDE(Cell Death-Inducing DFF45-Like Effectors)家族蛋白是一类在哺乳动物物种间高度保守的蛋白,包括Cidea、Cideb 以及Fsp27(Fat-specific Protein 27)。研究表明,在细胞中过量表达Fsp27 能够促进大脂滴的形成,Fsp27 缺失会导致脂肪细胞内大脂滴形成出现障碍,脂滴变小变多[21]。其分子机制为Fsp27 定位于脂滴表面,并依靠完整的C-末端结构以及自身的脂滴定位信号,富集在脂滴与脂滴的接触位点(LDCS),进而促进由LDCS 相连的脂滴之间中性脂从小脂滴向大脂滴的定向转移,最终导致脂滴的融合以及一个更大脂滴的形成[21]。Fsp27 通过其CIDE-N 结构域形成的同源二聚体对Fsp27 所介导的脂滴融合起着十分关键的作用[22]。
中国区某大领导回应:制度就是这样的,谁知道你们有没有猫腻和包庇?谁都这样来闹,这么大一家公司还怎么运作?
有研究发现,Plin1基因的单核苷酸多态性与肥胖的发生风险相关。Plin1基因单核苷酸多态性与生活方式的相互作用直接影响肥胖者的减肥效果,尤其是女性[43];Gol 等[44]使用贝叶斯方法发现Plin1基因多态性与猪早期生长速度和胴体长度的显著关联;Raza 等[45]发现Plin1基因的5 个SNPs 与秦川牛的背脂深度、肌内脂肪和胸深相关,Plin1基因的二倍型H2H4 与秦川牛肉体和胴体性状相关,可在育种中进行选择,以提供经济优势;范红静[46]研究发现Plin1基因外显子2 的多态位点与鸭的皮脂率、腹脂率、胴体重、全净膛重和腹脂重呈显著或极显著相关。此外,鸡Plin1基因内含子6的G2467 多态位点也与鸡胴体性状及脂肪沉积有关,该位点A1A1基因型个体的胴体和脂肪性状指标均显著高于A2A2基因型个体[47]。至于Plin1基因多态性是通过哪种调控机制影响基因的遗传效应尚不清楚,推测多态位点的碱基突变可能使该基因的转录因子结合位点或调控元件发生改变,导致基因的表达活性受到影响,从而改变其表达产物,致使表型性状出现差异。
4.2 PLIN1 与炎症反应 脂肪组织是内分泌器官,可以分泌包括肿瘤坏死因子α(TNFα),白介素1β(IL-1β)和白介素6(IL-6)等多种炎症因子。这些炎症因子可诱发脂肪细胞内的炎症反应以及相关脂肪因子的分泌紊乱,从而影响自身及其他脏器组织的功能、脏器的微环境,参与或加速疾病的发生和发展。而PLIN1 作为脂肪细胞代谢相关蛋白,与炎症因子关系紧密。研究表明,TNFα可降低PLIN1 mRNA 含量,从而降低cAMP 的水平,诱导TAG 的水解[48];IL-6 可刺激脂肪细胞脂肪分解,PLIN1 的表达水平显著下降,并导致肥胖和糖尿病患者的胰岛素抵抗[49]。与此相对应,过表达PLIN1 也可以抑制相关炎症信号通路的激活,使TNFα、IL-1β和IL-6 等炎性因子表达量下降,起到抗炎作用[50];而PLIN1 缺乏会促进脂肪组织中的炎症反应和脂解作用,从而导致胰岛素抵抗,脂肪代谢维持困难,代谢稳态失衡[51]。
PLIN1 双向调控脂解功能的分子机制在哺乳动物中已经研究的比较透彻。在基础(或进食)条件下,PLIN1 附于脂滴表面形成屏障,使得ATGL 和HSL 与它们的脂质底物隔离,在胞质中处于游离状态。同时,PLIN1 还会与ATGL 的激活剂ABHD5(也称CGI-58)在脂滴表面结合,阻止ABHD5 与ATGL 的相互作用,限制了ATGL 的脂解活性[15]。因此,在基础条件下,PLIN1 有效地保护了脂滴中的TAG,使其不被脂解酶脂解,脂解作用受到抑制(图3-A)。
2.2 调节脂滴大小 有研究表明,PLIN1 在成熟的脂肪细胞中大量表达,而PLIN2 主要存在于含小脂滴的未成熟前脂肪细胞中;并且在分化为成熟脂肪细胞的过程中,脂滴颗粒中的PLIN2 逐渐被PLIN1 替代,说明PLIN1 可能参与了大脂滴的形成[19]。
星点设计-效应面法优化山茱萸总环烯醚萜苷脂质体的制备工艺 …………………………………………… 苏艳莹等(19):2612
4.3 PLIN1 与遗传性脂肪营养不良 人在PLIN1 羧基末端中的移码突变会引起脂肪营养不良。研究发现,在人类家族性部分脂肪营养不良(FPLD)的新亚型中,PLIN1 的羧基末端存在3 个独立的杂合移码突变(398fs、404fs、439fs)[56-58]。398fs 和404fs 位 于PLIN1a 的CGI-58 结 合区内,均与来自3 个家庭的6 名患者的部分脂肪代谢异常、肝脂肪变性、血脂异常和胰岛素抵抗相关[56-57],这些患者的WAT 组织学分析显示,脂肪细胞变小、巨噬细胞浸润和纤维化增加。体外机理研究表明,由于结合和稳定CGI-58 的能力降低,这两种突变均不能抑制基础脂解。其原因可能是这些突变使得患者的脂肪细胞中ATGL–CGI-58–LD 相互作用和激活增强,从而导致基础脂解水平升高。
与398fs、404fs 不同,439fs 位于CGI-58 结合区之外。尽管PLIN1a 的439fs 突变体能够结合并稳定CGI-58,但仍不能抑制体外培养细胞中的基础脂解,这可能是439fs 突变体PLIN1a 不如野生型PLIN1a 稳定的原因所致[58]。此外,来自439fs 患者的WAT 活检显示,PLIN1a 水平降低的同时PLIN2 水平升高,说明PLIN2 对减少的PLIN1a 的补偿可能是导致这些患者基础脂解升高的部分原因[58]。
选取2014年3月至2017年3月在本院接受治疗的结肠癌患者103例,将患者随机分为两组:实验组51例(完整结肠系膜切除术),对照组52例(传统根治术)。
与Plin1-/-小鼠相比,这些患有PLIN1 杂合突变的患者表现出更强的全身表型缺陷,这反映了WAT 代谢或适应性补偿机制可能存在物种差异,或两者都有。这些研究为PLIN1 在脂肪组织的脂质存储中的关键作用提供了有力证据。
5 展 望
PAT 家族蛋白是一个进化上古老的家族,其特征是N-末端PAT 结构域和11-mer 重复序列,但C-末端差异大,使得PLINs 具有独特的功能特性。尽管PLINs与脂滴表面的精确相互作用仍然未知,但脂滴定位离不开PAT 结构域和11-mer 区域,同时也不能忽略C-末端区域的作用,并且脂质核心、单层磷脂和脂滴上其他蛋白质分子的性质也会对其有所影响。PLINs 究竟如何靶向脂滴,目前仍然未知,但PLINs 之间高分辨率三维结构的比较分析将有利于揭示PLIN1 与脂滴之间的物理相互作用。
虽然已知Fsp27 是脂滴融合的必要条件,PLIN1可与其相互作用共同促进脂滴的融合,但仍不足以解释脂肪细胞中大脂滴是如何形成的。与Fsp27 相互作用的是PLIN1 的哪一种蛋白亚型,脂滴融合是否有其他潜在成分发挥作用,是否有其他细胞途径促进脂滴融合,仍需继续探究。此外,关于PLIN1 的不同蛋白亚型鲜有报道,其表达规律和脂滴定位是否有所不同,在调控脂解中所起的功能是否存在差异,需要进一步深入研究。
肥胖对机体健康有严重影响,不仅限于胰岛素抵抗、糖尿病和冠心病。探究PLIN1 的表达与肥胖之间的潜在联系,重视Plin1基因多态性对肥胖的影响,将对研究肥胖的发生发展,以及针对性的肥胖预防和治疗具有重要意义和应用价值。PLIN1 是抑制脂肪组织炎症和胰岛素抵抗的关键调节剂,说明PLIN1 介导的脂质代谢可能是治疗炎症相关的代谢性疾病以及脂质失调的潜在靶标。此外,人PLIN1 的突变及其造成的遗传性脂肪营养不良突显了PLIN1 在全身能量稳态中的临床意义。针对PLIN1 功能、调控脂解分子机制的深入探究,将有助于解决肥胖、炎症反应、脂肪营养不良等相关领域的难题。
