湖羊与澳湖F1代羔羊短期育肥效果的比较
2021-06-18宋其志李发弟李国泽李晓龙张煜坤张德印张小雪王维民
宋其志,李发弟,李国泽,赵 源,李晓龙,张煜坤,张德印,张小雪,3,李 冲,3,王维民
(1.甘肃农业大学动物科学技术学院,甘肃兰州730070;2.兰州大学草地农业科技学院,甘肃兰州730070;3.甘肃省肉羊育种生物技术工程实验室,甘肃武威733000)
随着畜牧业的不断发展,人们对于养羊业的要求也随之不断提高。19世纪以后,随着全世界羊肉的生产和消费显著增长,人们不仅重视羊毛产业的发展,肉羊产业也开始迅速地在全世界发展。许多国家都开始生产优质羊肉,特别是羔羊肉,并且大量引入优良品种与当地品种杂交,以期培育生产性能优异的新品种[1]。
湖羊(Hu sheep)是我国特有的绵羊品种,具有早熟、四季发情、繁殖力高、生长发育快等优良特性,但其产肉性能与其他专门化肉羊品种仍存在较大的差距[1]。因此,我国通过选择国外的专门化肉用品种与地方品种杂交,以改良地方品种的生产性能[2]。澳洲白绵羊(Australian white sheep)是澳大利亚优质的肉羊品种,具有全年发情、生长快、体型大、肉质好、抗逆性强等优良特点[3]。张永东等[4]研究不同肉羊杂交组合杂交效果发现,引进品种与地方品种杂交改良效果显著,后代表现优良的生产性能,繁殖性能显著提高,表现出明显的肉用体型。陈广仁等[5]在对杜湖杂交组合研究中表明,杜泊羊与湖羊杂交后,在生长性能及屠宰性能等方面都有显著提高。
本研究以我国特有且市场占有率高的湖羊及其与专门化肉用绵羊品种澳洲白绵羊杂交后F1代羊为研究对象,对澳湖F1杂种羊与湖羊的生长性能、胴体性能、体组成和羊肉品质等性状进行比较分析,目的在于为湖羊和澳洲白绵羊杂种优势利用和新品种(系)培育提供数据支持,促进地方养羊产业的快速发展,培育适应当地气候和饲料资源的杂交类群,增加肉羊养殖业的收入。
1 材料与方法
1.1 试验区概况
民勤县地处甘肃省河西走廊东北部,平均海拔1400 m,四季分明,降水量不多,光照时间长,年均气温28.3℃。试验羊舍东西走向,内有两列单栏。净高度为2.5 m,由隔栏分为单栏,隔栏高度1.0 m。每个单栏宽0.8 m,长1.2 m。圈舍围栏底部为漏粪地板,其余地面为水泥。羊舍夏季平均温度28℃,冬季平均温度5℃,相对湿度25%。
1.2 试验动物及饲养方式
试验所用羊均来自武威普康养殖有限公司(甘肃省武威市),育肥和屠宰在民勤县德福农业科技有限公司(甘肃省民勤县)开展。随机选择122只(湖羊和澳湖F1代羔羊各61只)具有详细系谱信息、体况良好、日龄(135 d ± 5 d)和体重接近的公羔进行试验。试验预饲期10 d,正式期60 d,每20 d为一期,共进行3期生长性能测定,于育肥结束后进行屠宰。试验羊只全部饲喂全价颗粒日粮,试验羊全部舍饲,单栏饲养,每个单栏均设有单独的喂料槽和饮水器,并进行标准免疫。
1.3 试验饲粮配方和加工
饲粮营养水平参考中华人民共和国农业行业标准–肉羊饲养标准(NY/T 816-2004)[6],配方计算、测定及其他营养指标参考中国饲料成分及营养价值表(第26版)[7]。试验饲粮按配方加工为颗粒饲料,制粒温度为70℃,颗粒直径为6 mm。饲粮配方组成及营养水平如表1所列。
1.4 屠宰取样
屠宰前,记录宰前活重,采用标准的屠宰方式屠宰,屠宰后取第9~13根肋骨处背最长肌肉样500 g,用于肉质性状测定。

表1 饲料组成成分及营养水平(风干基础)Table 1 Ingredients and chemical composition of the experimental diet (air-dry basis)
1.5 性状指标测定
性能测定参照赵有璋[8]方法,主要测定生长指标、胴体指标、体组成指标和肉质指标。
1.5.1 生长指标
测量指标包括初始重(0 d)和20、40、60 d的体重,并记录全期采食量。体重均在晨饲前空腹称重。
根据张小雪[9]的研究,计算饲料转化率(feed conversion ratio, FCR)。FCR = 平均日采食量(g·d−1)/平均日增重(g·d−1)。
1.5.2 胴体指标
屠宰放血,去头、蹄、毛皮、尾部、内脏(不包括板油和肾脏)后称重,记为胴体重,参照杨再俊等[10]的方法测定背膘厚度、眼肌面积和胴体脂肪含量(GR)。
1.5.3 体组成指标
屠宰后,将所有组织器官与胴体分离,包括头、蹄、皮毛、心、肝、脾、肺、肾、尾脂、肾周脂、肠系膜脂肪等部位,用台秤称量并记录。
1.5.4 肉质指标
在屠宰结束后45 min内和排酸24 h后,用酸度计直接测定样品pH,45 min测定记为pH1;24 h后测定记为pH2。
肌肉失水率使用压力仪(C-LM3B,Tenovo,北京)测定;参照标准方法[11-13]测定肌肉熟肉率、滴水损失和肉色指标,其中屠宰后45 min的肉色指标记为a*1、b*1、l*1,屠宰后24 h肉色指标记为a*2、b*2、l*2。
1.6 统计分析
统计所有试验数据并使用Excel 2010整理,各性状指标的比较分析利用SPSS 25.0软件进行独立样本T检验比较,以P<0.01为差异极显著,P<0.05为差异显著,统计数据用均值± 标准差表示。
2 结果与分析
2.1 生长性能
湖羊与澳湖F1代羔羊间,其初始体重和末期体重均无显著差异(表2),但澳湖F1代羔羊的末期体重高于湖羊(P>0.05)。湖羊在饲养0~20 d日增重(ADG)极显著高于澳湖F1代(P< 0.01),但在21~40 d和41~60 d澳湖F1代羔羊生长速度加快,且显著高于湖羊(P<0.05),表明湖羊早期生长发育快,澳湖F1代羔羊后期生长潜力较大。0~60 d饲养全期湖羊和澳湖F1代羔羊ADG差异不显著(P>0.05)。0~60 d饲养全期湖羊和澳湖F1羔羊的平均日采食量(ADFI)和饲料转化率(FCR)均无显著差异。
2.2 屠宰性能
澳湖F1代羔羊与湖羊在胴体长、胴体胸围、臀围和眼肌面积间存在显著(P<0.05)或极显著差异(P<0.01)(表3),其中湖羊在育肥60 d屠宰时眼肌面积、胴体臀围极显著低于澳湖F1代羔羊(P<0.01),胴体长极显著高于澳湖F1代羔羊(P<0.01),胴体胸围显著低于澳湖F1代羔羊(P<0.05)。
2.3 组织器官
湖羊与澳湖F1代羔羊的组织器官绝对重与相对重如表4所列。澳湖F1代羔羊与湖羊在皮毛、心脏、肝脏、肾周脂肪、肠系膜脂肪和尾部脂肪的绝对重及其相对重(宰前活重)存在显著差异(P<0.05),其中澳湖F1代羔羊的心脏、肝脏、肺脏、肾脏的绝对重极显著高于湖羊(P<0.01),肾周脂肪、肠系膜脂肪和尾部脂肪的绝对重和相对重(宰前活重)等与脂肪沉积相关的指标均极显著低于湖羊(P<0.01);头重、蹄重绝对重和相对重(宰前活重)无显著差异(P>0.05)。

表2 湖羊与澳湖F1代羔羊的生长性能比较Table 2 Comparison of growth performance between Hu lambs and Australian-Hu F1 lambs
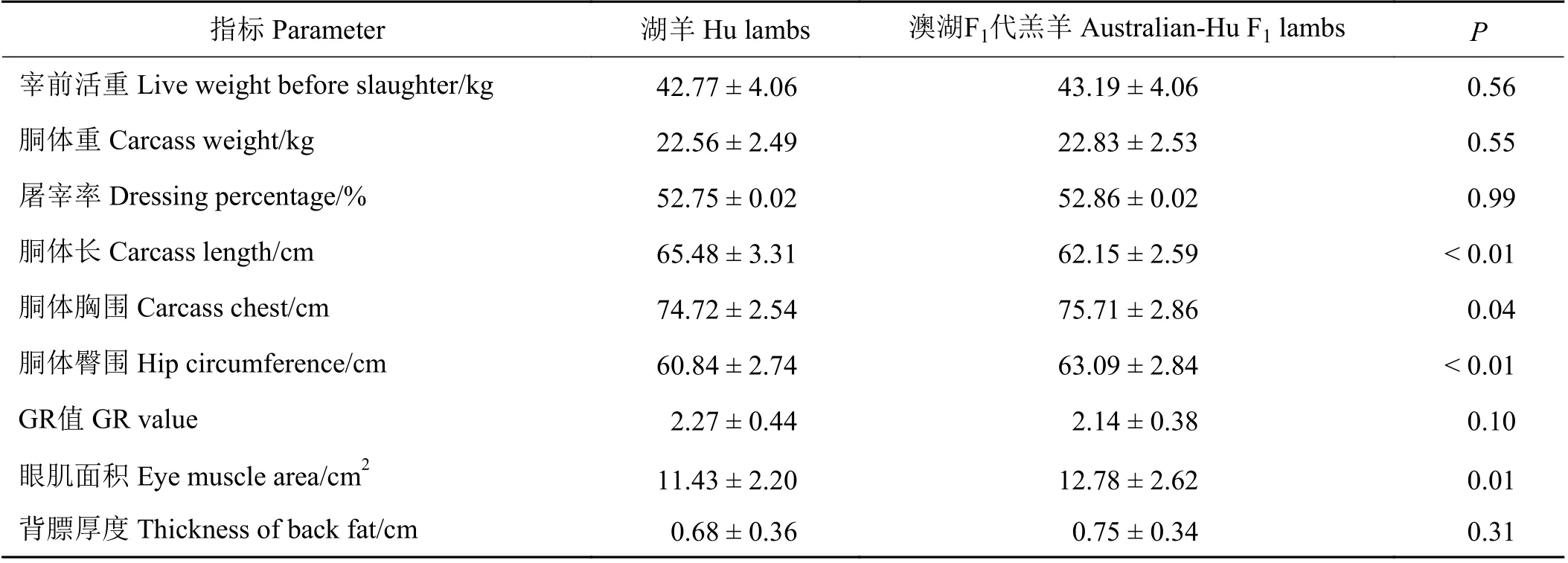
表3 湖羊与澳湖F1代羔羊的胴体性状比较Table 3 Comparison of carcasstraitsbetween Hu lambsand Australian-Hu F1 lambs
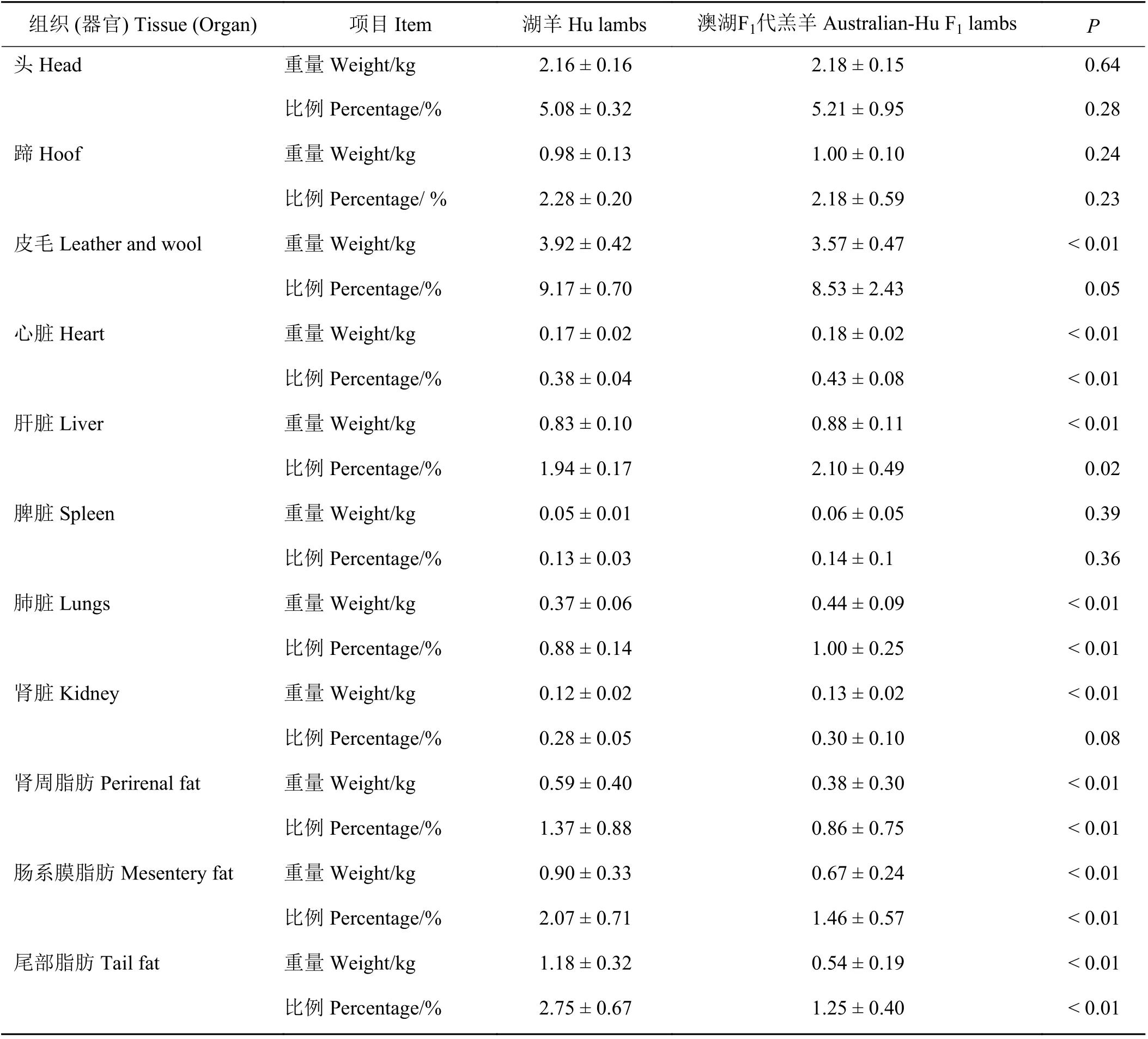
表4 湖羊与澳湖F1代羔羊的组织器官比较Table 4 Comparison of tissues and organs between Hu lambs and Australian-Hu F1 lamb
2.4 肌肉品质
湖羊与澳湖F1代的肌肉品质分析如表5所列。澳湖F1代羔羊与湖羊的失水率、熟肉率、肌肉pH1、肉色b*2和肉色l*2存在显著差异(P<0.05);其中澳湖F1代羔羊肌肉的失水率、屠宰后24 h肉色b*2值和l*2值显著(P< 0.05)或极显著高于湖羊(P< 0.01),熟肉率和肌肉pH1均极显著低于湖羊(P<0.01);其余肉质指标均无显著差异(P> 0.05)。

表5 湖羊与澳湖F1代羔羊的肉质性状比较Table 5 Comparison of meat quality between Hu lambsand Australian-Hu F1 lambs
3 讨论
3.1 生长与肥育性能
利用国外引进专门化肉用品种与地方品种进行杂交,是改良地方品种肉用性能的重要途径[14]。本研究以湖羊和澳湖F1代羔羊为研究对象,通过单栏测定,系统比较了其生长、屠宰、体组成和肌肉品质,以期为湖羊的杂交改良提供数据支撑。本研究结果发现,湖羊在饲养期0~20 d日增重极显著高于澳湖F1代,但在21~40和41~60 d澳湖F1代羔羊生长速度加快,且显著高于湖羊。这与湖羊和澳洲白绵羊的生长发育规律相符。与澳洲白绵羊等国外引进的专门化肉用品种相比,湖羊具有早熟、早期生长发育快的特点,结果表明湖羊早期生长发育快,而湖羊与澳洲白绵羊杂交生产的澳湖F1代羔羊后期生长潜力较大[15]。另外,澳洲白绵羊属国外引进品种,其在国外以放牧为主,对国内舍饲条件的适应性可能不及湖羊。因此在相同的过渡期条件下,湖羊更易适应舍饲环境。此外,结果显示,0~60 d饲养全期湖羊和澳湖F1代羔羊ADG以及末期体重均差异不显著,可能与本研究饲养期较短有关,在饲养第2期(21~40 d)和第3期(41~60 d)时澳湖F1代羔羊的生长速度明显加快,表明澳湖F1代羔羊后期生长潜力大。因此,在后续研究中应适当延长饲养的过渡期和性能测定周期,使澳湖F1代羔羊进一步充分发挥其生长潜力。刘明丽等[16]对比澳洲白与湖羊杂交F1代性能测定的研究结果表明,澳湖F1代羔羊在2月龄、4月龄、6月龄体重显著大于湖羊,但差异不显著,与本研究结论相似。
3.2 胴体性状
本研究结果表明,与湖羊相比较,澳湖F1代羔羊的胴体胸围、臀围和眼肌面积均有显著提升。澳湖F1代羔羊的眼肌面积显著大于湖羊,而眼肌面积越大其产肉量也越多,可间接表明杂交后对于后代的胴体产肉量有显著的提升。背膘厚和GR值可反映胴体脂肪含量的多少,本研究结果中澳湖F1代羔羊胴体背膘厚和GR值与湖羊无显著差异,表明澳湖F1代羔羊胴体相关指标及产肉量有所增加,但其胴体脂肪含量有效减少。尾脂、肾周脂和肠系膜脂肪是绵羊脂肪沉积的主要形式之一,澳湖F1代羔羊的尾部脂肪、肾周脂肪、肠系膜脂肪绝对重量及相对重量均极显著低于湖羊。这些脂肪的利用价值和经济价值远低于瘦肉,过多脂肪沉积会减少机体对饲料的利用效率[17-19]。以上结果也表明,尽管澳湖F1代羔羊的胴体质量与湖羊无差异,但其产肉性能和胴体可食比例要优于湖羊。田瑛等[20]、王志武等[21]、杨富民[22]的研究结果也表明,与优异引入品种进行杂交,其后代的生产性能、饲料效率等指标均有不同程度的提高,但本研究中澳湖F1杂交羔羊的脂肪沉积显著减少。动物胴体性状的巨大差异也就造成了不同的经济效益,通过杂交表现出的不同杂交优势,以期待为养殖业创造更大的经济效益。
3.3 体组成
脏器的组成及其重量是评价动物遗传品质的重要依据,具有重要的指导意义。本研究的结果显示湖羊的头、蹄和皮毛占宰前活重的比例高于澳湖F1代羔羊,可增加一定的经济效益。反刍动物内脏器官的重量有可能会与动物的生长速度相关,这与组织器官参与机体的新陈代谢有关。本研究湖羊除了脾脏和肺脏,其余脏器的绝对重和占宰前活重的比例均低于澳湖F1代羔羊。反刍动物内脏组织的总耗氧量为35%~60%[23],在新陈代谢活跃的细胞中,例如肝脏、肾脏等,线粒体供能约占细胞总能量的90%,而这些细胞约占总重量的10%[24-26]。因此,表明脏器的重量可能会与畜禽生长速度相关,这也解释了湖羊和澳湖F1代羔羊在不同阶段中生长速度的差异。
3.4 肉质性状
肌肉品质是肉用家畜重要的经济性状,同时也是衡量杂交效果的重要指标之一[27-28]。系水力和熟肉率分别代表肌肉在机械压力和烹饪过程中羊肉的保水能力[29]。本研究中澳湖F1代羔羊肌肉的失水率显著高于湖羊,而熟肉率显著低于湖羊,表明湖羊与澳洲白绵羊杂交后肌肉的保水性能下降。有研究表明失水率会受到pH的影响[30],而肌肉品质的优劣可通过pH反映。刚屠宰时羊肉的pH在6.0~7.0,排酸后肌肉僵直时为5.4~5.8,pH的下降是由于肌肉内糖原进行无氧糖酵解导致乳酸积累引起[31]。本研究中湖羊屠宰后肌肉的pH1(45 min)显著高于澳湖F1代羔羊,可能与湖羊肌肉的保水能力强于澳湖F1代羔羊有关。肉色对肉的风味影响不大,但易影响消费者的视觉感受,澳湖F1代羔羊在肉色l*2优于湖羊,表明杂交后代肉品具有较理想的外观。孙洪新等[31]对不同品种杂交羔羊肉品质比较的研究也表明,引入杂交组合绵羊群体的的肉色、营养价值更优良,但失水率等肉质物理指标会相对降低,要更注意保水,以防止失水过多肉质变干。
4 结论
在本研究条件下,湖羊与澳洲白绵羊杂交后能有效提高F1代羔羊的胴体胸围、胴体臀围、皮毛、心脏、肝脏重量,降低了“羊三脂”(尾部脂肪、肾周脂肪和肠系膜脂肪)沉积能力,但肌肉失水率上升,熟肉率下降。在肉羊产业发展中,选择引进的专门化肉用品种与地方品种进行杂交,可在有效提高胴体生产性能的同时,改善羊肉品质,产生更高的经济效益。
