基于铁死亡相关基因的生物信息学分析构建肺鳞癌预后模型研究
2021-06-18胡文龙梁惠芳
胡文龙,梁惠芳,李 明
(暨南大学附属顺德医院呼吸内科,广东 佛山 528000)
肺癌作为我国最常见的肿瘤之一,在男性肿瘤中的发病率和致死率均居首位[1]。肺癌的主要类型是非小细胞肺癌(NSCLC),其所占比例为85%~90%,而肺鳞状细胞癌(简称肺鳞癌)是NSCLC第二常见病理亚型[2]。由于肺鳞癌缺乏早期诊断和预后的生物标志物,且易发生局部浸润和转移,肺鳞癌患者中多数人5年生存率低于15%[3]。因此,通过肺鳞癌预后相关的生物标志物对肺鳞癌患者的预后情况进行早期评估,对于肺鳞癌患者的预后及治疗尤为重要。
铁死亡是程序性细胞死亡的形式之一,其主要特点是发生在线粒体内的铁依赖性脂质过氧化物损伤诱导了细胞的死亡[4]。铁死亡与阿尔兹海默病、急性肾损伤、心肌缺血再灌注损伤、肿瘤的增殖和凋亡等多种疾病的发生、发展密切相关[5]。肺癌组织中普遍存在着更高的活性氧和脂质氧化标志物水平,这提示肺癌细胞中可能存在铁死亡。CHEN等[6]研究表明,毛兰素可以诱导肺鳞癌细胞铁死亡,并伴随ROS聚集、脂质过氧化和谷胱甘肽耗竭,抑制肿瘤细胞迁移从而达到抗癌的目的。此外,JIANG等[7]研究也表明,诱导细胞铁死亡也是p53抑制肺癌生长的重要途径,但铁死亡的调控是由多个氧化应激途径和代谢途径共同作用,因此铁死亡相关基因在肺癌发生中起到重要作用。为探索可靠的铁死亡相关基因对于肺鳞癌预后评估的意义,本研究拟通过分析TCGA数据库中肺鳞癌的高通量测序数据,筛查出差异表达的铁死亡相关基因,并加以分析构建临床预后模型,为肺鳞癌患者提供个体化治疗和预后评估方面的依据。
1 资料与方法
1.1一般资料 2020年9月从TCGA官方网站下载(https://gdc-portal.nci.nih.gov/)肺鳞癌患者肿瘤组织和癌旁组织的mRNA高通量测序数据及临床资料。使用R软件中的Limma包对测序的基因表达谱做归一化。下载的数据内容有肺鳞癌患者的两类mRNA表达数据,包括502例肿瘤组织和49例癌旁组织。临床数据包含了502例肺鳞癌患者ID号、年龄、性别、病理分期、生存时间、生存状态等临床信息,为了减少统计学误差,剔除生存时间少于30 d的患者信息,最终纳入482例肺鳞癌患者。TCGA数据都是公开的,因此本研究免除了地方伦理委员会的批准。
1.2方法
1.2.1代谢相关基因提取和处理 下载并阅读PubMed、EMBASE、Web of Science、万方数据库中国知网,维普数据等数据库中的铁死亡相关文献[8-12],选取整理好的60个铁死亡相关基因作为研究对象。使用R软件中的“Limma”包筛选肺鳞癌组织和癌旁组织的差异铁死亡相关基因,以伪发现率(FDR)<0.05为阈值;采用单因素Cox回归筛选与预后相关的铁死亡相关基因,上述2个条件筛选的基因取交集,并绘制热图。
1.2.2LASSO回归分析为了避免单因素Cox回归分析所得的基因有过度拟合,通过R软件“glmet”包进行LASSO回归再次筛选基因。本研究使用10折交叉验证来确定λ的值,并且选择偏似然偏差最小的λ作为最优λ。一旦确定了预测基因,笔者应用它们构建基于风险评分的预后模型,风险评分表达式如下所示。
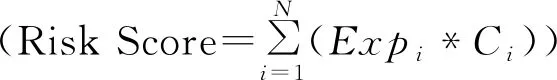
其中N是基因数,Expi是基因的表达水平,Ci是lasso回归分析得到的回归相关系数。根据预后模型可以计算出每一个肺鳞癌的风险评分大小,通过风险评分的中位数值,模型将纳入的肺鳞癌患者划分为高风险组和低风险组。基于预后模型中基因的表达情况,采用R软件中的“stats”包对基因表达量进行主成分分析和不同组别的分布情况分析(t-SNE)。
1.2.3预后模型评价和K-M生存分析 采用R软件中的“survival”包并利用K-M生存分析对高风险组和低风险组进行评价;其次,通过 “timeROC”包对3年及5年总生存率的ROC曲线下面积(AUC)值进行计算,对预后模型的预测能力进行评价。除此之外,本研究结合年龄、性别、病理分期等临床信息,采用多因素Cox回归对预后模型进行分析,以验证构建的模型的预测能力是否独立于其他临床因素,可以成为独立的预测因子。
1.2.4功能富集及免疫功能状态分析 继续利用R软件“cluster profiler”和“Limma”包对高风险组和低风险组之间的差异基因(log2FC的绝对值大于1,FDR<0.05)进行基因本体论(GO)和京都基因百科全书(KEGG)分析。运用“ssGSEA”包对两组的免疫细胞浸润分数和免疫相关功能的活性进行定量计算。

2 结 果
2.1纳入患者的基本情况 最终符合纳入标准的肺鳞癌患者482例,其中男性患者死亡235例(71.43%),未死亡112例(73.20%);女性患者死亡94例(28.57%),未死亡41例(26.80%);肺鳞癌死亡患者平均年龄(68.7±6.9)岁,未死亡患者平均年龄(65.4±8.5)岁,表1中包含患者种族、吸烟、化疗、放疗、生存时间等情况。见表1。
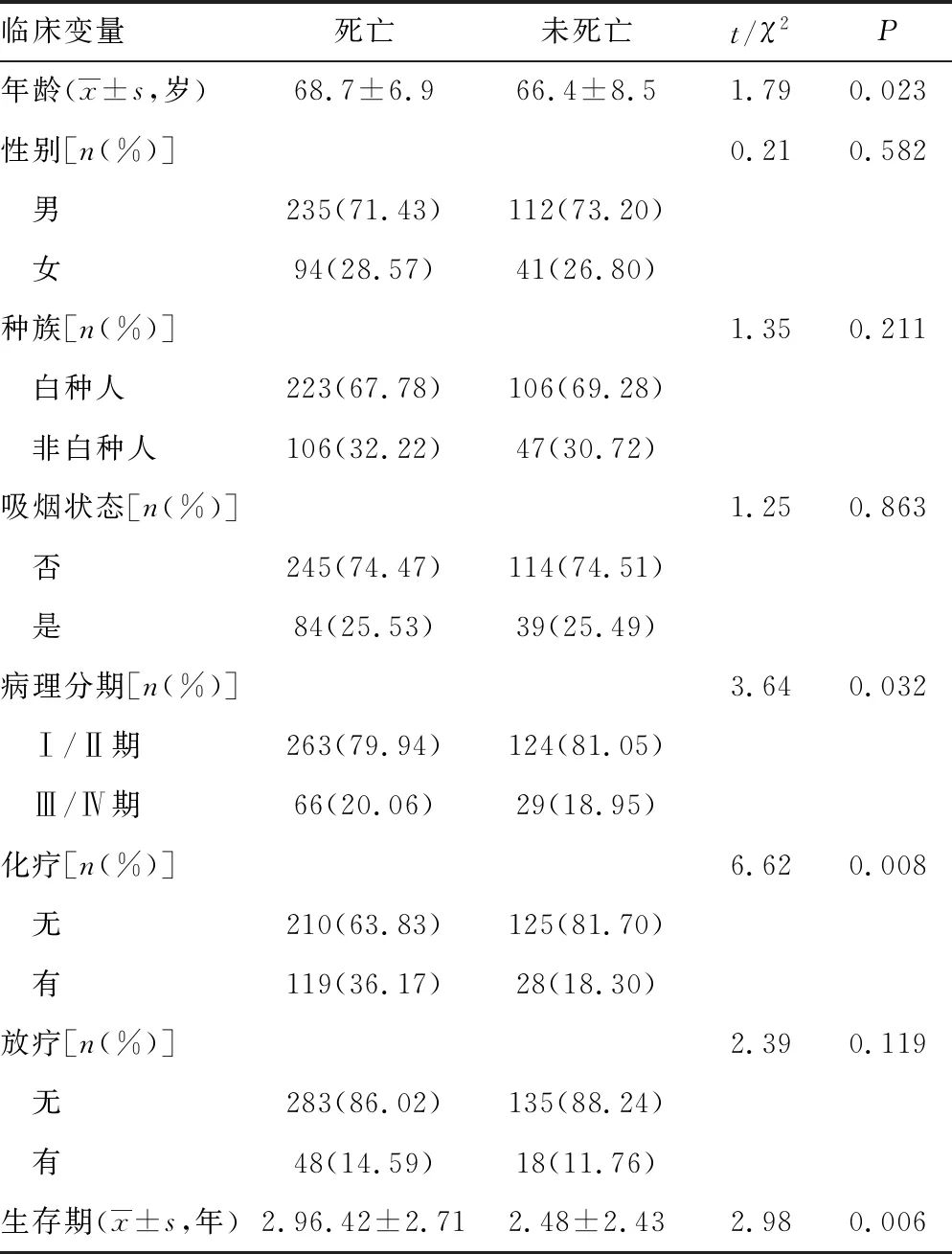
表1 从TCGA数据库中纳入分析的肺鳞状细胞癌患者的基本特征(n=482)
2.2肿瘤组织和正常肺组织中差异表达的铁死亡相关基因 对482例肺鳞癌患者肿瘤组织和49例癌旁正常肺组织的铁死亡相关基因进行Wilcoxon非参数秩和检验,经分析满足条件FDR<0.05的基因共有52个。大部分的铁死亡相关基因在两组间都有差异表达(86.67%,52/60)。
2.3与肺鳞癌预后相关的关键铁死亡相关基因的确定 单因素Cox回归分析显示5个基因与总体生存时间有关,图1A。上述条件取交集的基因也是5个,图1B,他们分别是ALOX5,TFRC,PHKG2,FADS2,NOX1,基因表达量的热图见图1C。通过LASSO回归分析进一步确定了这5个铁死亡相关基因均是关键基因。见图2A、2B及表2。

表2 5个关键基因的详细信息
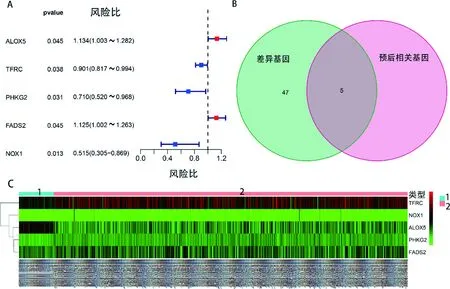
A为与预后相关的铁死亡基因;B为差异的铁死亡基因和预后相关的铁死亡基因的交集;C为5个铁死亡基因表达量的热图;C中1代表癌旁组织,2代表肺鳞癌组织。
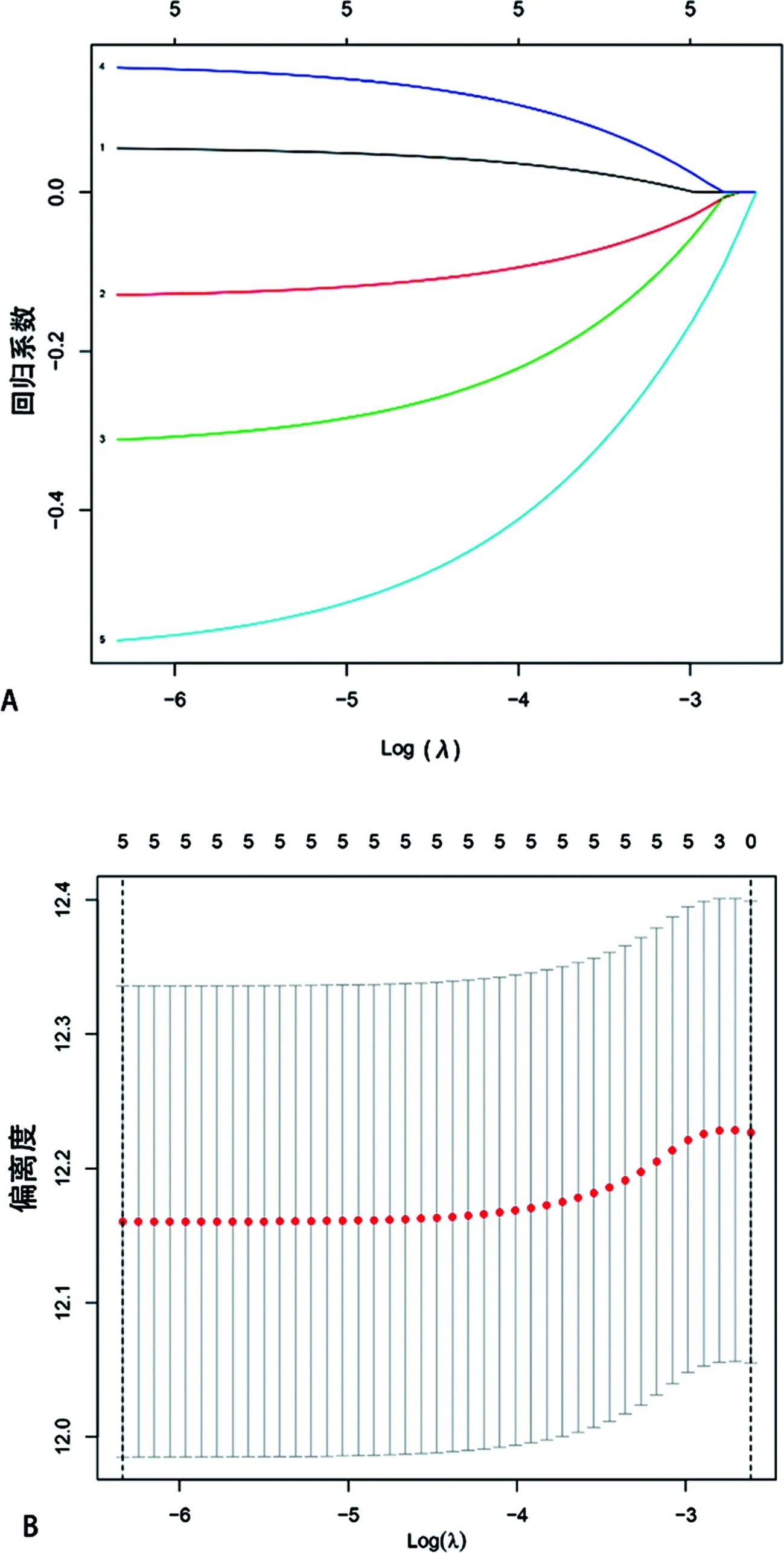
A代表LASSO回归系数分布的剖面图,B代表采用10倍交叉验证选择最优的λ值。
2.4肺鳞癌预后模型的构建和评价 基于LASSO回归分析确定的预后模型将所有患者分为高风险组和低风险组两组,主成分分析和t-SNE分析表明,不同风险程度的两组患者分布在两个方向,见图3。用K-M生存分析评估该模型的预测能,结果表明高风险组的中位生存期为1.65年,而3、5年生存概率分别为47%和37%;低风险组的中位生存期为2.26年,3、5年的生存概率分别为69%和55%,低风险组总体生存期比高风险组长,差异有统计学意义(P<0.05),见图4A;3年总生存率的ROC曲线下面积AUC=0.635,5年总生存率的ROC曲线下面积AUC=0.619,见图4B。同时,所有患者的风险评分分布及风险评分与生存时间的关系也提示高风险组的患者可能更早死亡,见图5A、5B。以总生存时间为因变量,预后模型所计算的风险评分、年龄、性别、病理分期等临床指标作为协变量进行多因素Cox回归分析,其结果表明该预后模型可以作为一个独立的预测预后的因子[风险比(HR)=2.893,95%置信区间=1.687~3.379,P<0.05],见图6。
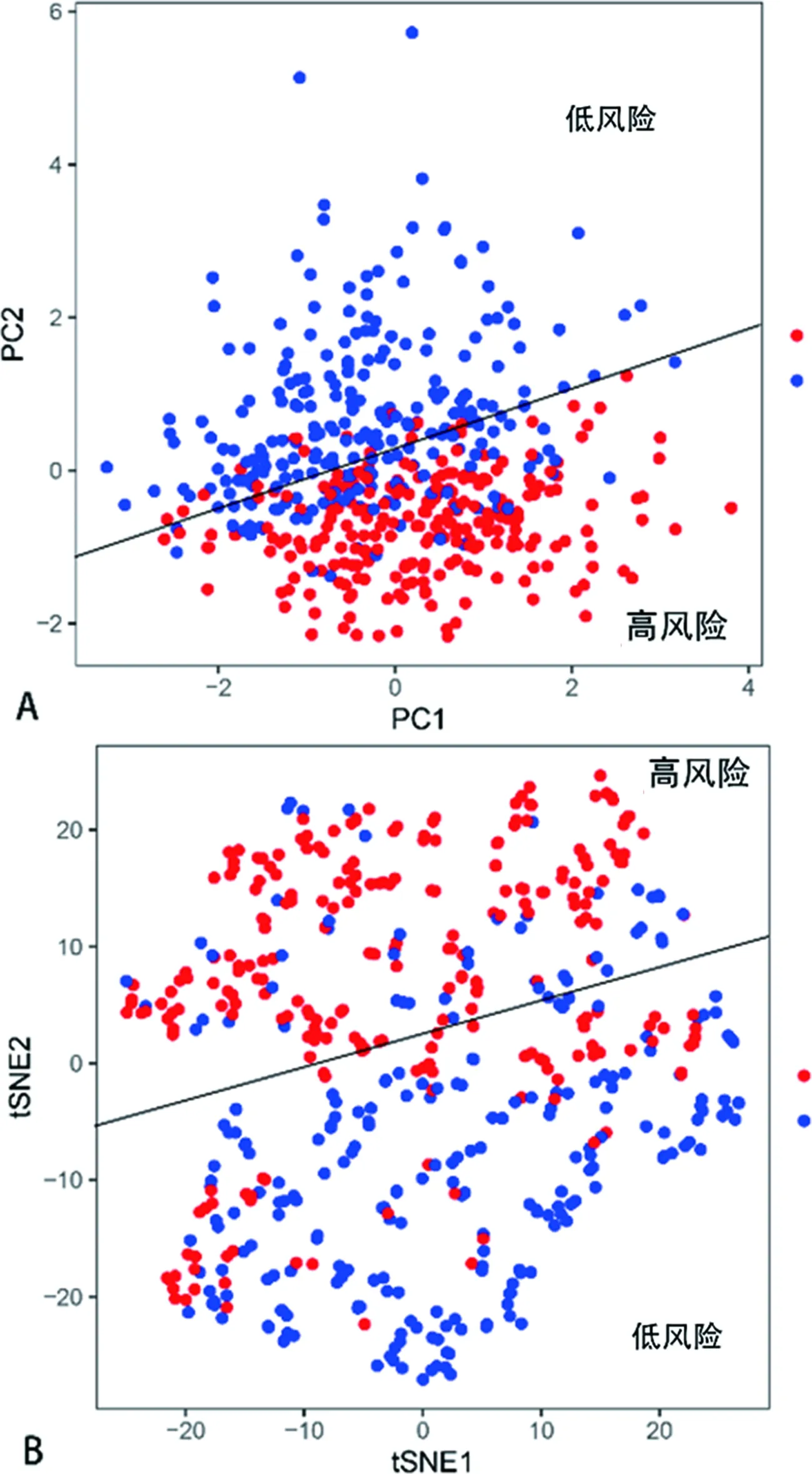
A为主成分分析,B为t-SNE分析。
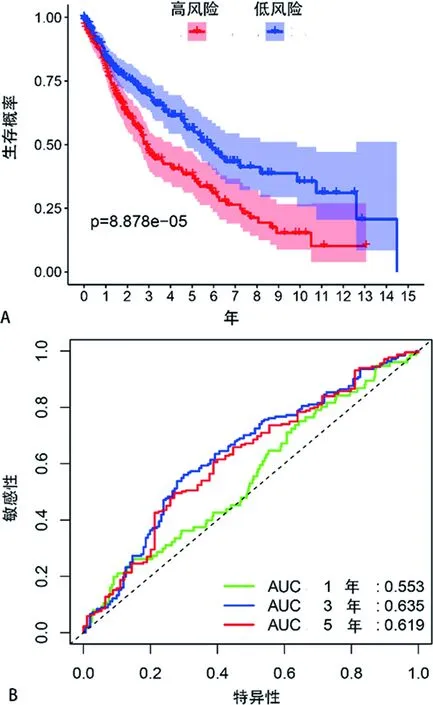
A为肺鳞癌患者的生存曲线,蓝色代表低风险人群,红色代表高风险人群;B为预后模型的ROC曲线。
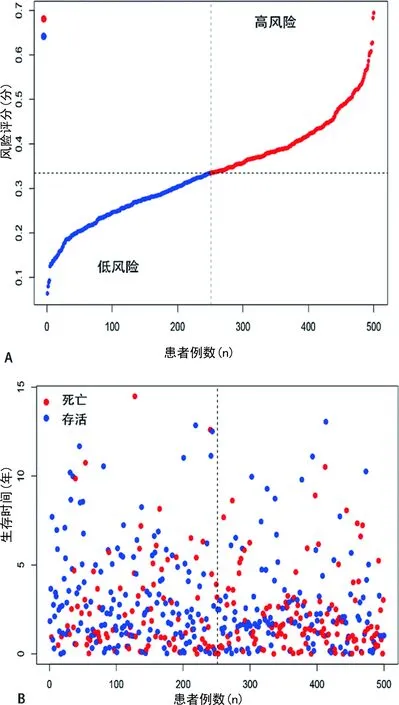
A为肺鳞癌中风险评分的分布情况;B为风险评分与生存时间的关系,黑色虚线是把患者分为高风险组和低风险组的最佳分界线。
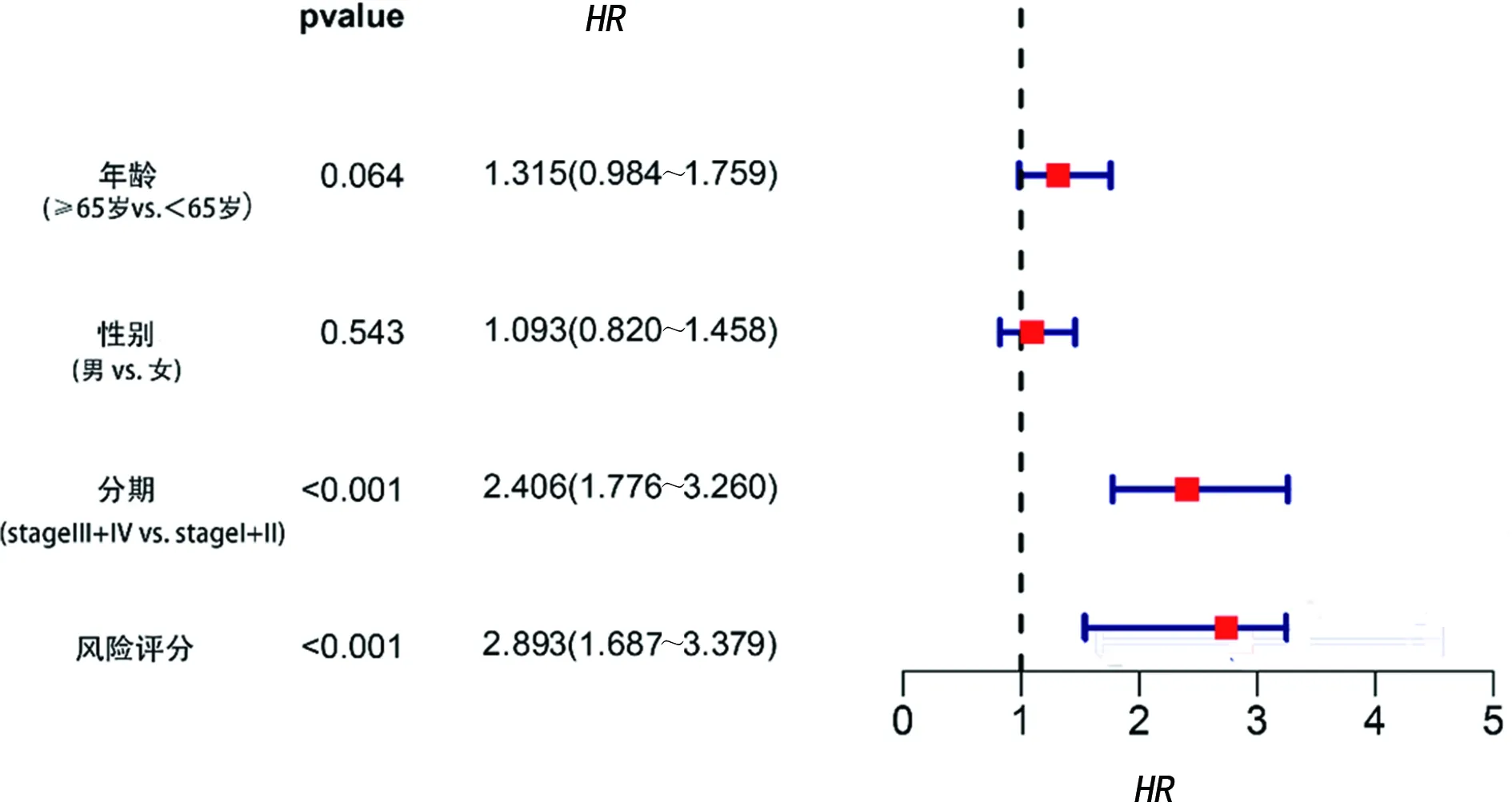
图6 多因素Cox回归分析风险评分与预后关系的森林图
2.5功能富集分析 为了阐明和预后风险评分相关的生物学功能和通路,利用高风险组和低风险组之间的差异基因进行GO富集和KEGG通路分析。结果发现离子通道活性和离子门控通道活性等几个和铁相关的分子功能在两组的差异基因中均有富集,见表3。但值得注意的是,高风险组和低风险组的差异基因也显著存在于许多与免疫相关的生物学过程中,如细胞因子与细胞因子受体的相互作用,细胞外基质受体途径(P<0.05)。
2.6免疫功能状态分析 在所纳入的患者中,巨噬细胞,NK细胞,中性粒细胞等免疫细胞在高风险组和低风险组之间有显著差异(P<0.05)。其次,除了抗原呈递细胞的抑制功能差异无统计学意义(P>0.05)外,其余免疫功能在高风险组和低风险组差异均有统计学意义(P<0.05)。见图7。
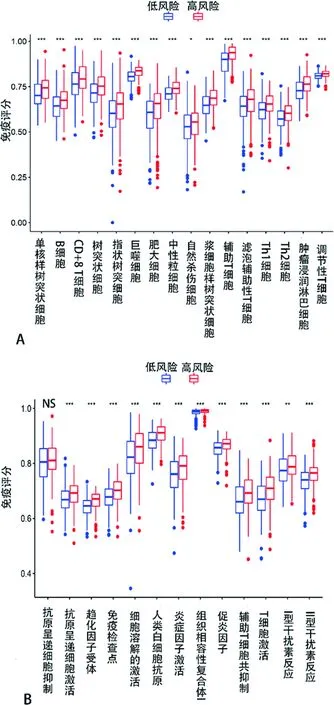
图7 高、低风险人群与免疫细胞及免疫功能的关系

表3 GO富集和KEGG通路分析

续表3 GO富集和KEGG通路分析
A为免疫细胞亚群图,B为免疫相关功能图,NS代表差异无统计学意义。
3 讨 论
铁死亡是否可以像凋亡和自噬等程序性死亡一样,参与机体的发育和正常生理过程,目前仍在积极研究中,但是关于铁死亡在肿瘤中的潜在作用已经有很多报道[13-14]。大多数肿瘤处于高氧化应激状态,以致肿瘤细胞也需要通过增加ROS的清除能力,以防止氧化损伤,因此多数肿瘤(如肝细胞癌、骨肉瘤、前列腺癌、卵巢癌等)细胞比较易受铁死亡的影响[15]。肺部组织相比与其他组织处于高氧浓度的环境中,这种特殊的环境造就了肺部肿瘤需要承受很大的氧化压力。为了应对氧化压力,肺癌细胞系的System xc-上调水平在癌症细胞中的相对较高以抵抗铁死亡[16]。此外,铁死亡相关基因半胱氨酸脱硫酶(NFS-1)在肺癌细胞中表达较高,进一步实验发现NFS-1明显缓解了高氧诱导的细胞铁死亡,动物实验中也发现NSF-1敲除后细胞成瘤时间明显延长[17]。这表明铁死亡相关基因调控的铁死亡在肺癌的增殖和凋亡中发挥着重要作用。鉴于此,作者有理由推测铁死亡相关基因在预测预后方面可能也发挥一定作用,为临床鉴定理想的预后标志物提供参考。
本研究通过文献查阅及生物信息技术,系统地分析了60个铁死亡相关基因在肺鳞癌组织中的表达及其与总体生存期的关系,首次构建了一个基于5个铁死亡相关基因的预后模型,该模型将482例肺鳞癌患者分为了高风险和低风险组,两组患者差异基因主要富集于免疫相关通路中。 虽然以往研究表明,部分铁死亡基因可能调节药物诱导的肺鳞癌中的铁死亡现象[17],但是这些基因的表达与肺鳞癌患者的总体生存期相关性仍然需要进一步研究。但值得注意的是,大多数铁死亡相关基因(86.67%)在肺鳞癌组织和癌旁组织中都有差异表达,单因素Cox回归分析显示其中5个铁死亡相关基因与总体生存期相关。这些结果都表明铁死亡在肺鳞癌中的潜在作用,以及利用铁死亡相关基因建立预后模型的可能性。
本研究建立的预后模型由5个铁死相关基因(ALOX5、TFRC、PHKG2、FADS2、NOX1)构成。这些基因主要和4种代谢有关,即脂代谢、铁代谢、能量代谢和抗氧化代谢。花生四烯酸5-脂氧合酶(ALOX5)是一种起始酶,主要介导炎症介质白细胞三烯和脂氧素生成,是肿瘤细胞存活的关键调节因素,ALOX5基因可通过过表达而抑制由于药物诱导导致的铁死亡[18]。转铁蛋白受体(TFRC)是重要蛋白质分子,在机体铁的运输、转化和利用等铁代谢过程中起到关键作用,此外还可介导细胞生长、增殖及代谢,过度表达的TFRC能显著抑制由c-Myc引起肿瘤的形成过程[19]。磷酸化酶催化亚基γ(PHKG2)基因抑制会导致线粒体中铁的累及和随后的氧化损伤,从而导致毛兰素诱导的肺鳞癌细胞铁死亡[20]。脂肪酸去氧饱和酶基因2(FADS2)可通过在脂肪酸的烃链中引入双键来达到调节多不饱和脂肪酸合成的目的,FADS2的过度表达可以加速肿瘤细胞的铁死亡进程,进而抑制肿瘤的生长[21]。酰胺腺嘌呤二核苷酸磷酸氧化酶1(NOX1)参与催化产生活性氧过程,NOX1的敲除可以通过阻止肿瘤细胞脂质活性氧的诱导来抑制毛兰素诱导的铁死亡[22]。
虽然以往研究显示,肿瘤的免疫机制一直是热门的研究领域,但肿瘤免疫和铁死亡之间的潜在调控关系仍然未知。作者对高风险组和低风险组患者的差异基因进行了GO和KEGG分析,发现这些差异基因存在于与免疫相关的生物学过程和通路中。根据结果,推测铁死亡与肿瘤的免疫功能之间可能存在密切关联。在本次研究中,低风险组和高风险组的免疫功能存在着显著差异,一种可能性是铁死亡细胞释放不同的信号,如脂质代谢产物、铁代谢产物、细胞因子等,将抗原呈递细胞吸引到铁死亡细胞的位置[23]。此外,通过对比分析,高风险人群都有较高比例的巨噬细胞和调节性T细胞。有研究表明,肿瘤相关巨噬细胞或调节性T细胞的增加和肺癌患者预后不良有关,因为这两类细胞起到免疫侵袭作用[24]。同时,本研究通过免疫功能状态分析还发现高风险评分组患者与抗肿瘤免疫受损相关,高风险组患者的Ⅱ型IFN应答的比例更低,提示该组患者抗肿瘤免疫功能减弱,且可能是预后不良的原因之一。
本研究仍有一些不足之处:(1)铁死亡相关基因建立的预后模型是基于公共数据库TCGA的临床资料和基因表达谱,为验证此模型的临床作用,需根据自身临床数据加以确认;(2)预后模型仅纳入了铁死亡相关基因的表达水平,许多显著与肺鳞癌预后相关的基因可能排除在外;(3)风险评分与免疫功能的关系需要基础实验进一步验证。
综上所述,经多种生物信息学方法筛选出的5个铁死亡相关基因组成的预后模型对肺鳞癌预后有较好的预测价值,可能对肺鳞癌患者人的个体化治疗和评估提供一定依据。
