海洋来源产低温几丁质酶菌株的诱变选育及酶学性质研究
2021-06-18陈立功吴家葳张金平张庆芳迟乃玉王晓辉王梦雨
陈立功,吴家葳,张金平,张庆芳,迟乃玉,王晓辉,王梦雨
(大连大学生命科学与技术学院,辽宁省海洋微生物工程技术研究中心,大连市合成生物学重点实验室,辽宁大连 116600)
几丁质(chitin)是地球上含量仅次于纤维素的可再生资源,在海洋当中含量十分丰富[1-3]。它广泛存在于动植物及微生物中,在虾蟹壳中的含量极高,随着海洋中虾蟹的死亡逐步累积,主要靠海洋中微生物分泌的几丁质酶完成降解[4-7]。但由于自然状态下,几丁质多以晶体状态存在,性质稳定,不溶于水,自然状态下不易降解,所以降解速度远远赶不上产生的速度[8-9]。几丁质酶(chitinase,EC 3.2.1.14)广泛存在于自然界的各种生物体中,能够降解几丁质生成几丁寡糖、几丁单糖及其衍生物,这些降解产物由于具有良好的组织兼容性及免疫抗菌作用被广泛应用于医药、农业等领域[10-12]。
从自然环境中筛选到的野生菌往往产酶活性不高,人们往往通过诱变育种的方式来选育产酶活性高的菌株。根据方式不同分为物理诱变和化学诱变,物理诱变中比较常用的为辐射诱变,即用β射线等射线、粒子或紫外照射诱发菌株变异[13-15]。化学诱变是利用化学诱变剂对菌株进行处理,使其发生基因突变,常用的化学诱变剂有硫酸二乙酯、乙烯亚胺、亚硝酸钠等[16]。为达到更好的诱变效果,往往选择两种或多种方法进行诱变,称之为复合诱变。
本研究对产低温几丁质酶菌株Photobacteriumsp.LG-1进行了BIOLOG生理生化实验,确定了菌株对碳源的利用嗜好性和对化学物质的敏感程度,为提高其产酶活性,对菌株进行了诱变选育,并对菌株LG-1酶学性质及抑菌特性进行了初步研究,为低温几丁质酶在工、农业等领域的应用提供了理论参考。
1 材料与方法
1.1 材料与仪器
产低温几丁质酶菌株 实验室前期从中国辽宁大连渤海海域5~100 m(123°391′E,39°6972′N)筛选得到,命名为Photobacteriumsp.LG-1[17];筛选培养基 胶体几丁质1.0 g/L,蛋白胨10.0 g/L,K2HPO45.0 g/L,KH2PO45.0 g/L,NaCl 5.0 g/L,MgSO4·7H2O 5.0 g/L, ZnSO4·7H2O 5.0 g/L,FeSO4·7H2O 5.0 g/L,琼脂1.5%~2.0%,海水,pH 7.0;2216E种子培养基牛肉膏5.0 g/L,胰蛋白胨5.0 g/L,原地海水配制,pH自然;粉状几丁质培养基 粉状几丁质5.0 g/L,胰蛋白胨5.0 g/L,原地海水配制,pH自然;几丁质粉(chitin)、N-乙酰氨基葡萄糖 美国Sigma公司;胰蛋白胨(Tryptone) 生工生物工程(上海)股份有限公司;马铃薯葡萄糖琼脂培养基 北京索莱宝科技有限公司;其它试剂 均为国产分析纯试剂。
LTI-700低温恒温培养箱 上海爱朗仪器有限公司;DK-S26电热恒温水浴锅 上海精宏实验设备有限公司;CRY-2112恒温摇床 上海茸研仪器有限公司;Thermo Multiskan1510酶标仪 芬兰Labsystems公司;GEN III Microstation全自动微生物鉴定仪 美国BIOLOG公司。
1.2 实验方法
1.2.1 LG-1的BIOLOG生理生化实验 将LG-1划线到BUG培养基上培养24 h后,用无菌棉签蘸取单菌落至培养液B中,透光度98%,接入GenⅢ微孔板于33 ℃培养37 h,使用BIOLOG MicroStation仪器进行读数,根据最终获得的表型指纹同BIOLOG数据库中的数据进行比较,以判断菌株对碳源的利用嗜好性和对化学物质的敏感程度。
1.2.2 酶活测定 取发酵液10000 r/min离心5 min,取0.5 mL上清,与0.5 mL 1%胶体几丁质混合,25 ℃下保温15 min,10000 r/min离心5 min,取上清200 μL煮沸5 min,冷却后,加入200 μL DNS溶液煮沸5 min,冷却后加入600 μL超纯水,10000 r/min离心10 min,取200 μL于96空板中测定OD520,设3个重复,取平均值,酶活单位定义(U):在上述条件下,催化产生l μmol N-乙酰-D-氨基葡萄糖所需的酶量[17]。
1.2.3 胶体几丁质的制备 根据王晓辉等[18]的方法进行1%胶体几丁质的制备:取10 g几丁质置于研钵,缓慢加入100 mL浓盐酸并不断搅拌1 h,保鲜膜封口后于冰箱4 ℃下过夜。大量超纯水反复洗至中性,离心后用0.1 moL/L磷酸缓冲液定容为1 L。
1.2.4 酶活曲线测定 挑取LG-1单菌落接种于5 mL种子培养基,20 ℃、160 r/min培养24 h。种子液以1%的接种量转接于100 mL粉状几丁质培养基,20 ℃、160 r/min培养,每隔24 h取样测定酶活性。三组平行实验。
1.2.5 菌株诱变育种
1.2.5.1 菌悬液制备 挑取单菌落接种于5 mL种子培养基,20 ℃、160 r/min培养24 h。种子液以1%的接种量转接于100 mL 2216E培养基,20 ℃、160 r/min培养,由实验室前期试验[17]可知菌株LG-1在该培养条件下,12~52 h为对数生长期,此阶段菌株生长情况良好,取36 h菌液4000 r/min离心10 min,沉淀用无菌海水稀释至菌体浓度为105cell/mL,作为菌株诱变育种的初始菌悬液。
1.2.5.2 紫外诱变 实验前将紫外灯功率调至20 W并打开预热20 min,吸取10 mL菌悬液至无菌培养皿中,并将培养皿置于100 r/min磁力搅拌器上使用无菌转子缓慢搅拌。将紫外灯置于无菌培养皿上方30 cm处照射,每隔1 min取100 μL菌悬液均匀涂布至筛选培养基上,20 ℃培养3 d[19-20]。以未照射的菌悬液作为对照组,统计诱变前后的菌落数量,计算致死率,选择致死率80%~90%的平板挑取透明圈较大的菌株接种于5 mL种子培养基,20 ℃、160 r/min培养24 h。种子液以1%的接种量转接于100 mL粉状几丁质培养基,20 ℃、160 r/min培养96 h,测酶活并计算酶活提高率。致死率及酶活提高率计算公式如下:
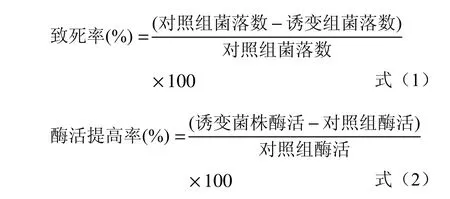
1.2.5.3 化学诱变 在3.5 mL菌悬液中加入1 mL的硫酸二乙酯和0.5mL的无水乙醇,混合均匀后每隔5 min加入0.5 mL 25%硫代硫酸钠溶液终止反应,对照组加入等量无菌水处理。取100 μL菌悬液均匀涂布至筛选培养基上,20 ℃培养3 d,统计菌落数量[20],按照式(1)计算致死率,选择致死率80%~90%的平板,挑取透明圈较大的菌株接种于5 mL种子培养基,20 ℃、160 r/min培养24 h。种子液以1%的接种量转接于100 mL粉状几丁质培养基,20 ℃、160 r/min培养96 h,测酶活并按照式(2)计算酶活提高率。
1.2.5.4 复合诱变 以方法1.2.5.2中紫外诱变所得产低温几丁质酶活最高的菌株作为出发菌株,按照方法1.2.5.1制备菌悬液,菌体浓度为105cell/mL;按照方法1.2.5.3进行化学诱变,计算致死率并选择致死率80%~90%的平板,挑取透明圈较大的菌株发酵测酶活。
1.2.5.5 遗传稳定性测定 分别选择紫外诱变、化学诱变和复合诱变后酶活最高的菌株进行连续传代培养,测其酶活,确定诱变菌株的遗传稳定性。
1.2.6 低温几丁质酶的酶学性质研究 菌株LG-1在粉状几丁质培养基中20 ℃、160 r/min培养96 h,10000 r/min离心5min,取上清液进行酶学性质研究。
1.2.6.1 最适温度和温度稳定性 为研究温度对几丁质酶活的影响,在0~65 °C温度下反应后测酶活。以酶活最大值为100%,根据酶在不同温度下相对活性绘制曲线,确定酶的最适反应温度。同时,将粗酶液分别置于0~65 °C下保温1 h,然后在最适反应pH和最适反应温度下检测残余酶活,与未经过处理的酶液进行比较,绘制相对活性曲线。
1.2.6.2 最适pH和pH稳定性 在最适反应温度,pH3~12的50 mmol/L缓冲液(pH3.0~5.0 phosphatecitrate、pH6.0~10.0 Tris-HCl、pH11.0~12.0 Na2HPO4-NaOH)中测定酶活,以酶活最大值为100%,根据酶在不同pH下的相对活性绘制曲线,确定酶的最适反应pH。同时,将粗酶液分别置于50 mmol/L不同pH缓冲液(pH3.0~5.0 phosphate-citrate、pH6.0~10.0 Tris-HCl、pH11.0~12.0 Na2HPO4-NaOH)中,20 °C下保温1 h,然后在最适反应pH和最适反应温度下检测残余酶活,与未经过处理的酶液进行比较,绘制相对活性曲线。
1.2.6.3 不同浓度金属离子及化学试剂对酶活的影响 在酶活测定反应体系中分别加入终浓度为1 或5 mmol/L的Ni2+、Mn2+、Ag+、Fe3+、Ca2+、K+、Mg2+、Cu2+、Fe2+、Na+、Zn2+等金属离子或β-mercaptoethanol(β-巯基乙醇)、尿素(Urea)、EDTA、Triton-100、Tween-80、2,3-butanedione(2,3-丁二酮)、保险粉、SDS、DTT等化学试剂。对照组加入相应体积的无菌水,测定酶活,计算相对活性。
1.2.7 抑菌性试验 参照Han等[21]和Mehmoo等[22]的方法,通过研究抑制孢子萌发实验测定LG-1抑菌活性。具体方法如下:将长有毛霉、青霉、根霉、黑曲霉、玉米腐烂病、稻瘟病、棉花枯萎病的马铃薯葡萄糖琼脂培养基挑碎,用镊子(灭菌)夹一块至盛有1 mL无菌水的离心管中,剧烈震荡2 min,制成孢子悬液。吸取100 μL孢子悬液涂布在固体发酵培养基上,然后用灭菌的玻璃棒蘸取LG-1菌体分别点接在培养基中央,20 ℃恒温倒置培养5~7 d,观察生长情况。
1.3 数据处理
所有实验均为三组平行。使用GraphPad Prism 8.0.1软件对诱变育种数据进行处理。
2 结果与分析
2.1 菌株LG-1的BIOLOG生理生化实验
传统菌株的生理生化实验方法主要是依靠人操作进行的,该方法存在操作复杂、耗时长等问题。BIOLOG全自动微生物鉴定仪可检测菌株对碳源的利用嗜好性和对化学物质的敏感程度,操作简单且迅速高效。化学物质敏感性试验结果表明该菌适合在高盐环境中生长,可能是因为菌株来源于海洋;微弱耐受醋竹桃霉素和万古霉素,对低pH、D-丝氨酸、二甲胺四环素、林肯霉素、萘啶酮酸、氨曲南、及丁酸钠不耐受。GenⅢ微孔板对该菌进行碳源的利用程度试验阳性结果如下表1。可见该菌对糊精、D-麦芽糖、D-海藻糖、蔗糖、β-甲酰-D-葡糖苷、N-乙酰-D-葡糖胺、D-果糖、肌苷、D-甘露糖、甘油、明胶、氨基乙酰-L-脯氨酸、L-丙氨酸、L-精氨酸、L-天冬氨酸、L-谷氨酸、L-组氨酸、L-丝氨酸、D-葡糖酸、柠檬酸、L-苹果酸、吐温40、β-羟基-D,L丁酸、丙酸和乙酸利用良好,对α-D-葡萄糖、D-山梨醇、D-阿拉伯醇、果胶、葡糖醛酰胺、丙酮酸甲酯、溴-丁二酸、α-酮-丁酸及乙酰乙酸利用较佳,对其余的碳源利用不佳。由此可知该菌株可广泛利用部分单糖、羧酸和脂肪酸,以及大部分氨基酸碳源。
2.2 菌株LG-1酶活曲线
自然界中几丁质含量十分丰富,大多以晶体结构存在,相比于胶体几丁质,粉状晶体几丁质因其结构特性更不易被降解[23-25]。如图1所示,在该培养条件下,菌株LG-1在24~96 h内酶活急剧升高,96 h时酶活达到最大值为1.134 U/mL,比实验室前期用胶体几丁质培养基测的最大酶活0.932 U/mL高20%以上[17]。96 h后,随着培养时间增加,酶活逐步下降,但在240 h时,酶活仍为最大酶活的50%以上,360 h时,酶活仍为最大酶活的25%以上,说明菌株LG-1在该培养条件下可较长时间持续作用。确定菌株LG-1在该条件下的最适培养时间为96 h。
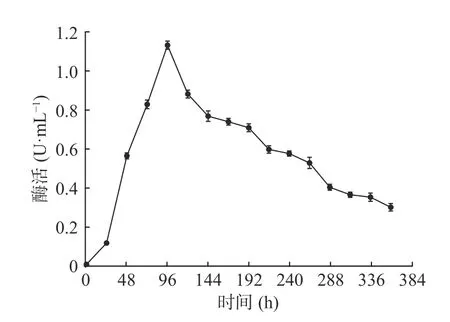
图1 产几丁质酶菌株LG-1酶活曲线Fig.1 Chitinase-producing LG-1 enzyme production
2.3 菌株诱变育种
2.3.1 紫外诱变 对菌株LG-1进行紫外诱变,致死率结果如图2所示。随着紫外灯照射时间的延长,菌株致死率不断增加,照射14 min时,菌株致死率已高于60%,照射20 min后菌株致死率超过80%,照射22 min时致死率为85.19%。通常情况下致死率在80%~90%时正突变率较高[20],因此选择紫外照射22 min时平板上7株透明圈较大的单菌落进行发酵培养,测定几丁质酶活性。
由表2可知,7株紫外诱变后的菌株中,有4株菌酶活明显提高,其中菌株LG-1-U-4酶活最高,为1.899 U/mL,与原始菌株LG-1相比,酶活提高率高达69.22%;诱变后有两株菌酶活降低,其中菌株LG-1-U-6酶活降低最多,比原始菌株降低了30.57%。
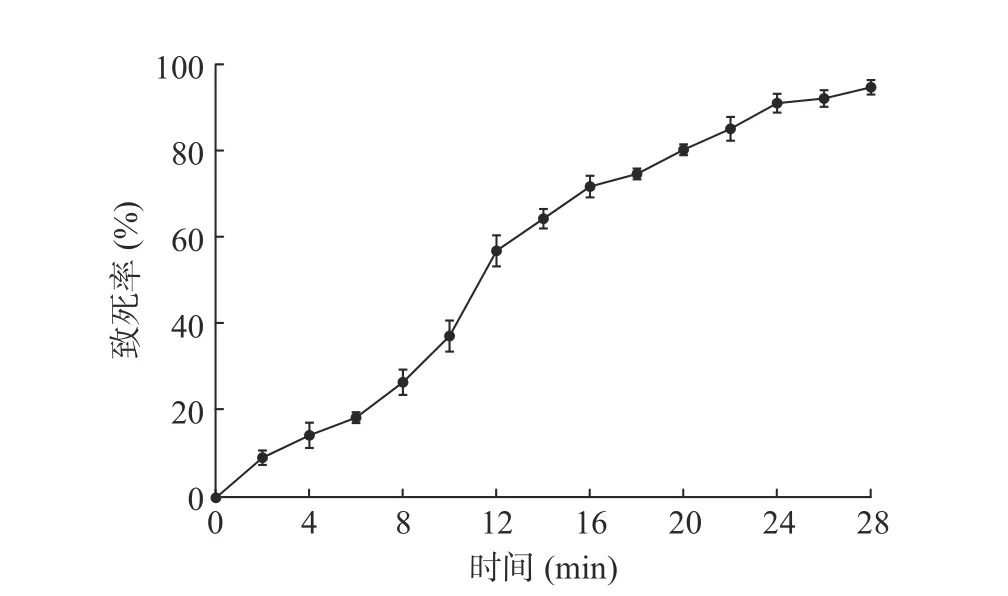
图2 菌株LG-1紫外诱变致死率Fig.2 Lethality rate of LG-1 induced by ultraviolet radiation
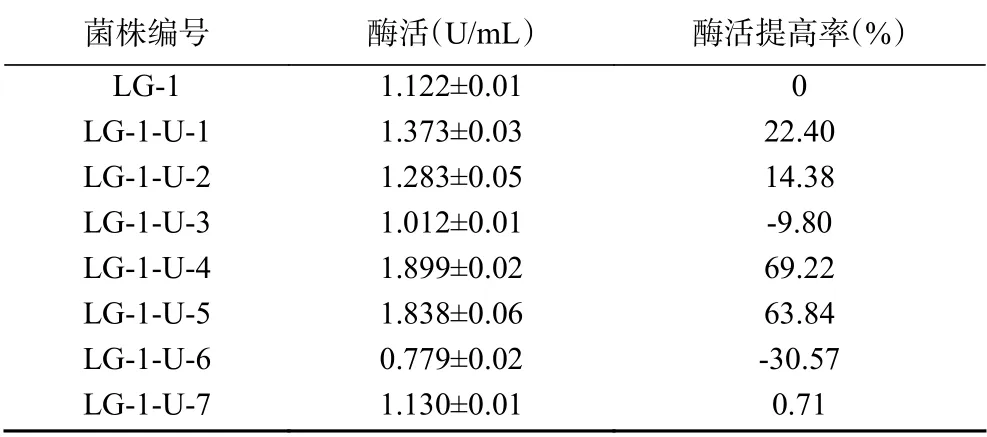
表2 紫外诱变菌株产几丁质酶活性Table 2 Chitinase activity of strain after UV mutagenesis
2.3.2 化学诱变 菌株LG-1经化学诱变后,致死率如图3所示。随着化学试剂对菌株作用时间的延长,菌株致死率不断增加,作用超过15 min后,菌株致死率急剧升高。诱变30 min后菌株致死率超过80%,诱变35 min时,致死率为86%。因此选择诱变35 min时平板上6株透明圈较大的单菌落进行发酵培养,测定几丁质酶活性。
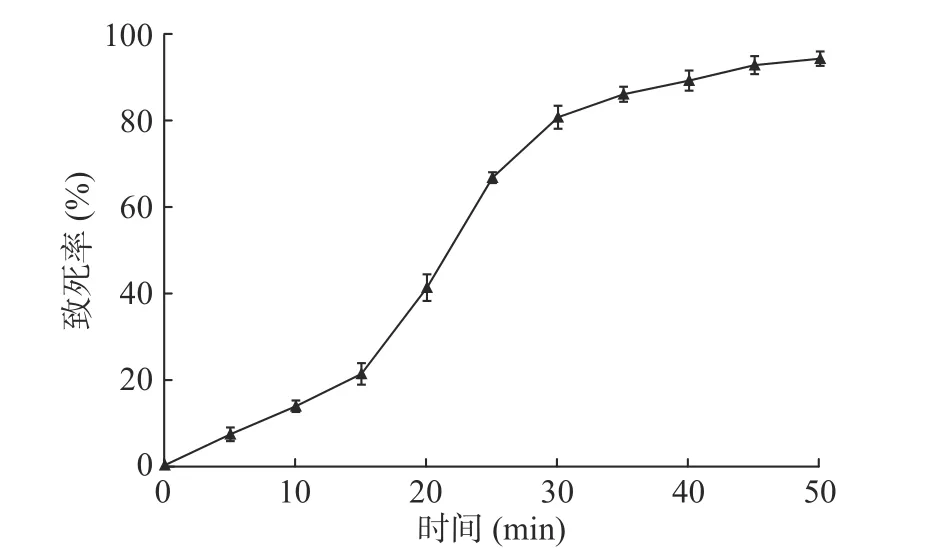
图3 菌株LG-1化学诱变致死率Fig.3 Lethality rate of LG-1 induced by chemical mutagenesis
由表3可知,6株化学诱变后的菌株中,有5株菌酶活得到提高,与原始菌株LG-1相比,其中有4株菌酶活提高率超过20%。菌株LG-1-H-1酶活最高,为1.848 U/mL,酶活提高率高达64.74%;与紫外诱变相比,酶活提高率略有降低。
2.3.3 复合诱变 菌株LG-1-U-4比菌株LG-1-H-1酶活更高,因此对菌株LG-1-U-4进行化学诱变,完成菌株LG-1的复合诱变过程。按照式(1)计算致死率,结果如图4所示。与菌株LG-1化学诱变致死率曲线相比,菌株LG-1-U-4在进行化学诱变时致死率更高、更快,诱变25 min时,致死率为84.34%,当诱变时间超过35min后,菌株致死率为100%。所以菌株LG-1-U-4进行化学诱变时,不能选择菌株LG-1化学诱变最佳时间35 min,而应该为25 min。挑取透明圈较大的7株菌进行发酵培养,测酶活并按照式(2)计算酶活提高率。

表3 化学诱变菌株产GOD酶活Table 3 GOD activity of strain after chemical mutagenesis
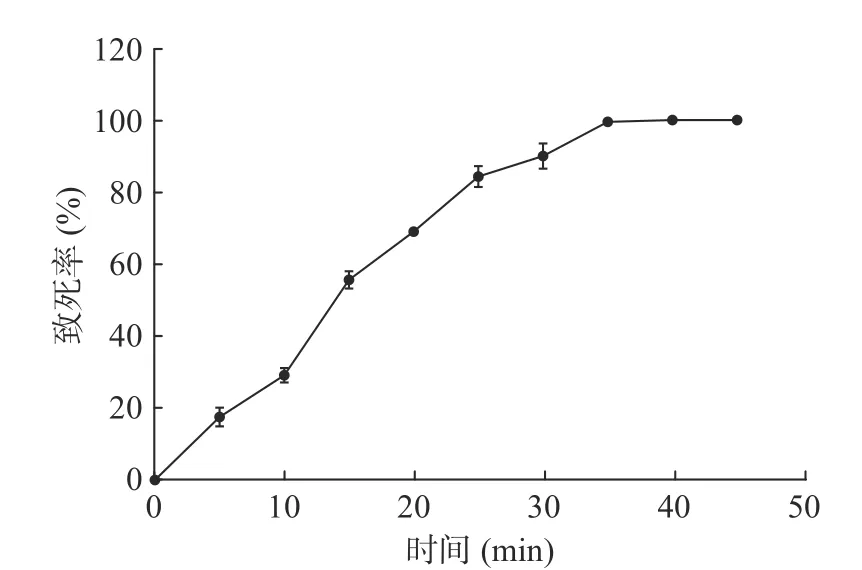
图4 菌株LG-1-U-4复合诱变致死率Fig.4 Lethality rate of LG-1-U-4 induced by composite mutagenesis
由表4可知,菌株LG-1-U-4经化学诱变后,7株菌中有4株菌酶活降低,有3株菌酶活升高,其中菌株LG-1-F-4酶活最高,达2.690 U/mL。与菌株LG-1-U-4相比,菌株LG-1-F-4酶活提高率为41.65%,与原始菌株LG-1相比,酶活提高率高达139.78%。
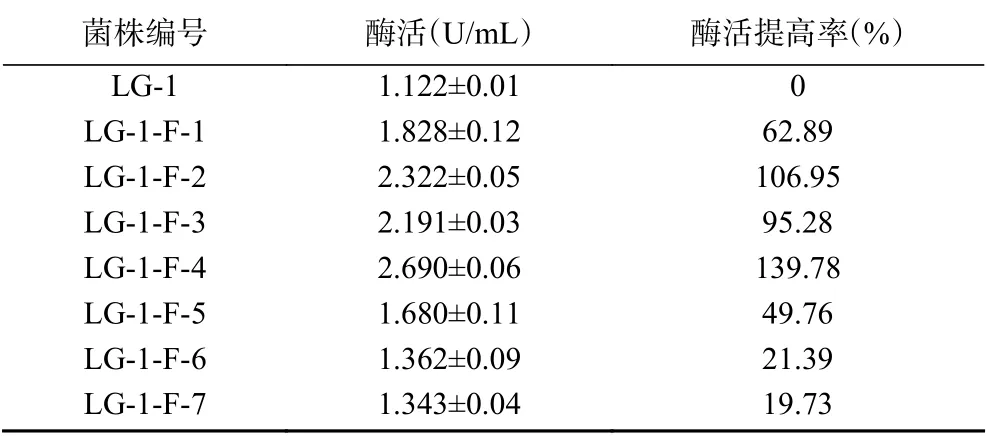
表4 复合诱变菌株产GOD酶活Table 4 GOD activity of strain after composite mutagenesis
2.3.4 诱变菌株产酶遗传稳定性实验 为获得产酶稳定的诱变菌株,对其进行连续10次传代培养,确定其产酶遗传稳定性,结果如图5所示。紫外诱变菌株LG-1-U-4遗传稳定性较差,在连续传代4次后,酶活逐渐降低。化学诱变菌株LG-1-H-1和复合诱变菌株LG-1-F-4遗传稳定性良好,在10次连续传代过程中,酶活虽稍有波动,但均分别维持在1.848 和2.690 U/mL左右。
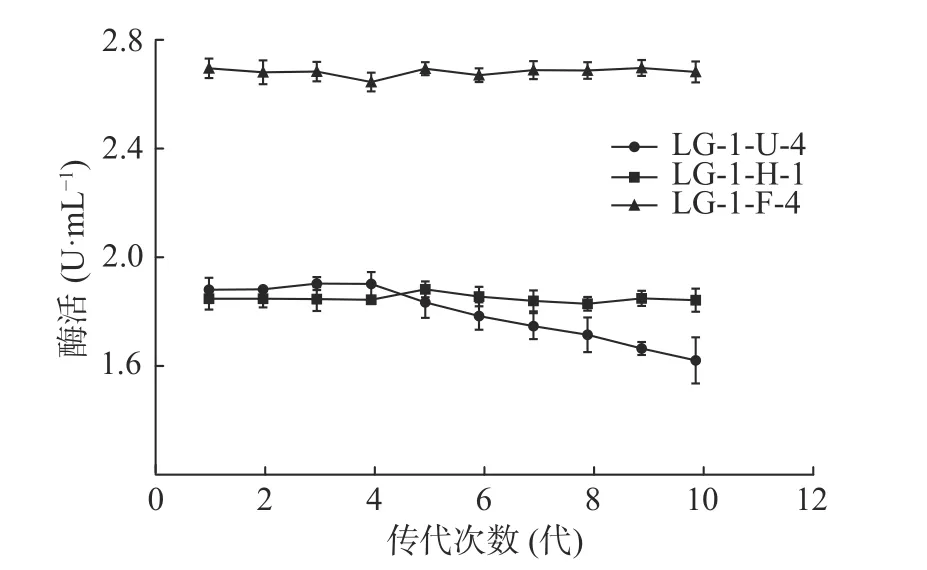
图5 菌株遗传稳定性Fig.5 Genetic stability of strains
2.4 低温几丁质酶的酶学性质分析
2.4.1 最适温度和温度稳定性
2.4.1.1 最适反应温度分析 由图6最适温度曲线可知,该酶在25~40 °C温度内有较高酶活,达到80%以上,最适反应温度为35°C;温度低于或高于35℃,酶活都降低,但相对于升高温度来说,降低温度时,酶活降低的速度更慢。10°C时,酶活为最适温度下酶活的30%以上,且在0°C时仍有酶活。在40~65°C温度内,随着温度的升高酶活力快速降低,50 °C时酶活力不足最适温度下酶活的40%。
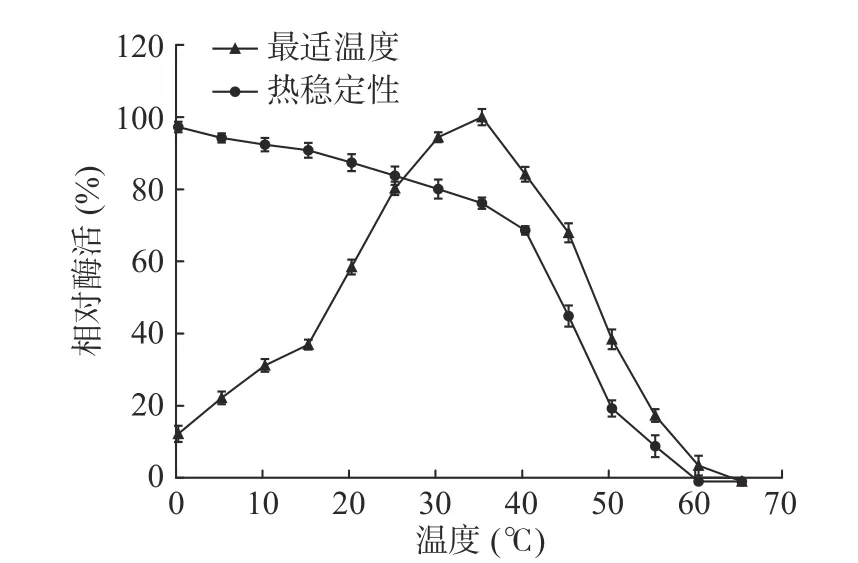
图6 几丁质酶的最适温度和温度稳定性Fig.6 Optimum temperature and thermal stability of the chitinase
2.4.1.2 热稳定性分析 由图6热稳定性曲线可知,该酶在低于30 °C的环境下具有较好的热稳定性,保温1 h处理后,酶活保留80%以上;在30 °C的环境下温育1 h后,酶活仍保留65%以上。当温度高于40 °C时,酶的热稳定性急剧下降,50 °C温育后,酶活仅剩余20%左右。
2.4.2 最适pH和pH稳定性
2.4.2.1 最适反应pH分析 由图7最适pH曲线可知,该几丁质酶在pH 7.0~8.0环境下酶活性较高,达到85%以上,pH为8.0时,酶活性最高;当pH小于7.0或大于8.0时,酶活急剧下降,但pH为9.0时,酶活仍为最大值的75%以上;pH为6.0时,酶活骤降至40%左右,pH为3.0~5.0时酶活低于40%;所以该几丁质酶在弱碱性环境中能更好的发挥作用。
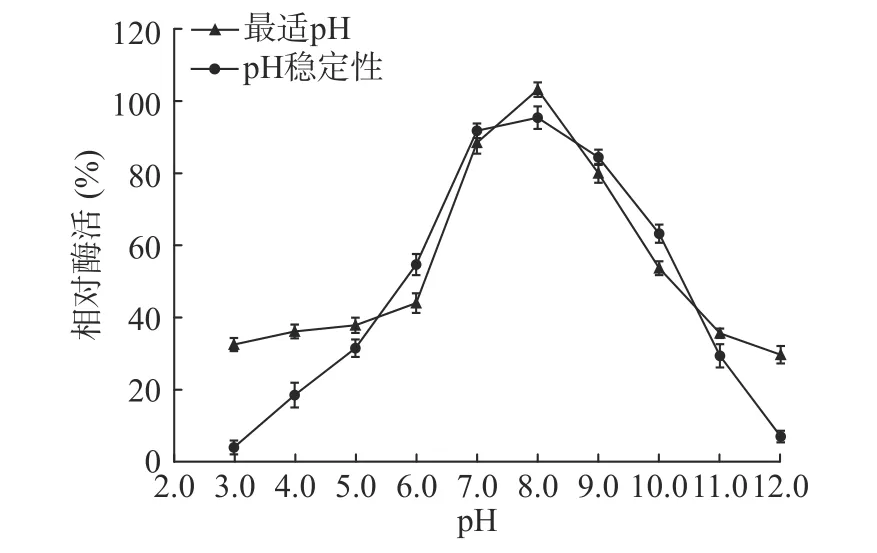
图7 几丁质酶的最适pH和pH稳定性Fig.7 Optimum pH and pH stability of the chitinase
2.4.2.2 pH稳定性分析 由图7 pH稳定性曲线可知,该几丁质酶在pH 7.0~9.0间较为稳定,剩余酶活力在80%以上,当pH为10.0时,相对酶活力剩余60%以上,pH为6.0时,相对酶活力剩余50%左右。当pH小于5.0或大于11.0时,残余酶活均小于35%,所以该酶适合保存在偏弱碱性的环境中。
2.4.3 不同浓度金属离子及化学试剂对酶活的影响
如表5所示,Ca2+、K+、Mg2+、Cu2+、Na+均对几丁质酶活性有促进作用,Ca2+、K+、Mg2+和Na+在海洋中含量丰富,研究表明其对海洋低温酶活性有显著促进作用[18-19]。且Ca2+、K+、Na+浓度越高促进作用越明显,浓度为5 mmol/L的Ca2+提高了将近60%的酶活性。而 5mmol/L的Mg2+和Cu2+对酶活的促进作用没有浓度为1 mmol/L效果好,但浓度1 mmol/L的Cu2+提高了85%的酶活性。Ni2+、Mn2+、Ag+、Fe3+、Zn2+均对几丁质酶活性有不同程度的抑制作用,其中5 mmol/L的Fe3+和Zn2+抑制效果最明显。由表5中不同浓度化学试剂对酶活的影响实验结果可 知,不 同 浓 度 的β-mercaptoethanol、EDTA、Triton-100、Tween-80、2,3-butanedione、SDS和DTT对几丁质酶活性均有抑制作用,其中5 mmol/L的SDS几乎使酶失活。高浓度的保险粉对酶活性抑制效果明显,Urea对酶活性几乎没有影响。
2.5 LG-1抑菌性的定性研究
由图8可知,菌株LG-1在涂有霉菌的培养基上生长7 d后,在根霉、黑曲霉、毛霉和玉米腐烂病的平板上产生明显的抑菌圈,说明菌株LG-1对根霉、黑曲霉、毛霉和玉米腐烂病的生长有抑制效果。
3 结论与讨论
目前,几丁质酶研究报道中多为中高温几丁质酶,最适反应温度在40~50 ℃,在高温下易失活,低温下活性很低或无酶活[26-27]。本研究对实验室前期筛选到的产低温几丁质酶菌株Photobacteriumsp.LG-1进行了BIOLOG生理生化实验,确定该菌株可广泛利用部分单糖、羧酸和脂肪酸,以及大部分氨基酸等碳源。化学物质敏感性试验结果表明该菌适合在高盐环境中生长,对低pH不耐受。
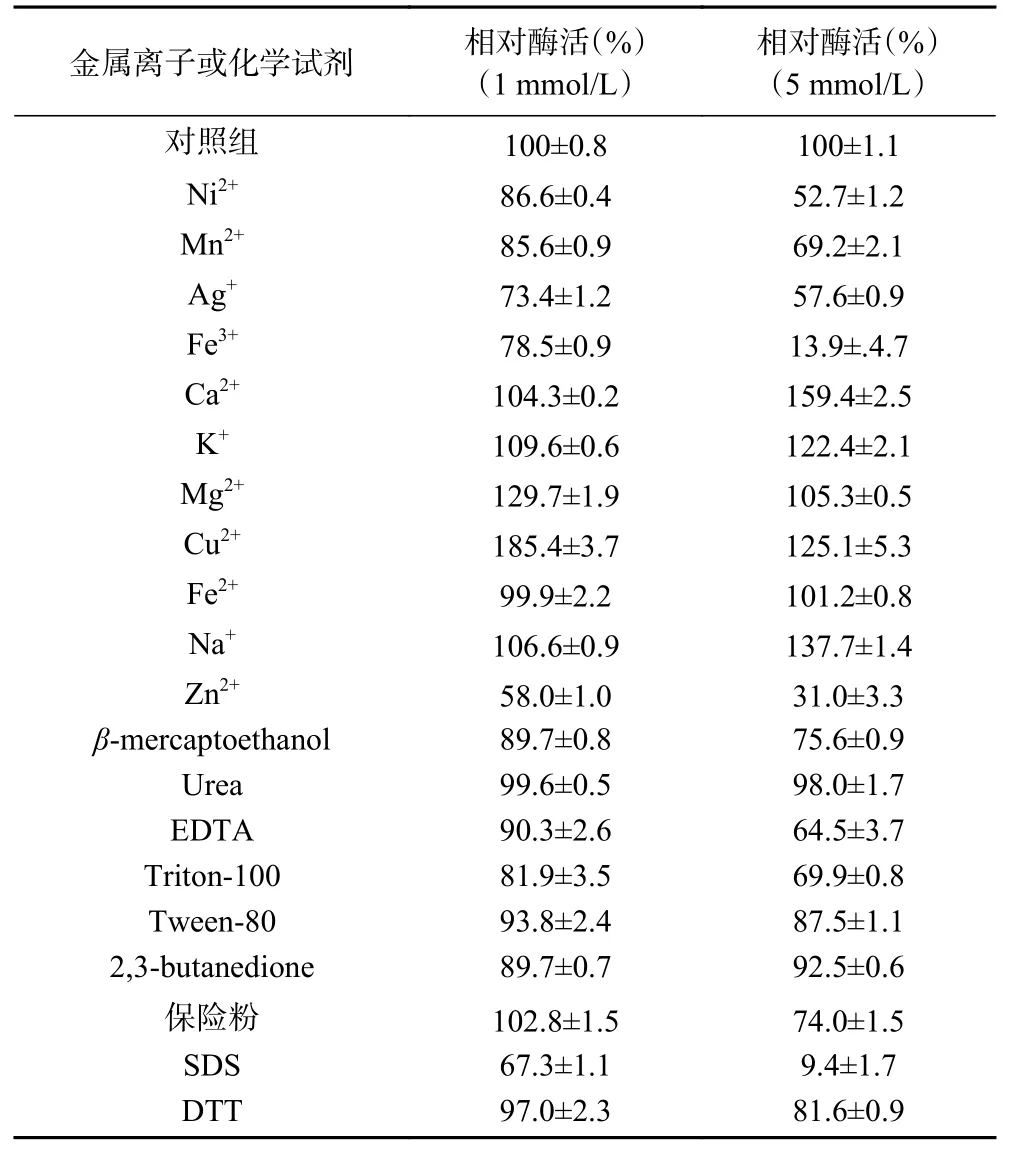
表5 金属离子及化学试剂对酶活的影响Table 5 Effects of metal ions and reagent on enzyme activity
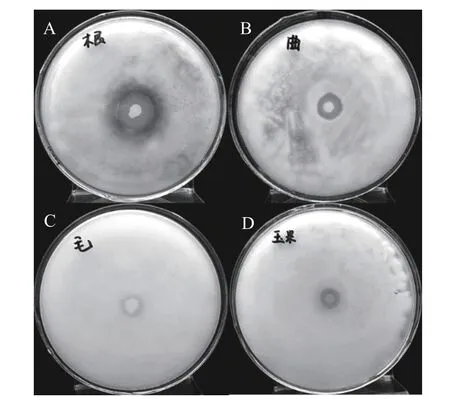
图8 菌株LG-1抑菌能力测定Fig.8 Antifungal activity of LG-1
为提高菌株LG-1产酶活性,对其进行了诱变育种,其中复合诱变效果最好,诱变后菌株LG-1-F-4酶活达2.690 U/mL,酶活提高率为139.78%,且菌株产酶遗传稳定性良好。紫外诱变比化学诱变酶活提高率略高,但菌株产酶遗传稳定性差,在传代培养过程中,酶活降低。酶学性质研究结果表明,该几丁质酶最适反应温度为35 ℃,0 ℃仍具有催化活性,符合低温酶特性;最适反应pH为8.0,在偏碱性环境中有较好的稳定性。金属离子Ca2+、K+、Mg2+、Cu2+、Na+均对几丁质酶活性有促进作用。抑菌性试验证明该菌对根霉、曲霉、毛霉和玉米腐烂病等有抑制活性。本研究可以为今后几丁质酶在农业生产上实现生物防治及工业应用等提供参考。
