毒死蜱降解菌株的分离鉴定及降解条件优化
2021-06-18孙建波张洪宇龚忠阔刘芝言王红蕾
孙建波,张洪宇,龚忠阔,张 超,刘芝言,王红蕾
(长春工业大学化学与生命科学学院,吉林长春 130012)
目前食用农产品中农药残留污染极为严重,Barron等[1]分析了塔吉克斯坦四个农村生食样品中农药残留,在肉类、乳制品和食用植物中检出农药高残留。2013年对波兰谷物中农药残留的检测发现,波兰北区谷物中农药残留普遍存在[2]。Guo等[3]从浙江省的竹笋中检测出三种类型的有机氯农药双对氯苯基三氯乙烷(DDT)、六氯环己烷(HCH)和五氯硝基苯(PCNB)。Houbraken等[4]研究表明,农药的使用不仅导致农作物中农药积累,在植物表面未被利用的农药同时可在昆虫体内积累,人类食用此类昆虫同样会对健康造成危害。
毒死蜱是一种广谱有机磷类杀虫剂[5],作为高毒有机磷农药的替代品,具有高效低毒的特点,但是其缺点是在自然环境中半衰期较长[6]。目前,传统的处理毒死蜱污染的方法有物理化学法和生物降解法,物理化学法包括紫外光解[7]、化学氧化法[8]、多相光催化降解[9]及辐射降解[10],而生物降解是利用微生物及其复合菌群,通过自身代谢将毒死蜱作为能源降解成为无毒物质[11]。目前已经分离出来的毒死蜱降菌株包括肠杆菌属[12]、产碱杆菌属[13]、副球菌属[14]、芽孢杆菌属[15、木霉属[16]及黑曲霉属[17]。研究表明,不同降解菌具有不同的生物活性和代谢活性,在不同程度上受到温度、pH、底物浓度、接种量等条件的影响[18-21],为了菌株能够应用到实际生活中,对菌株降解条件的优化必不可少。
本文运用富集驯化的方法分离可高效降解有机磷类农药毒死蜱的降解菌株,对菌株降解酶的定位,降解广谱性研究,运用正交试验对降解菌的降解条件进行优化,提高菌株的降解效率,有助于今后生物菌剂的制备,对农药污染环境修复及去除食用农作物表面有机磷农药残留方面极具应用潜力。
1 材料与方法
1.1 材料与仪器
土壤样品 取自长白山区周边农田土壤,土样放入4 ℃冰箱中保存备用;毒死蜱乳油(纯度50%)、敌敌畏乳油(纯度77.5%)、甲基对硫磷乳油(纯度50%)、氧化乐果乳油(纯度40%)、水胺硫磷乳油(纯度40%)、乙草胺乳油(纯度50%)、莠去津悬浮剂(纯度38%) 当地农药市场;毒死蜱标品纯度99.1%,上海市农药研究所有限公司;LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,固体培养基添加琼脂18~20;MSM培养基(g/L):NH4NO31.0,MgSO4·7H2O 0.5,(NH4)2SO40.5,KH2PO40.5,NaCl 0.5,K2HPO41.5。
IS-RSD3台式恒温振荡器 美国精骐有限公司;PHS-3C pH计 上海雷磁仪器厂;T960PCR仪
力康生物医疗科技控股有限公司;SPX-70BⅢ生化培养箱 天津市泰斯特仪器有限公司;DYY-6D型电泳仪 北京市六一仪器厂;BioDoc-It凝胶成像系统 UVP公司;BSC-1000ⅡA2生物安全柜 苏州安泰空气技术有限公司;
1.2 实验方法
1.2.1 毒死蜱降解菌的富集与分离 无菌条件下称取5 g土壤样品,放入含有50 mg/L毒死蜱的MSM培养基中,于37 ℃,180 r/min下,培养7 d,随后以5%的接种量转接到含有100 mg/L毒死蜱的MSM培养基中,逐步提高毒死蜱浓度分别为200、400、600、800 mg/L,取1 mL培养液,进行稀释平板涂布,选取单菌落进行划线分离纯培养。
1.2.2 毒死蜱降解菌株的鉴定 参照《常见细菌系统鉴定手册》对菌株AY-1进行菌落形态观察和生理生化实验。
利用试剂盒提取降解菌株基因组DNA,采用细菌16S rRNA基因通用引物27f和1492r对降解菌株的16S rRNA基因序列进行PCR扩增。PCR反应体系:10×PCR Buffer 5μL,dNTP Mixture 4 μL,引物各1 μL,模板2 μL,Taq DNA聚合酶0.3 μL,加灭菌水至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。PCR产物经检测后送至生工生物工程(上海)股份有限公司进行测序,将所得测序结果在NCBI上进行比对,下载同源序列,利用MEGA5.0构建菌株系统发育树。
1.2.3 细菌生长曲线的测定 将保存于试管斜面中的细菌接种于LB液体培养基中培养18 h,作为种子液。将种子液以1%的接种量,37 ℃,180 r/min培养,每隔2 h测定菌株OD600,以OD600为纵坐标,时间为横坐标绘制菌株的生长曲线
1.2.4 毒死蜱含量测定 挑取单菌落至LB液体培养基中,37 ℃,180 r/min,振荡培养18 h作为种子液,以MSM培养基为基础,37 ℃180 r/min恒温气浴摇床培养3 d,乳油加入水中后,会形成均一的溶液[22],为保证取出样品的均匀性,因此在培养结束后,取5 mL含毒死蜱的培养基,加入等体积的石油醚漩涡振荡1 min,静置分层,取上清液用于检测[23-24]。毒死蜱于λ=293 nm左右有特征吸收峰,通过紫外分光光度计测定样品的OD293,计算样品中毒死蜱的浓度,降解效率的计算公式为:
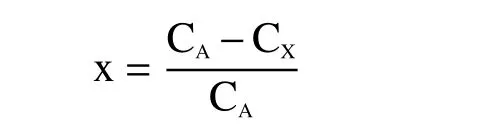
式中,x为毒死蜱降解效率;CA为对照样品中毒死蜱的浓度;CX为处理样品中毒死蜱的浓度。
1.2.5 毒死蜱标准曲线的测定 称取一定量的毒死蜱标准品,用石油醚作为溶剂配制成浓度为500 mg/L储备液,逐级稀释配制浓度为1.5625、3.125、6.25、12.5、25、50、100、200 mg/L的工作液,测定工作液在OD293下的吸光度值,制作标准曲线。在无机盐液体培养基及无机盐液体培养基接种2%种子液当中添加毒死蜱添加浓度为 5、50和100 mg/L三个浓度,每个浓度重复三次,同时做空白对照。测定毒死蜱在样品里的不同浓度添加回收率和变异系数。
1.2.6 菌株降解酶的定位 将180 r/min,37 ℃培养18 h的培养液以8000 r/min离心10 min,收集上清液,向上清液中加入适量(NH4)2SO4至饱和度为100%,4 ℃盐析过夜,离心收集沉淀,用pH7.0、浓度0.05 mol/L的磷酸缓冲液溶解沉淀后再用同一缓冲液透析至无NH4+,得到胞外粗酶液。
将上述离心收集的菌体,以1:3(菌体:缓冲液)的比例悬浮于缓冲液中,置于冰浴中,以超声波破碎仪破碎15次,将处理后的菌体以8000 r/min离心10 min,上清液即为胞内粗酶液,将上述两种粗酶液各取1 mL加入50 mL含有100 mg/L毒死蜱的MSM培养基中,37 ℃,180 r/min培养12 h,并设对照组,测定胞内粗酶液和胞外粗酶液对毒死蜱的降解情况,以确定毒死蜱降解酶的位置。
1.2.7 碳源和氮源对Pseudomonas aeruginosaAY-1培养条件的影响
1.2.7.1 碳源对Pseudomonas aeruginosaAY-1培养条件的影响 挑取单菌落至LB液体培养基中,在37 ℃,180 r/min条件下,振荡培养18 h作为种子液,以MSM培养基为基础,以浓度为0.5%的不同碳源(蔗糖、麦芽糖、葡萄糖、甘油、乙酸钠、甘露醇)培养18 h,测定OD600数值。
1.2.7.2 氮源对Pseudomonas aeruginosaAY-1培养条件的影响 挑取单菌落至LB液体培养基中,在37 ℃,180 r/min条件下,振荡培养18 h作为种子液,以MSM培养基为基础,以浓度为0.1%的不同氮源(硝酸钠、脲、硫酸铵、硝酸铵、硝酸镁)培养18 h,测定OD600数值。
1.2.8Pseudomonas aeruginosaAY-1降解条件的优化
1.2.8.1 温度对降解菌降解毒死蜱的影响 挑取单菌落至LB液体培养基中,37 ℃,180 r/min,振荡培养18 h作为种子液,以MSM培养基为基础,毒死蜱浓度为100mg/L,在温度值为25、30、35、40、45 ℃,以2%接种量接种于培养基中,以不加菌作为对照组,pH7、180 r/min恒温气浴摇床培养3 d,测定毒死蜱降解效率。
1.2.8.2 pH对降解菌降解毒死蜱的影响 挑取单菌落至LB液体培养基中,37 ℃,180 r/min,振荡培养18 h作为种子液,以MSM培养基为基础,毒死蜱浓度为100 mg/L,在pH为5、6、7、8、9,以2%接种量接种于培养基中,以不加菌作为对照组,35 ℃、180 r/min恒温气浴摇床培养3 d,测定毒死蜱降解效率。
1.2.8.3 毒死蜱浓度对降解菌降解毒死蜱的影响挑取单菌落至LB液体培养基中,37 ℃,180 r/min,振荡培养18 h作为种子液,以MSM培养基为基础,在毒死蜱浓度为50、100、150、200、250 mg/L,以2%接种量接种于培养基中,以不加菌作为对照组,35 ℃、pH7、180 r/min恒温气浴摇床培养3 d,测定毒死蜱降解效率。
1.2.8.4 正交试验设计 根据单因素实验结果,当温度在30~40 ℃,pH在6~8,底物浓度在100~200 mg/L范围时降解效果相对明显。因此选择30、35、40共3个温度水平,6、7、8共3个pH水平,100、150、200共3个底物浓度水平。采用L9(34)正交试验方案,表1为三因素三水平正交设计,
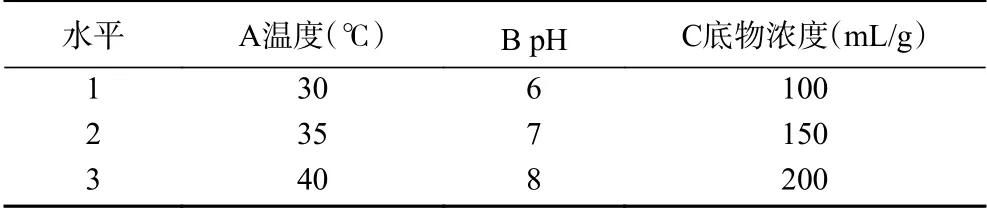
表1 降解条件优化正交试验设计Table 1 Optimization of orthogonal test design for degradation conditions
1.2.9 菌株降解底物广谱性研究 将菌株AY-1接种于含有500 mg/L敌敌畏、甲基对硫磷、氧化乐果、水胺硫磷、乙草胺和莠去津的MSM固体培养基中,37 ℃恒温培养7 d后观察菌落生长情况。
1.3 数据处理
每组试验重复三次,数据之间的显著性差异用Duncan检验。采用Excel软件进行数据统计及误差分析。使用SPSS进行显著性分析,使用Oringin9进行作图。
2 结果与分析
2.1 降解菌的分离鉴定
利用含有800 mg/L毒死蜱的MSM培养基筛选出1株毒死蜱降解菌,将其命名为AY-1。由图1可知,菌株AY-1在LB固体培养基,呈现湿润、粘稠、不易挑起、质地均匀。通过扫描电镜观察,菌株AY-1呈球杆状。
菌株AY-1通过16S rRNA序列PCR扩增和测序,并与Blast数据库进行相似度比较,同时调取菌株相似性最高模式菌株序列,利用NJ法构建系统进化发育树如图2所示,该菌株归属于铜绿假单胞菌(Pseudomonas aeruginosa)。
2.2 毒死蜱标准曲线
以毒死蜱浓度为横坐标,OD293为纵坐标,得标准曲线如图3所示,回归方程为y=59.208x-0.065,R²=0.9992,表明毒死蜱标品在0~100 mg/L浓度范围内线性良好。
在50 mL基础培养基中,毒死蜱的浓度分别设置为 5、50和100 mg/L分别吸取一定体积的培养液,用1.2.1的方法进行提取,每一浓度分别测定三次。由表2可见,不加菌的培养基3个浓度毒死蜱的平均添加回收率在95.84%~102.75%之间,变异系数在2.29%~3.47%之间。加菌的培养基3个浓度毒死蜱的平均添加回收率在95.80%~102.08%之间,变异系数在1.80%~2.27%之间。表明分析方法满足菌株降解农药残留分析的要求。
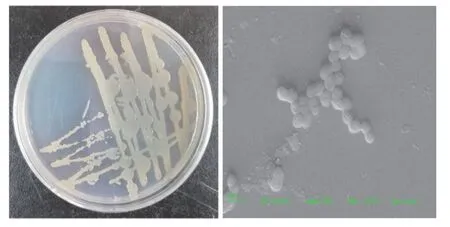
图1 菌株AY-1菌落和菌体形态Fig.1 Colony and morphology of strain AY-1
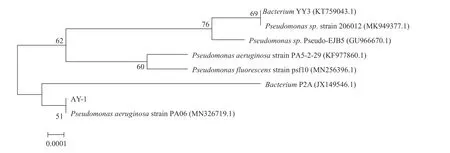
图2 菌株AY-1系统发育树Fig.2 Phylogenetic tree of strain AY-1
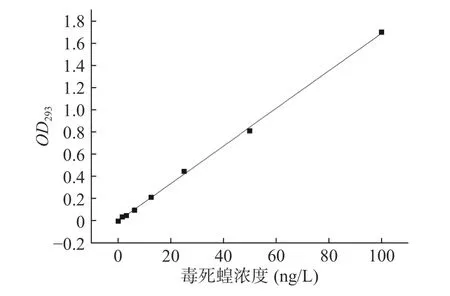
图3 毒死蜱标准曲线Fig.3 Chlorpyrifos standard curve
2.3 菌株Pseudomonas aeruginosa AY-1的生长曲线
图4 为菌株Pseudomonas aeruginosaAY-1的生长曲线,0~2 h时,菌株生长较为缓慢,处于生长缓慢期,2 h后,OD600数值迅速增加,菌株进入对数生长期,代谢活动更为活跃,26 h后生长速度下降,增长较为缓慢。菌株的生长曲线为后期微生物菌剂的制备提供条件。
2.4 降解菌毒死蜱降解酶的定位
分别测定了胞外粗酶液和胞内粗酶液对毒死蜱的降解效率,以此来确定毒死蜱降解酶的位置,以缓冲液为空白对照,实验结果如表3所示。由表3可知,胞内粗酶液对毒死蜱的降解效率远高于胞外粗酶液,胞外粗酶液对于毒死蜱微弱的降解效率可能是由于菌体释放部分降解物质,由此可知菌株AY-1产生的毒死蜱降解酶属于胞内酶。
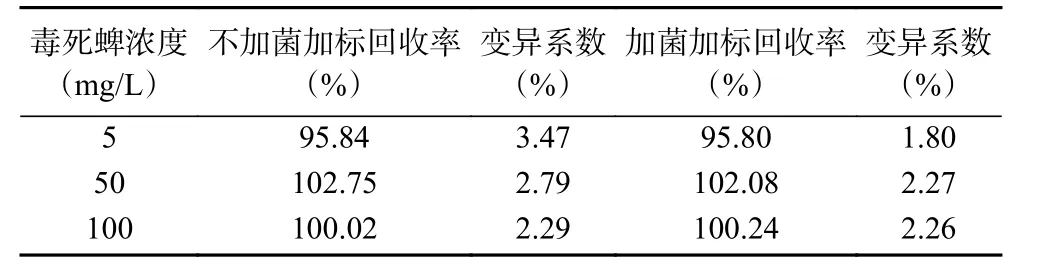
表2 毒死蜱在培养基中的加标回收率Table 2 Recovery rate of chlorpyrifos in the culture medium
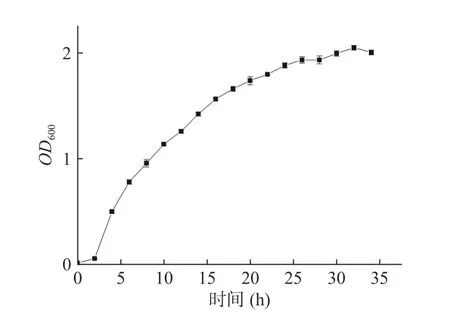
图4 菌株AY-1生长曲线Fig.4 Growth curve of strain AY-1

表3 细菌不同位置的降解酶对毒死蜱的降解效率Table 3 Degradation efficiency of chlorpyrifos by degrading enzymes at different positions of bacteria
2.5 碳源和氮源对菌株Pseudomonas aeruginosa AY-1培养条件的影响
2.5.1 碳源对菌株Pseudomonas aeruginosaAY-1生长的影响 如图5所示,不同碳源对菌株Pseudomonas aeruginosaAY-1的生长影响程度不同,葡萄糖为最适碳源,其次为甘油,对蔗糖和麦芽糖的利用率较低。推测可能是不同碳源之间转运及分解代谢方式的不同影响了菌株对碳源的利用,进而影响菌株生长[25]。
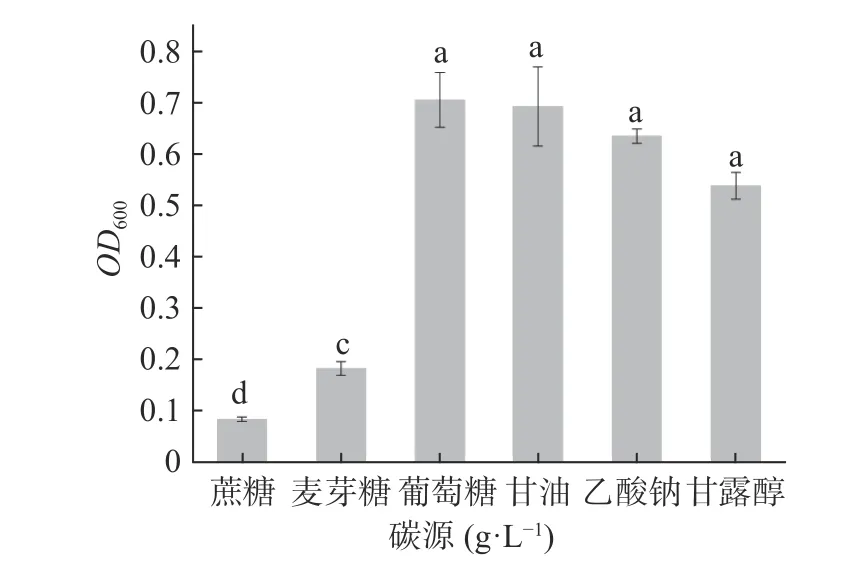
图5 不同碳源对菌株AY-1生长的影响Fig.5 Effects of different carbon sources on the growth of strain AY-1
2.5.2 氮源对菌株Pseudomonas aeruginosaAY-1生长的影响 如图6所示,不同氮源对菌株Pseudomonas aeruginosaAY-1的生长影响程度不同,硫酸铵为最适氮源,其次为脲素。可能原因是细菌利用不同氮源需要不同的酶,对酶的活性有一定要求,因此菌株在不同氮源的条件下生长效果不同[26]。
2.6 菌株Pseudomonas aeruginosa AY-1降解特性
2.6.1 温度对菌株Pseudomonas aeruginosaAY-1降解毒死蜱的影响 温度对AY-1降解毒死蜱的影响如图7所示,在不同的培养温度下,菌株AY-1对毒死蜱的降解效率先升高后降低。从毒死蜱随温度升高的降解曲线可以看出,该菌对毒死蜱降解的最适温度范围为30~35 ℃。其中,当温度为45 ℃时降解效率降到10%以下(P<0.05),说明低温和高温对菌株降解毒死蜱都不利。这可能是因为微生物的生长需要一定的环境温度条件。温度相对较低时,随着温度提升,微生物及其酶活性提高,降解效率也随之增大;超过微生物最适温度后,温度的升高会导致微生物活性下降,甚至死亡[27]。35 ℃时,菌株Pseudomonas aeruginosaAY-1对150 mg/L毒死蜱降解效率达到最大为68.3%。
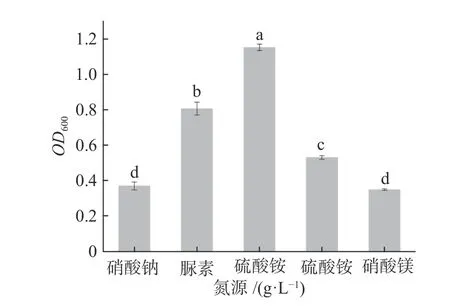
图6 不同氮源对菌株AY-1生长的影响Fig.6 Effects of different nitrogen sources on the growth of strain AY-1
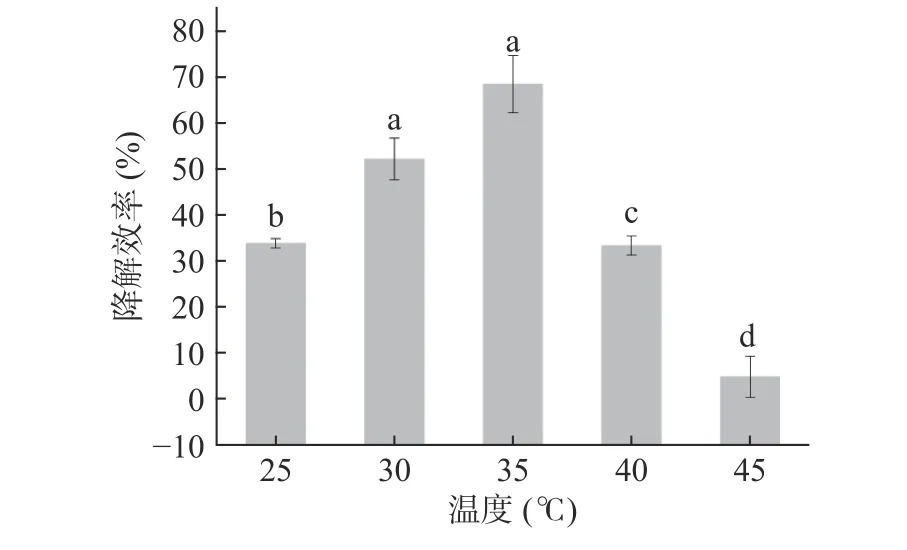
图7 温度对Pseudomonas aeruginosa AY-1降解毒死蜱的影响Fig.7 Effect of temperature on degradation of chlorpyrifos by Pseudomonas aeruginosa AY-1
2.6.2 pH对菌株Pseudomonas aeruginosaAY-1降解毒死蜱的影响 pH对Pseudomonas aeruginosaAY-1降解毒死蜱的影响如图8所示,初始pH在5~9范围内,AY-1对毒死蜱的降解效率先升高后降低,培养72 h后,pH=7时,菌株AY-1对150 mg/L毒死蜱降解效率达到最大为65%,当pH=9时,降解效率迅速降低。pH=7~8时,Pseudomonas aeruginosaAY-1对毒死蜱有较高的效率,两者无显著差异(P>0.05),可能原因为培养体系pH的不同,会改变营养物质的生物可利用性和污染物的形态及生物毒性,从而影响微生物的活性,最终导致微生物生长速率和污染物降解速率的变化[28]。
2.6.3 底物浓度对菌株Pseudomonas aeruginosaAY-1降解毒死蜱的影响 微生物对污染物的降解能力受到底物浓度的影响,特别是当底物浓度过高时,会抑制微生物降解酶的产生,从而影响微生物的降解能力,底物浓度过低时,由于营养物质不充足,导致降解效率较低[29]。底物浓度对Pseudomonas aeruginosaAY-1降解毒死蜱的影响如图9所示,随着底物浓度的增高降解效率随之增高,当底物浓度为150 mg/L时,降解效率达到最高为56.77%(P<0.05)。底物浓度超过150 mg/L时,降解效率随之降低,这说明底物浓度过高会抑制Pseudomonas aeruginosaAY-1对毒死蜱的降解。底物浓度低于150 mg/L时,随着底物浓度增加,降解效率随之增加。
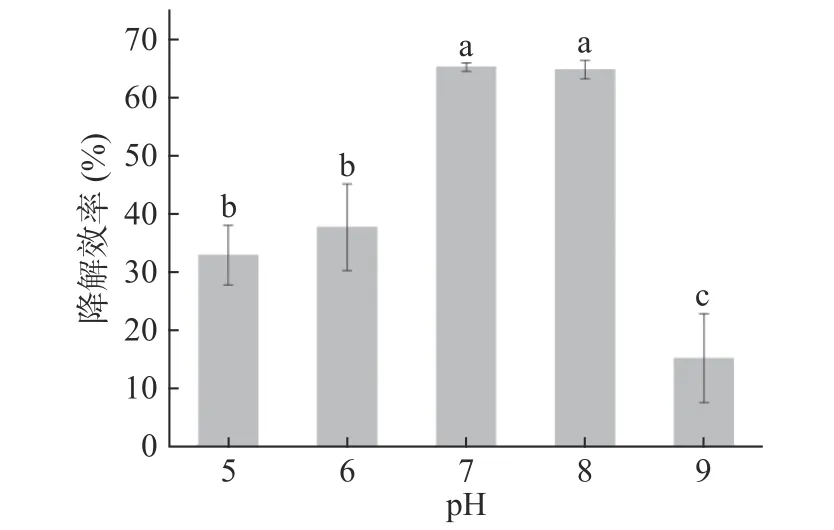
图8 pH对Pseudomonas aeruginosa AY-1降解毒死蜱的影响Fig.8 Effect of pH on degradation of chlorpyrifos by Pseudomonas aeruginosa AY-1
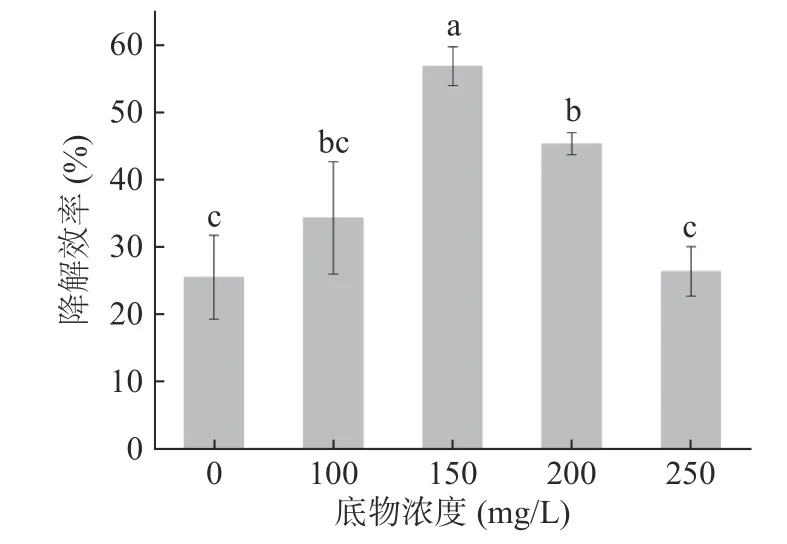
图9 底物浓度对Pseudomonas aeruginosa AY-1降解毒死蜱的影响Fig.9 Effect of Substrate concentration on degradation of chlorpyrifos by Pseudomonas aeruginosa AY-1
2.6.4 多因素正交试验 正交试验结果由表4可知,通过正交试验的极差R得出A、B、C 3因素对毒死蜱降解影响的大小顺序为:B>A>C。这说明在菌株AY-1降解毒死蜱的过程中,pH对降解效率的影响最大,其次是温度,底物浓度的影响最小,培养条件对毒死蜱降解的影响最优组合为A2B3C1,即培养温度为35 ℃,pH=8,底物浓度为100 mg/L时达到最佳降解状态,降解效率为75.09%。
菌株Pseudomonas aeruginosaAY-1经过3 d可将100 mg/L的毒死蜱降解75.09%,相对于Shi等[30]筛选的Ochrobactrumsp.经过7 d将100 mg/L毒死蜱降解75.18%,菌株Pseudomonas aeruginosaAY-1用时更短,因此具有更好的应用价值。本文从现有文献中得知,从环境中分离出了多种能够降解毒死蜱的微生物如表5。由下表可知,Pseudomonas aeruginosaAY-1是降解毒死蜱效率最高的。
2.7 菌株降解底物广谱性研究
菌株AY-1在500 mg/L的敌敌畏、氧化乐果、甲基对硫磷、水胺硫磷、乙草胺和莠去津固体平板上均能生长,如图10所示,说明菌株AY-1对农药具有一定广谱降解效果。敌敌畏、氧化乐果和水胺硫磷平板生长情况良好,而在甲基对硫磷、乙草胺和莠去津平板上生长较差,说明菌株AY-1对敌敌畏、氧化乐果和水胺硫磷降解潜力更大,对甲基对硫磷、乙草胺和莠去津降解潜力较低。
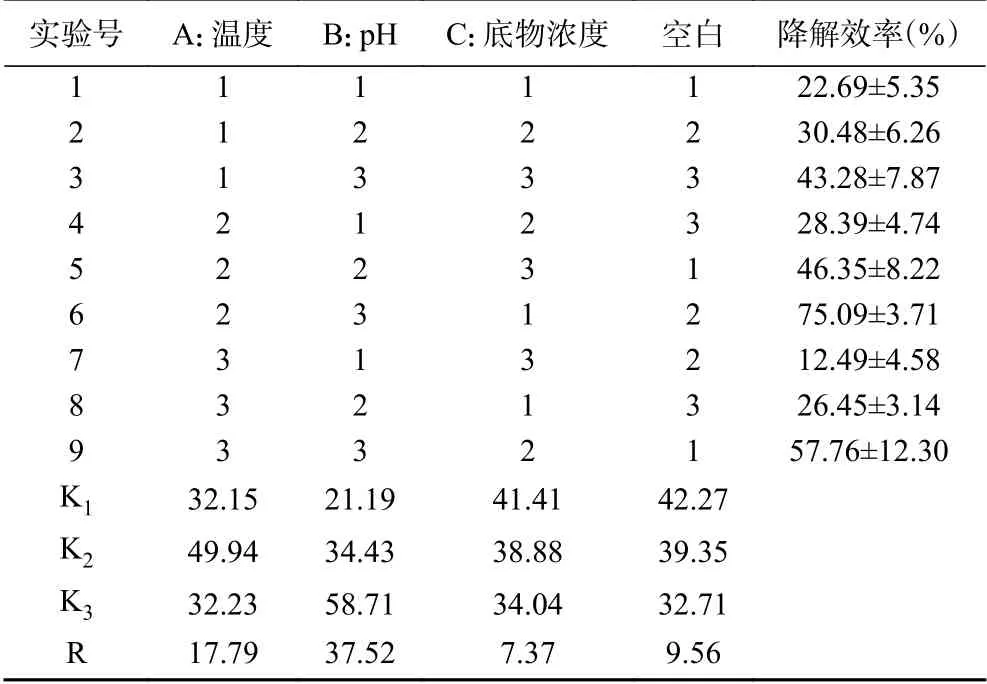
表4 降解条件优化正交试验结果Table 4 Degradation conditions optimization orthogonal test results
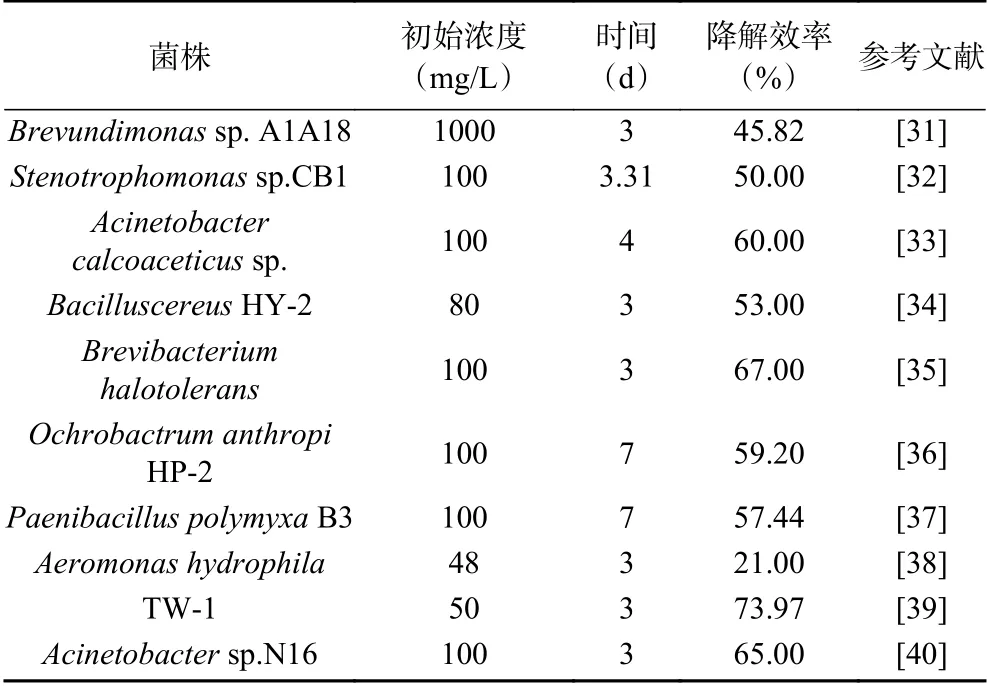
表5 其他毒死蜱降解微生物降解效率Table 5 Degradation efficiency of other chlorpyrifosdegrading microorganisms
3 结论
本研究从长白山区农田土中分离出一株降解毒死蜱菌株Pseudomonas aeruginosaAY-1,通过形态学观察,生理生化鉴定和16S rRNA测序,将其鉴定为铜绿假单胞菌。铜绿假单胞菌具有抗逆性强的特点,因此在生物修复污染环境方面具有应用价值。目前利用铜绿假单胞菌进行生物修复污染环境的报道有很多,如Lu等[41]从陕西延长油田下寺湾采油厂内石油污染土中筛选出一株铜绿假单胞菌,能够降解荧蒽,在14 d降解效率达到90.2%,对其降解酶进行检测,发现邻苯二酚1,2-双加氧酶在其生物降解过程中起主导作用;Song等[42]从经过长期拟除虫菊酯处理的土壤中分理出一株铜绿假单胞菌,能够高效降解甲氰菊酯。并对氯氰菊酯,溴氰菊酯,联苯菊酯和氯氟氰菊酯都有一定的降解能力,通过鉴定降解产物研究了菌株对甲氰菊酯的降解机理。Hoskeri等[43]从造纸厂废水中分离出一株铜绿假单胞菌,能够以2 g/L 4-氯苯甲酸为生长底物。
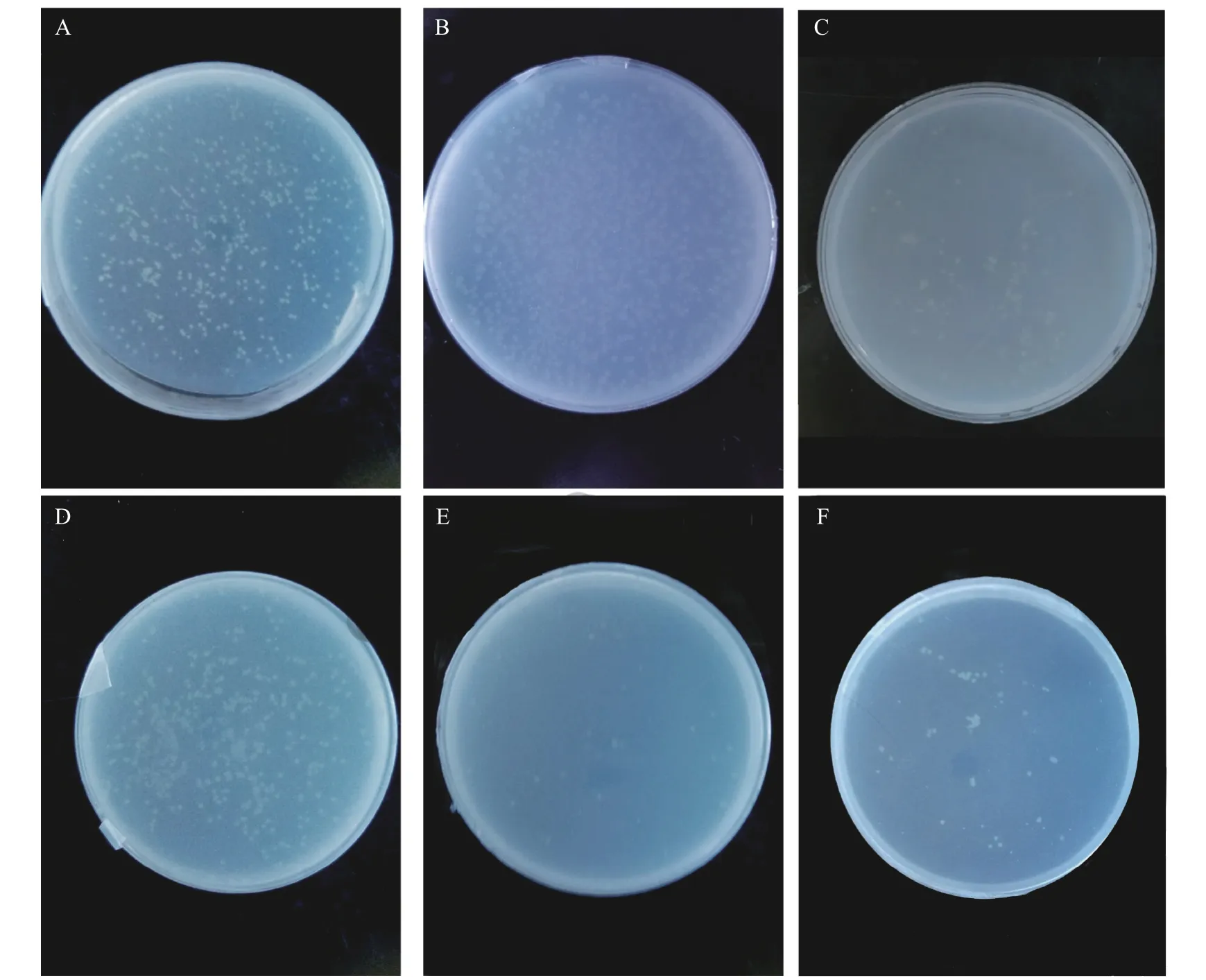
图10 菌株AY-1在不同农药平板的生长情况。Fig.10 Growth of strain AY-1 on different pesticide plates.
微生物降解技术是目前比较有前景的一种技术,微生物可以利用农药为能源,或者自身分泌特定的酶来降解农药及其分解产物。本文研究的降解菌Pseudomonas aeruginosaAY-1产生的降解酶为胞内酶,Pseudomonas aeruginosAY-1对敌敌畏、氧化乐果、甲基对硫磷、水胺硫磷、乙草胺和莠去津均具有一定的降解效果,建议未来将研究方向放在固定化方面,以获得更高效的毒死蜱降解菌株。
