不同灭菌方式人参粉的皂苷含量、指纹图谱分析及灭菌效果评价
2021-06-18白羽辛王玥玥贡济宇何文媛蔡广知
白羽辛,王玥玥,贡济宇,何文媛,李 妍,蔡广知
(长春中医药大学, 吉林长春130000)
人参的药用部位是根及根茎[1],具有抗氧化[2-3]、改善记忆力[4]、保护肝脏[5]、调节免疫功能[6-7]、抗肿瘤[8]、抗抑郁[9]等作用。2015版《中国药典》中对人参的用法用量有记载[1],临床应用中人参粉可辅助治疗病毒性心肌炎,提高心脏造血能力,提升机体免疫力[10],减轻早搏症状[11]。人参粉胶囊还用于治疗心绞痛[12],服用方便的粉类饮片是产业和消费者的共同诉求。因此人参粉的炮制关键技术及标准研究对建立科学全面的人参粉品质评价体系具有深远的意义。
由于口服饮片对微生物有严格的控制要求,为保证产品质量,人参粉灭菌环节至关重要。中药灭菌方式有多种,包括60Co辐照灭菌[13]、臭氧法[14]、微波干燥灭菌[15]、紫外灭菌[16]和湿热灭菌[17-18]等。近年来药品标准对中药微生物限度要求越来越严格,随着中药产业发展水平与中药质量标准的全面提升,如何因药制宜选择合适的灭菌方式显得极其重要[19]。目前国内外对三七超微粉[20]、天麻、川芎、制何首乌等生药粉[21]等均有研究。对于人参粉灭菌方式的相关研究报道较少,因此有必要对人参粉灭菌工艺进行考察。
本研究采用HPLC法建立14批不同灭菌方式人参粉样品指纹图谱[22],结合聚类分析法、偏最小二乘判别分析法(PLS-DA)[23]以及模型变量投影(VIP)参数有效区分不同灭菌方式的人参粉样品,通过比较不同灭菌方式对人参粉皂苷含量及微生物数量的影响,为选择和确定人参粉灭菌工艺以及人参粉质量控制提供参考。
1 材料与方法
1.1 材料与仪器
人 参 皂 苷Rf(98.0%)、Rb1(91.1%)、Rg2(93.8%)、Rb2(93.8%)、Rd(92.1%)、Re(97.4%)、Rg1(93.6%) 批号分别为111719-201505、110704-201726、111779-200801、11715-201203、111818-201603、110754-201626、110703-201731,中国食品药品检定研究院;人参皂苷Rb3(97.6%)、Rc(98.0%)、Ro(98.0%) 批号分别为68406-26-81、11021-14-0、P15A6F2403,上海源叶科技有限公司;甲醇、乙腈 色谱纯,赛默飞世尔科技有限公司;水 超纯水。
LC-2030型高效液相色谱仪 日本岛津公司;KQ3200DB超声清洗机 昆山市超声仪器有限公司;XFB-500型粉碎机 上海将来实验设备有限公司;AL204万分之一电子天平、AB135-S十万分之一电子天平 梅特勒-托利多仪器有限公司;GB 19258紫外杀菌灯 东莞市毅万光源有限公司;LS-35HJ湿热灭菌锅 上海精若科学仪器有限公司;臭氧灭菌器 大连博斯特科技有限公司。
1.2 实验方法
1.2.1 灭菌样品制备 辐照灭菌样品按不同剂量3、6、9 kGy制备,紫外灭菌样品在紫外灯下照射2 h,湿热灭菌样品在121 ℃下灭菌10 min,臭氧灭菌样品浓度为20 g/m³,灭菌时间为60 min,共14批人参粉样品,见表1。
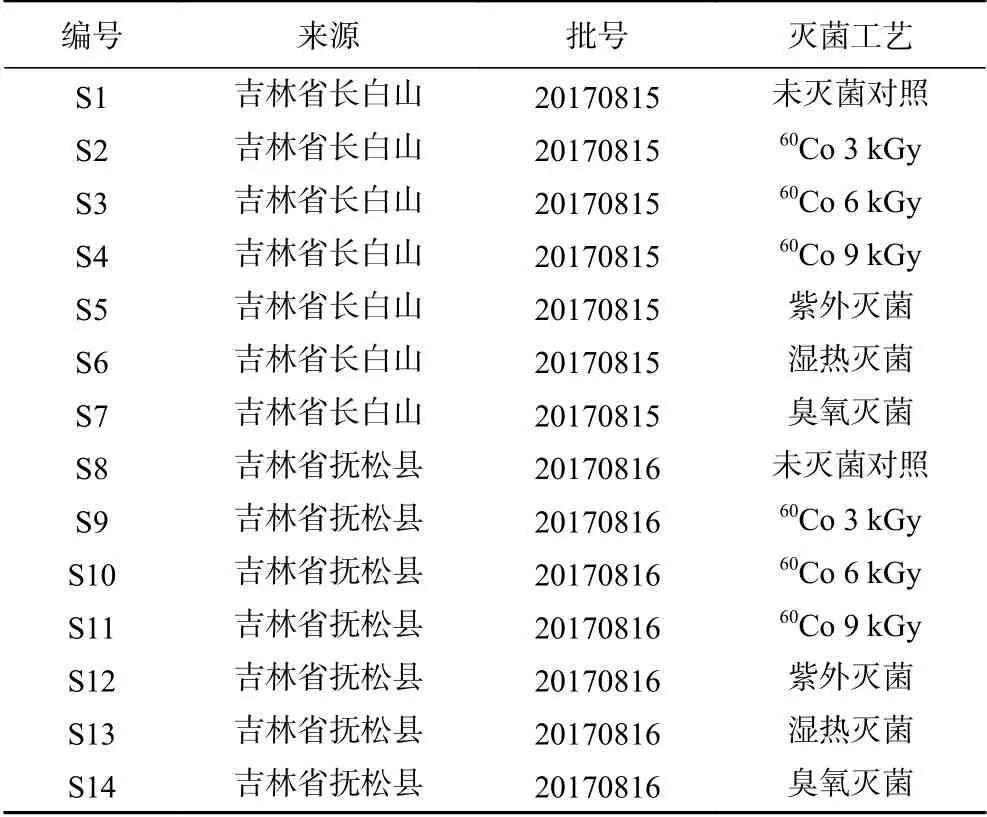
表1 样品信息Table 1 Sample information
1.2.2 色谱条件 Agilent EC-C18柱(4.6 mm×150 mm,2.7 μm);流动相乙腈(A)-0.1%磷酸水溶液(B);柱温40 ℃;流速1 mL/min;进样量10 μL;检测波长203 nm;梯度洗脱(0~23 min,18%~21% A;23~35 min,21%~28% A;35~80 min,28%~32% A)。
1.2.3 混合对照品溶液的制备 精密称量对照品,加甲醇制成含人参皂苷Rg1、Re、Rf、Rg2、Rb1、Ro、Rc、Rb2、Rb3、Rd质量浓度分别为0.81、0.78、0.41、0.21、0.82、0.80、0.81、0.79、0.18、0.34 mg/mL的混合对照品储备液,备用。
1.2.4 供试品溶液的制备 精密称定人参粉样品约1 g,加入20 mL 70%甲醇,称重,超声(500 Hz)提取30 min,放冷,以70%甲醇补足至超声前质量,过0.22 μm滤膜,即得供试品溶液。
1.2.5 人参粉微生物数量测定 按照《中国药典》2015版附录“微生物限度检查法”[24]进行微生物限度检查,阴性组为空白培养基。
1.3 数据处理
所有数据均为三次平行实验的平均值,采用Excel 2007对实验数据进行处理,SPSS23.0进行方差分析和聚类分析,SIMCA-P 11.5软件进行PLSDA分析。
2 结果与分析
2.1 人参粉的杀菌效果评价
2.1.1 微生物测定结果 2020版《中国药典》非无菌药品微生物限定标准(通则1107)规定含需氧菌总数≤105cfu/g、霉菌和酵母菌总数≤103cfu/g、不得检出大肠埃希菌(1 g);不得检出沙门菌(1 g);耐胆盐革兰阴性菌应小于104cfu(1 g)[25]。按照不同稀释度进行检测,可知辐照灭菌剂量高效果好,辐照强度越大,杀菌效果越好。由表2可知,辐照强度为6和9 kGy时,灭菌效果最佳。紫外灭菌能减少一定的微生物数量,但效果不佳。湿热灭菌也能在一定程度上减少微生物的数量,但不适用于人参粉灭菌,会导致表面变色、结块。
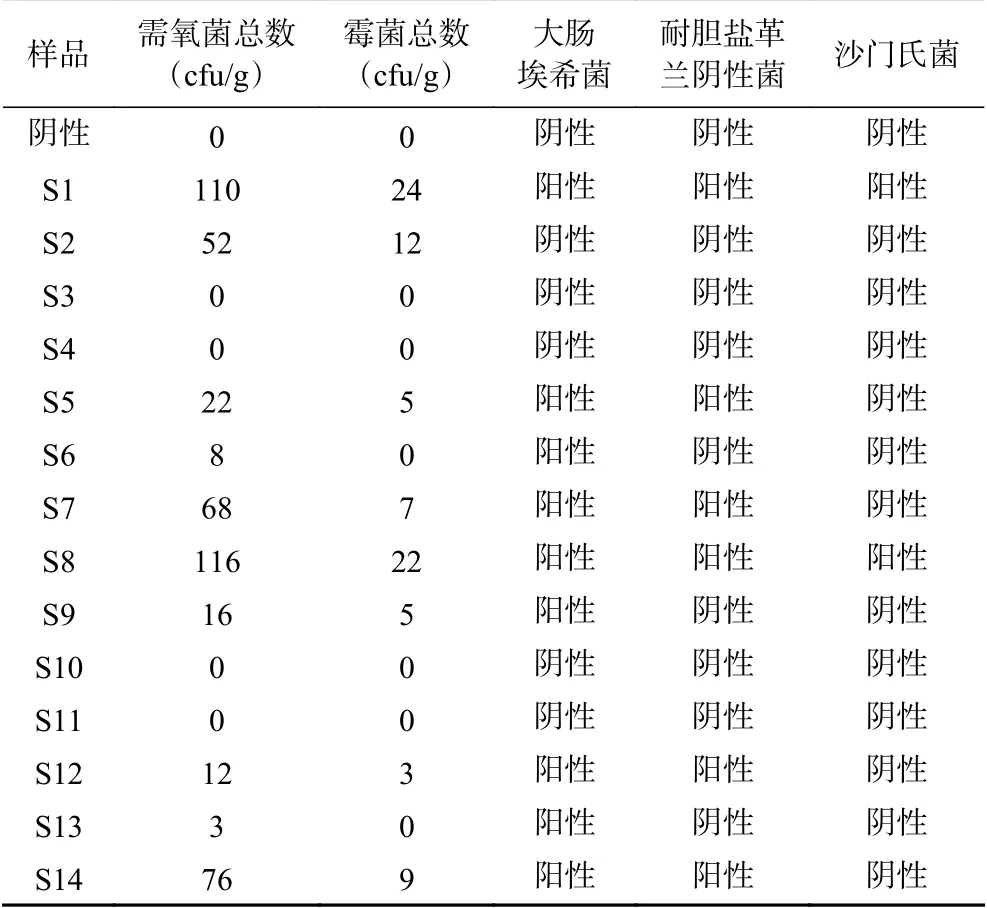
表2 灭菌人参粉微生物结果Table 2 Microbial results of sterilized ginseng powder
2.1.2 稳定性考察 人参粉样品放置6个月后,对样品(S1~S14)微生物数量进行测定,结果见表3。由此可知,放置6个月后,人参粉微生物数量有所上升,但与0个月(表2)差异不大,表明人参粉阴凉处密封放置时,微生物数量较稳定。
2.2 HPLC检测皂苷
2.2.1 样品的测定 按“1.2.4”项下色谱条件进行测定,混合对照品和人参粉供试品溶液(编号S1)色谱图见图1、图2。
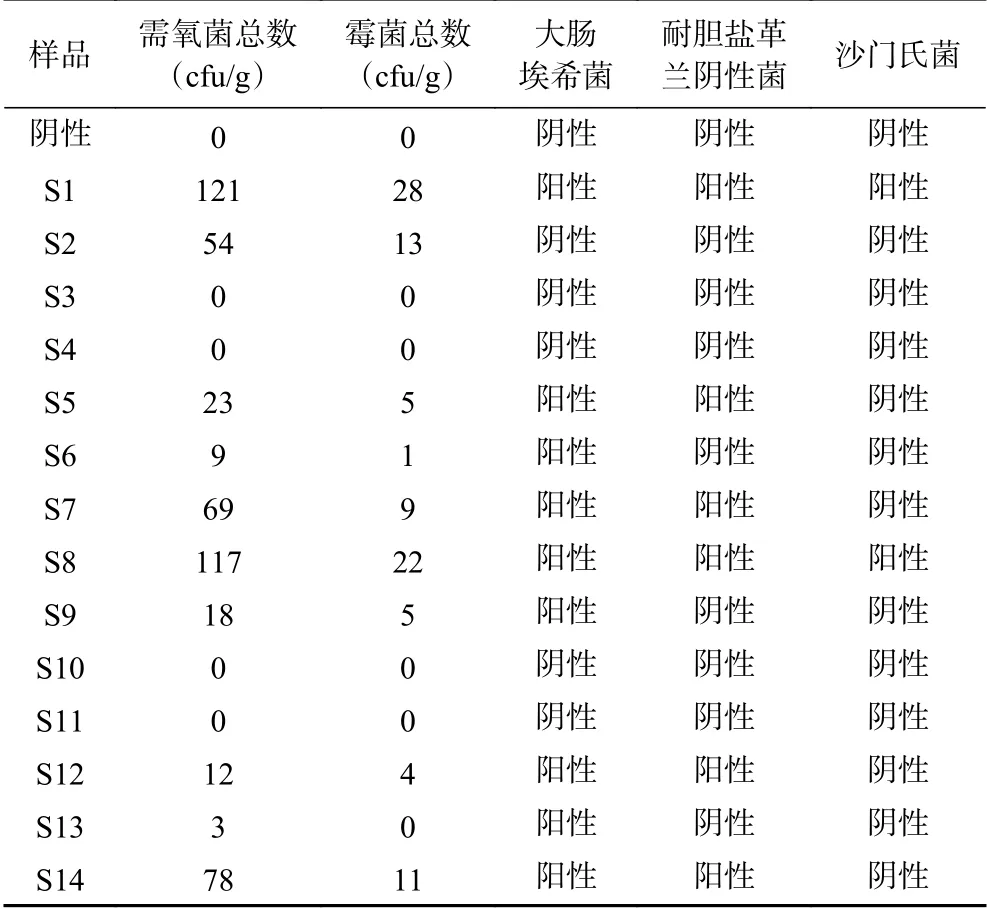
表3 灭菌人参粉6个月后微生物结果Table 3 Microbial results of sterilized ginseng powder
2.2.2 HPLC指纹图谱的生成 采用《中药色谱指纹图谱相似度评价系统》(2004版),以编号S1为参照谱,因人参皂苷Rb1的峰型较好面积大且稳定,因此选择其为参照峰。14批人参粉供试品溶液色谱图如图3所示,共确认出30个共有峰,指认出10个共有峰,本次实验所建立的指纹图谱能够较全面的反映人参粉的指纹图谱信息。共有峰相对保留时间和相对峰面积见表4、表5。
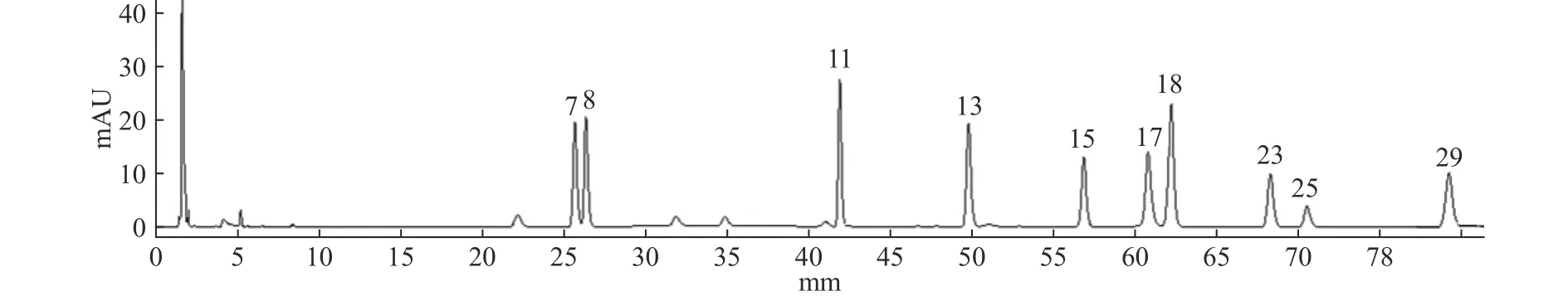
图1 混合对照品图谱Fig.1 Chromatograms of mixed control
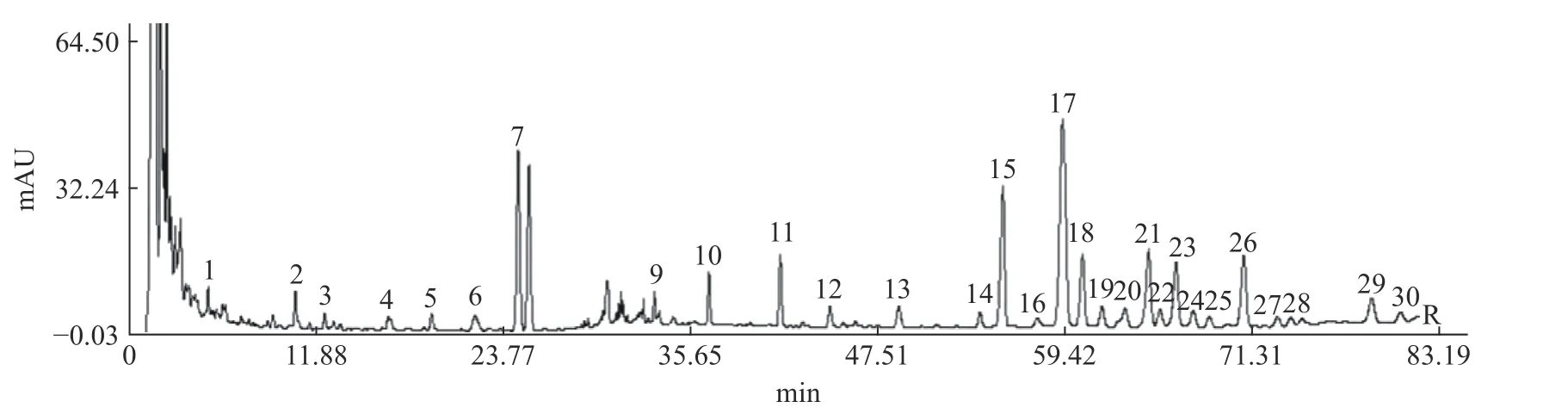
图2 人参粉指纹图谱Fig.2 Fingerprint of ginseng powder
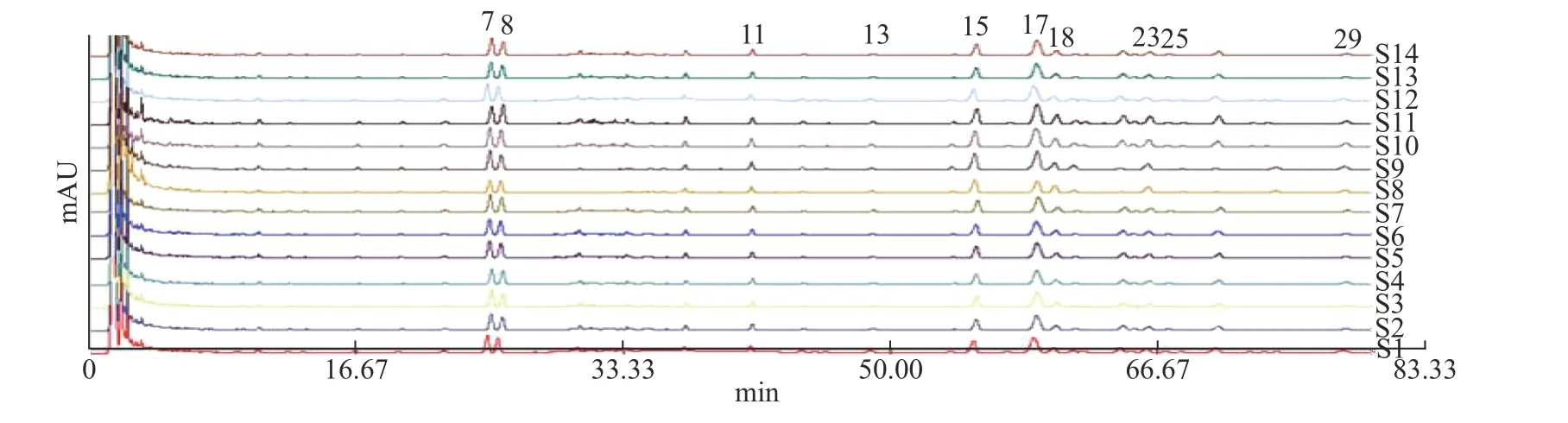
图3 14 批人参粉指纹图谱Fig.3 Fingerprints of 14 batches of ginseng powder
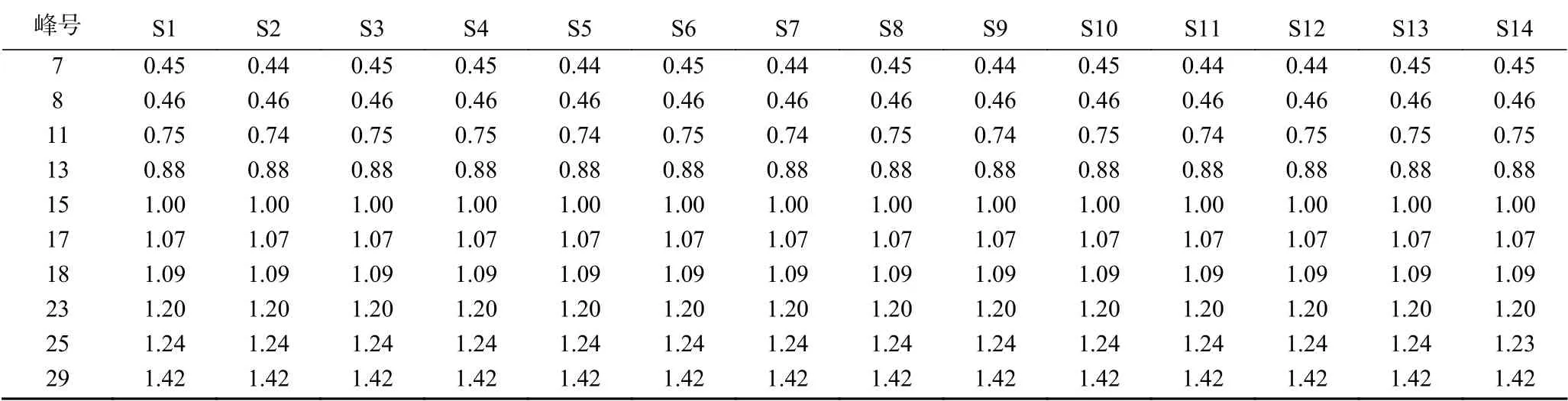
表4 共有峰相对保留时间(S1~S14)Table 4 Relative retention time of common peaks (S1~S14)
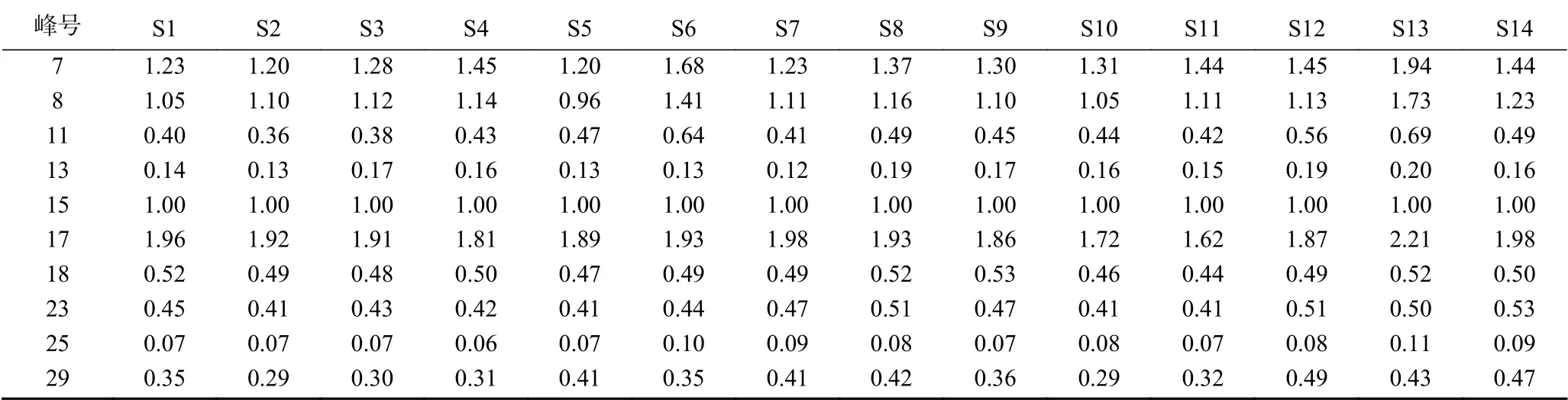
表5 共有峰相对峰面积(S1~S14)Table 5 Relative peak of common peaks (S1~S14)
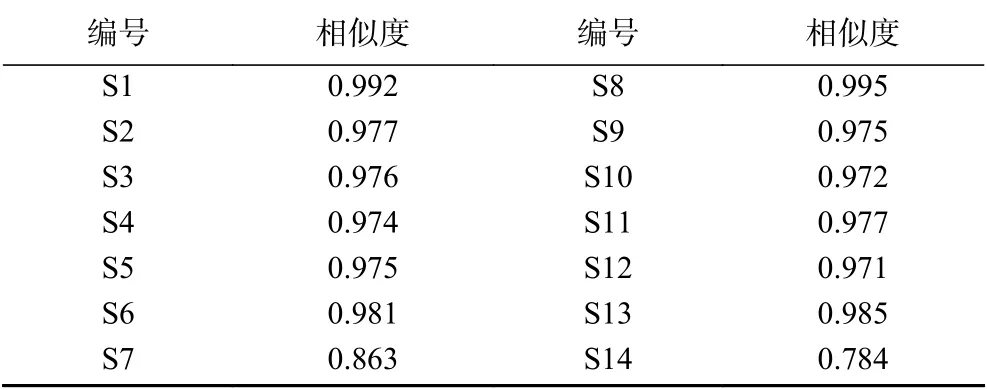
表6 人参粉相似度结果Table 6 Similarity results of ginseng powder
2.2.3 相似度评价 整体相似度评价14批样品见表6。结果显示,未灭菌、湿热灭菌样品S1、S8、S6、S13的相似度为0.981~0.995,分为一类。辐照灭菌、紫外灭菌S2~S5、S9~S12相似度为0.971~0.977,为一类,臭氧灭菌样品S7和S14相似度为0.784和0.863,为一类。
2.3 方法学考察
2.3.1 线性及范围 精密量取人参皂苷Rg1、Re、Rf、Rg2、Rb1、Ro、Rc、Rb2、Rb3、Rd的对照品储备溶液0.1、0.3、0.5、0.7、0.9、1 mL,并稀释至1 mL,分别吸取10 μL进样测定。以浓度为横坐标(x),色谱峰的峰面积为纵坐标(y)绘制标准曲线,计算回归方程及相关系数见表7,结果可知,方程线性关系良好。
2.3.2 精密度试验 取供试品溶液(编号S1),按“1.2.4”项下方法制备供试品溶液,按“1.2.2”项下色谱条件连续进样6次,参照峰为人参皂苷Rb1。共有峰相对峰面积的RSD<1.62%,相对保留时间的RSD<0.48%,表明仪器精密度良好。
2.3.3 稳定性试验 取同一人参粉供试品溶液(编号S1),分别于0、4、6、8、12、24h时进样测定。共有峰相对峰面积的RSD<1.87%,相对保留时间的RSD<0.51%,表明样品24 h内稳定。
2.3.4 重复性试验 取同一批人参粉供试品(S12),按“1.2.4”项下方法平行制备6份供试品溶液,进样测定。共有峰相对峰面积的RSD<2.74%,相对保留时间的RSD<0.37%,表明重复性良好。
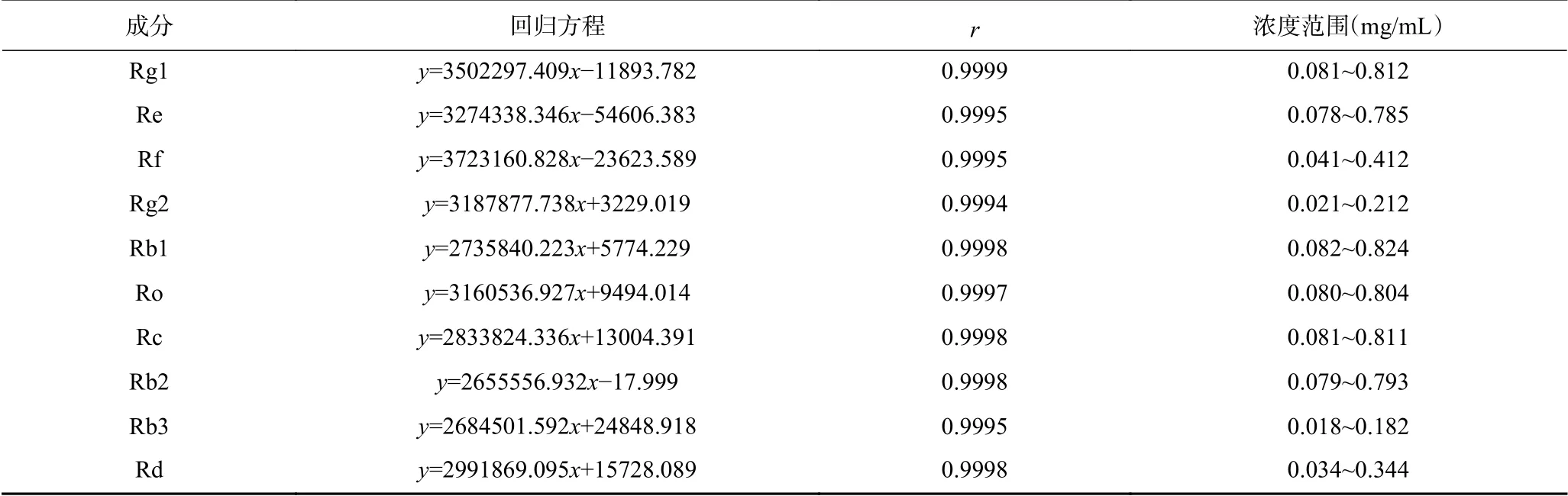
表7 线性范围结果Table 7 Results of linear range
2.3.5 加样回收率试验 取已知含量的人参粉0.5 g,精密称定9份,按样品皂苷含有量的50%、100%、150%精密加入对照品溶液,依色谱条件测定,计算得出人参皂苷Rg1、Re、Rf、Rg2、Rb1、Ro、Rc、Rb2、Rb3、Rd的平均回收率依次为98.68%、98.22%、99.20%、98.67%、98.75%、99.87%、98.63%、99.75%、98.47%、98.95%,RSD依次为0.46%、1.25%、1.23%、1.02%、1.48%、1.20%、1.44%、1.43%、1.37%、1.12%,结果表明方法的准确度良好。
2.4 人参粉灭菌前后皂苷含量测定结果
将14批人参粉按“1.2.4”项下方法制备成供试品溶液,按“1.2.2”项下色谱条件进样,每组实验重复3次,取平均值,结果见表8。湿热灭菌人参皂苷Rg1、Re、Rf的含量升高,人参皂苷Ro、Rc、Rb1、Rb2含量下降,随着辐照灭菌剂量的升高人参皂苷Rg1、Re、Rb1、Rf的含量均明显升高。臭氧灭菌Rg1、Re、Rb1、Rf、Ro、Rc、Rb2含量均明显下降。使用SPSS 23.0软件进行方差分析见表9。结果表明,不同灭菌方式对人参皂苷Rg1、Re、Rb1、Rc含量差异的影响极显著(P<0.01),对人参皂苷Ro、Rb2、Rd含量差异的影响也具有显著性(P<0.05)。
2.5 不同灭菌方式人参粉化学模式分析
2.5.1 聚类分析 以欧式距离为测度,选用平均连接法,指标确定为各共有峰的峰面积,用SPSS 23.0分析,见图4。欧式距离为7.5~10时,14批样品可聚为4类:未灭菌、紫外灭菌、低剂量辐照灭菌样品(S1、S2、S5、S8、S9、S12)聚为一类,臭氧灭菌样品(S7、S14)聚为一类,高剂量辐照灭菌样品(S3、S4、S10、S11)聚为一类,湿热灭菌样品(S6、S13)为一类,由聚类分析可知高剂量辐照灭菌、湿热灭菌、臭氧灭菌对人参粉皂苷含量影响较明显。
2.5.2 PLS-DA分析 对14批样品进行PLS-DA分析,自变量(X)和因变量(Y)确定为共有峰的峰面积和样品,绘制PLS-DA模型得分图,详见图5。可知,湿热灭菌、臭氧灭菌样品(S6、S7、S13、S14)为一类,分布在右侧;未灭菌、紫外灭菌和辐照灭菌人参粉(S1~S5、S8~S12)分布在左侧,聚为一类。相似度评价、聚类分析与PLS-DA结果大体一致。Q2=0.524,R2Y=0.518,均大于0.5,表示所建模型成立。由图6可知,人参皂苷、Ro、Rc、Rb1的VIP值分别为1.620、1.463、1.099。这3个峰的VIP值均大于1,可知3个变量贡献相对较大。
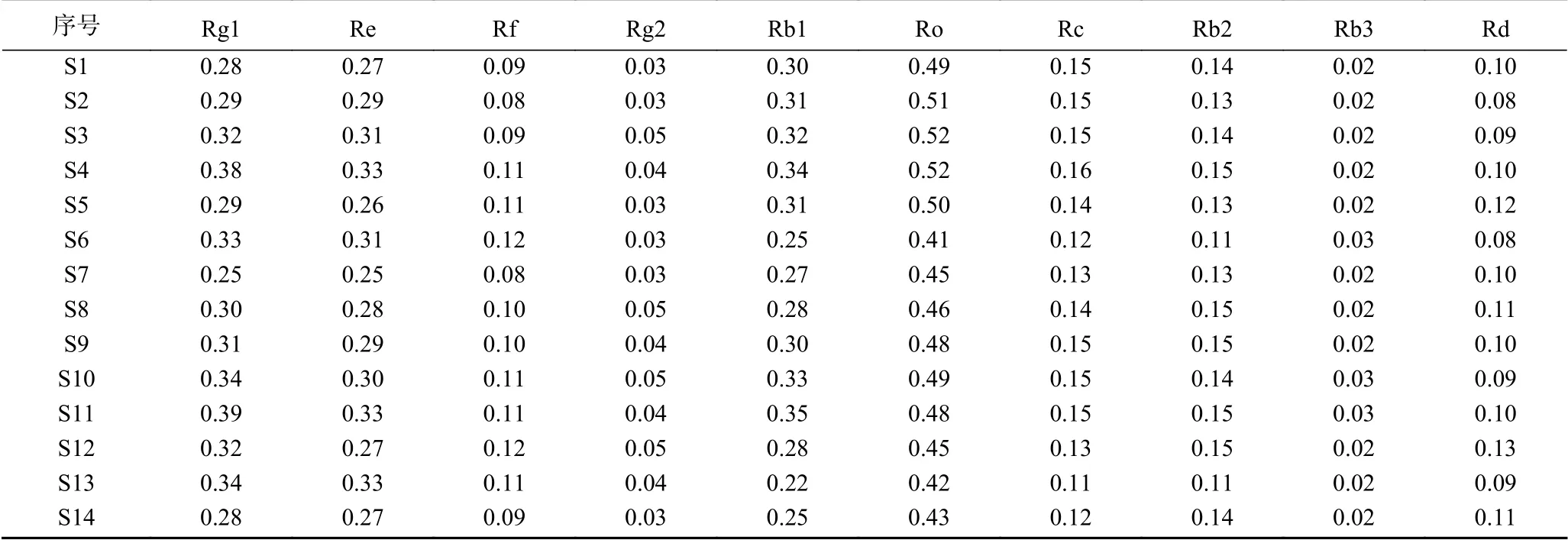
表8 人参粉皂苷相对含量(%)Table 8 Contents determination results of ginseng powder (%)
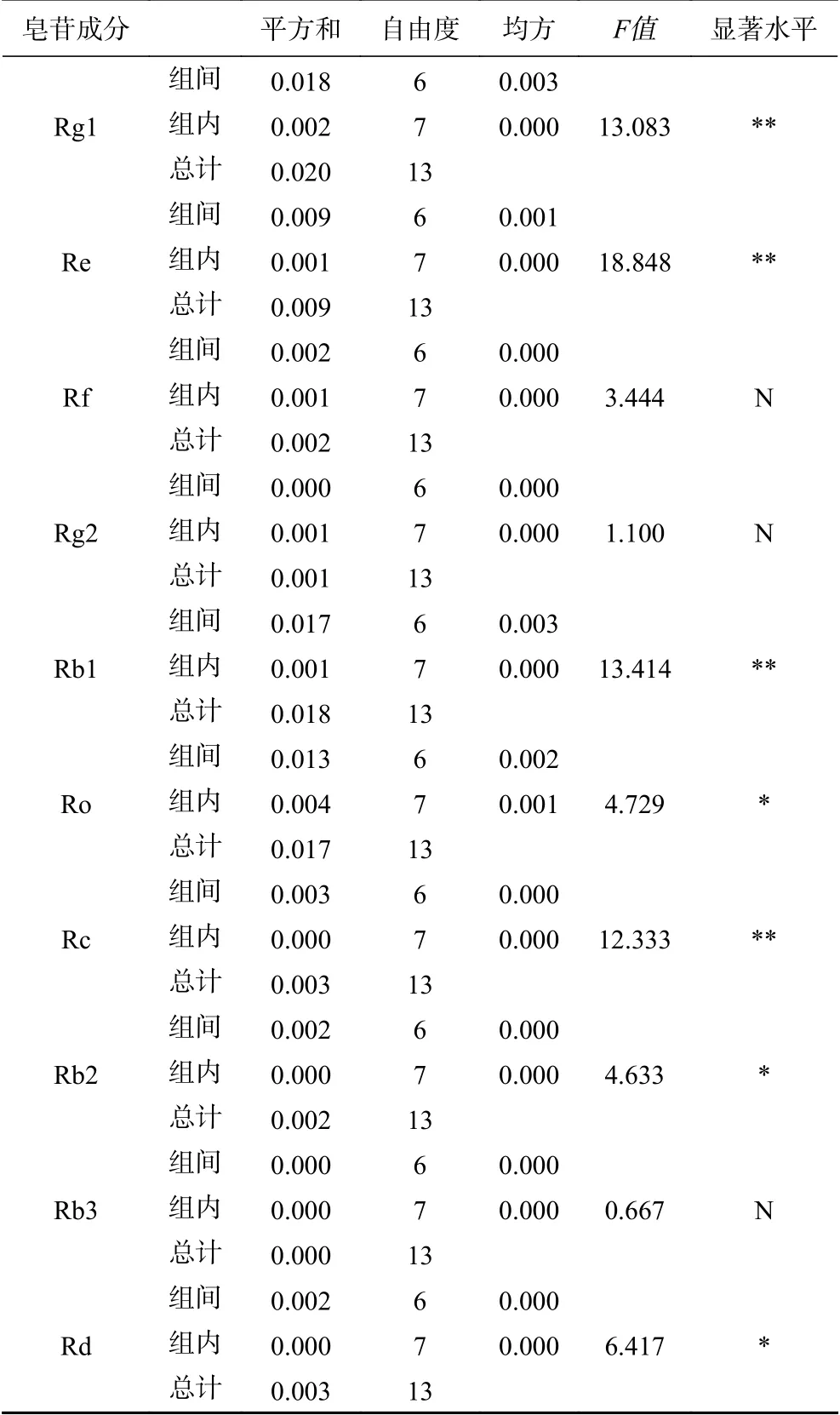
表9 人参粉皂苷含量的方差分析Table 9 Variance analysis of ginsenoside content in ginseng powder
2.6 灭菌前后稳定性考察
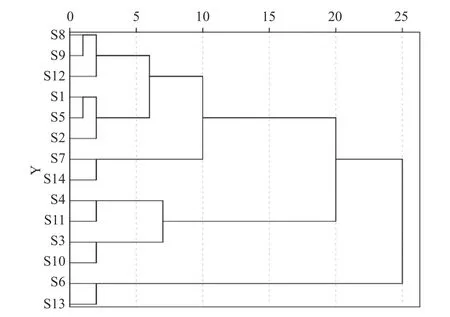
图4 聚类分析树状图Fig.4 Cluster analysis dendrogram
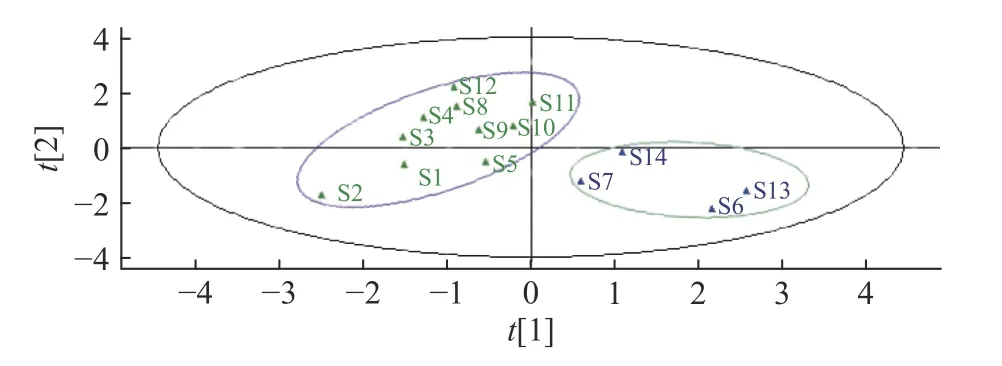
图5 PLS-DA模型得分图Fig.5 PLS-DA score plot
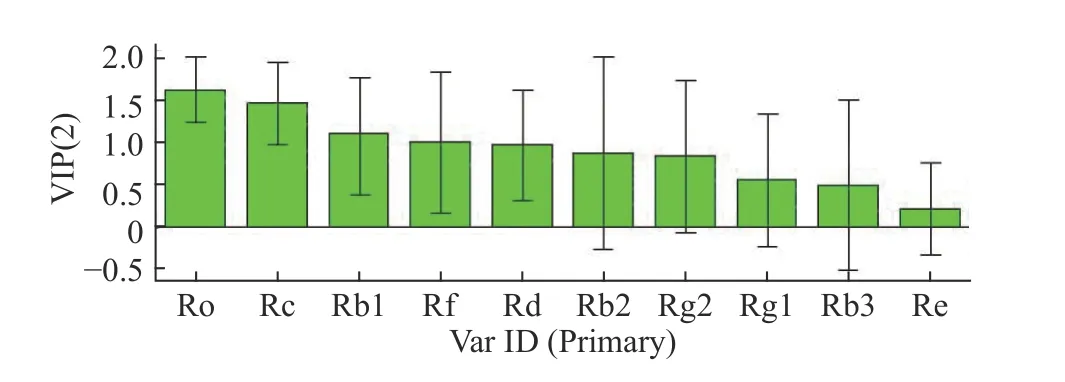
图6 共有峰的VIP值Fig.6 VIP value of common peaks
人参粉样品放置6个月后,采用“1.2.2”项下色谱条件对样品(S1~S7)测定,对比放置6个月样品(S1~S7)灭菌前与灭菌后含量变化见表10。结果可知,放置6个月过程中皂苷变化较小,含量相对稳定。
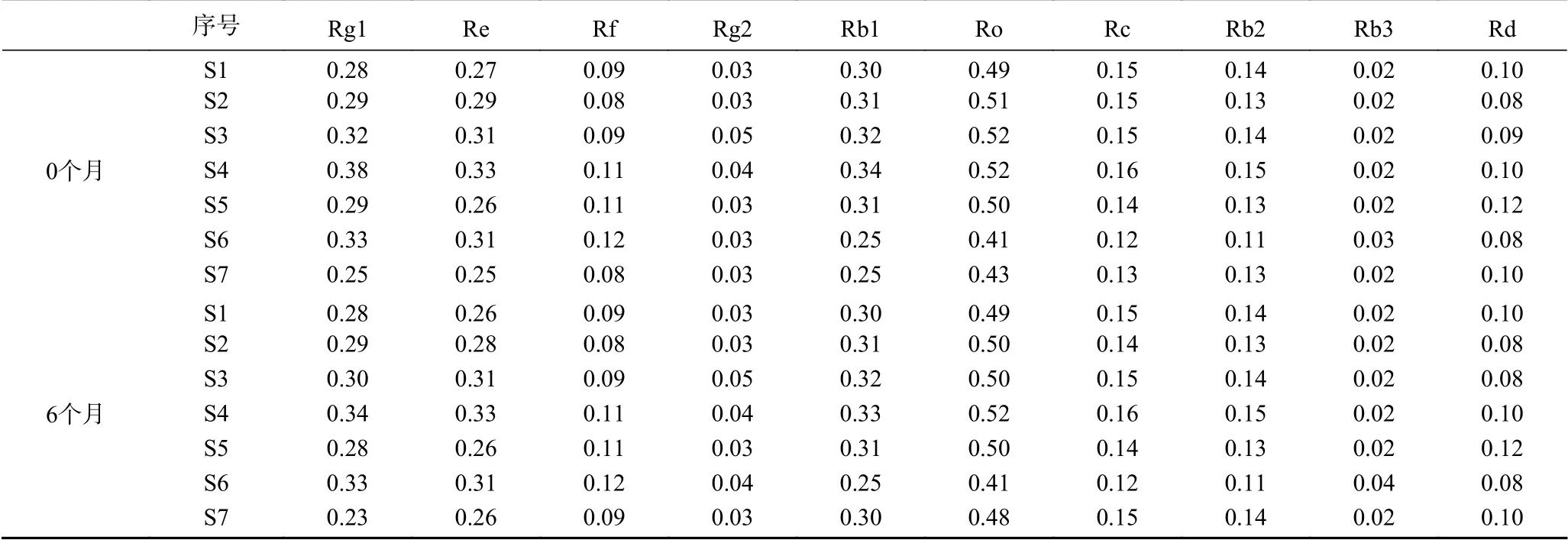
表10 皂苷含量稳定性考察Table 10 Stability of content of saponins
3 结论
本研究建立的HPLC指纹图谱能较好的反映人参粉的整体特征,紫外灭菌对样品皂苷含量影响不大,能有效减少微生物数量,但不能达到药典要求。湿热灭菌人参皂苷Rg1、Re的含量升高,人参皂苷Ro、Rc、Rb1、Rb2含量下降,会使人参粉变色、结块,故不能用于人参粉灭菌。由灭菌样品(S2~S4、S9~S11)可知,随着辐照灭菌剂量的升高人参皂苷Rg1、Re、Rb1、Rf、Ro的含量均明显升高,其余皂苷含量无明显变化。臭氧灭菌指纹图谱的相似度较低,分析原因臭氧灭菌后的人参粉可能发生了皂苷转化。CFDA 2015年版本的《中药辐照灭菌技术指导原则》建议中药最大总体平均辐照剂量原则上不超过10 kGy,且灭菌放置6个月相对稳定,结合微生物数量和皂苷含量结果,可知人参粉选用辐照灭菌剂量为6 kGy是可行的。本实验可为人参粉灭菌工艺提供理论支撑,但灭菌后的人参粉中多糖、还原糖、蛋白质含量、抗氧化活性以及药效作用是否存在变化,是否能够保证人参粉临床应用的有效性和安全性,有待今后进一步研究。
