AKT通路在大鼠弥漫性轴索损伤中的作用
2021-06-18李东波李从进宋锦宁王松林
金 涛,李东波,杨 涛,李从进,宋锦宁,王松林*
(1陕西省安康市中心医院神经外科,安康 725000;2陕西省安康市中医院神经外科;3西安交通大学第一附属医院神经外科;*通讯作者,E-mail:263288612@qq.com)
弥漫性轴索损伤(diffuse axonal injury,DAI)后一系列生化和细胞反应可导致继发性的轴索断裂,但具体机制不明[1,2]。丝氨酸-苏氨酸蛋白激酶(serine/threonine protein kinase,AKT)在葡萄糖代谢、凋亡、细胞增殖、迁移等过程中起重要作用,不但与脑缺血过程中的细胞凋亡密切相关,且神经营养因子、缺血预处理和缺血后处理等也通过激活AKT通路抑制细胞凋亡,但是其在DAI病理生理过程中的作用仍不明确[3,4]。
本研究拟通过给予DAI大鼠AKT通路抑制剂,观察AKT通路在大鼠DAI后细胞凋亡、胶质反应、轴索损伤中的作用,探索其潜在的分子机制。
1 材料与方法
1.1 实验动物、试剂及仪器
相同遗传背景SPF级健康成年雄性SD大鼠48只,购自西安交通大学医学部实验动物中心(许可证号:SCXK(陕)08-018,合格证号:2007-001),体质量250-280 g。所有实验伦理经西安交通大学医学部生物医学伦理委员会批准。AKT通路抑制剂LY294002(Sigma,19-142,美国);抗Neurofilament-H抗体(NF-H,CST,2836,美国);抗Caspase-3抗体(CST,9662,美国);抗cleaved Caspase-3抗体(C-Caspase-3,CST,9661,美国);抗Occludin-1、ZO-1、Claudin-5、MMP-9、β-APP)(ABCAM,ab216327,ab190085,ab172968,ab38898,ab15272,英国);抗GFAP抗体(CST,80788,美国);抗Iba-1抗体(ABCAM,ab178846,英国);抗Tau46、β-actin抗体(CST,货号4019,货号3700,美国);抗AKT抗体(CST,9272,美国)、抗phospho-AKT抗体(Ser473,P-AKT,CST,4060,美国)、抗GSK-3β抗体(CST,12456,美国)、抗phospho-GSK-3β(p-GSK-3β,Ser9,CST,5558,美国)。凝胶成像系统(JS-380A,上海培清科技有限公司)。
1.2 实验动物分组
采用随机数字表法对大鼠进行编号(从1编号到48),并将其分为对照组、DAI 1 d组、DAI 1 d+vehicle组、DAI 1 d+LY294002(LY)组,每组12只。对照组为正常大鼠,仅接受麻醉;大鼠经瞬间旋转损伤装置造成DAI模型,DAI 1 d组大鼠在造模后1 d时取脑,DAI 1 d+LY组大鼠在造模后即刻侧脑室注射LY294002(溶于DMSO,终浓度为10 μmol/L);DAI 1 d+vehicle组在造模后即刻注射DMSO。
1.3 DAI模型的建立
大鼠麻醉后,将大鼠头颅固定于瞬间旋转损伤装置上,待大鼠将要清醒时,按下扳机,装置使大鼠头颅瞬间旋转90°并即刻停止[5]。该实验伦理经西安交通大学医学院生物医学伦理委员会批准。动物实验及处死均符合相关的动物使用和保护条例。
1.4 脑室注射溶剂及AKT通路抑制剂
大鼠造模后固定于脑立体定向仪上,确定前囟,以前囟点为中心,旁开1.5 mm,向后囟方向1.1 mm,深4.5 mm[6]。大鼠在造模后立即注射DMSO及AKT通路抑制剂LY294002(均10 μl)。
1.5 HE染色观察皮层病理变化
石蜡切片经苏木精液、伊红液染色,中性树胶封固。于Leica-Q550CW图像采集与分析系统上采集、分析图片。
1.6 免疫组织化学法检测NF-H的表达
为评估DAI模型的有效性和稳定性,利用免疫组化检测DAI 1 d组大鼠皮层NF-H的表达,石蜡切片高压修复抗原。山羊血清室温封闭后加入抗NF-H一抗(1 ∶200),4 ℃孵育过夜。分别经生物素化二抗(1 ∶5 000)、辣根酶标记链霉卵白素孵育,DAB显色、苏木素复染,封片。每张切片随机选取6个视野(×200),Image-Pro Plus 6.0对切片进行半定量分析。免疫组化结果评分依据阳性细胞数和染色强度。阳性细胞数的评分标准:无细胞染色为0分,0<阳性细胞数≤10%为1分,10%<阳性细胞数≤50%为2分,50%<阳性细胞数≤80%为3分,80%<阳性细胞数≤100%为4分。染色强度评分标准:无染色为0分,弱染色为1分,中等强度染色为2分,强染色为3分。总分值为阳性细胞数分值×染色强度分值[7]。
1.7 Western blot检测相关蛋白的表达
提取各组大鼠皮层组织蛋白,蛋白经BSA试剂盒定量,各组蛋白经电泳、转膜后封闭,分别加入一抗Caspase-3(1 ∶1 000)、cleaved Caspase-3(C-Caspase-3,1 ∶1 000)、Occludin-1(1 ∶500)、ZO-1(1 ∶1 000)、Claudin-5(1 ∶1 000)、MMP-9(1 ∶1 000)、β-APP(1 ∶2 000)、GFAG(1 ∶1 000)、Iba-1(1 ∶1 000)、Tau46(1 ∶1 000)、AKT(1 ∶1 000)、p-AKT(1 ∶1 000)、GSK-3β(1 ∶1 000)、p-GSK-3β(1 ∶1 000),β-actin为内参(1 ∶2 000),二抗孵育后显影,凝胶成像系统拍照,Image J软件作定量分析。
1.8 统计学分析
应用SPSS 16.0进行数据分析,所有实验数据均以均数±标准差表示,在满足正态性和方差齐性的条件下,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 DAI后大鼠皮层组织病理改变及NF-H的表达
对照组皮层轴索完整,神经元核仁清晰、完整。DAI 1 d组可见核固缩,轴突肿胀、扭曲(见图1)。与对照组相比,DAI 1 d组NF-H的表达明显升高(P<0.05,见图1)。

图1 大鼠DAI后皮层的病理改变及NF-H的表达 (HE染色,×200)Figure 1 Pathological changes and expression of NF-H in cortex of rats after DAI (HE staining,×200)
2.2 AKT通路抑制剂加重大鼠DAI后皮层细胞凋亡
与对照组相比,DAI 1 d组、DAI 1 d+vehicle组、DAI 1 d+LY组Caspase-3及C-Caspase-3的表达均升高。与DAI 1 d组相比,DAI 1 d+vehicle组Caspase-3及C-Caspase-3的表达无明显差异(P>0.05);与DAI 1 d组相比,DAI 1 d+LY组Caspase-3及C-Caspase-3的表达量更高,差异有统计学意义(P<0.05,见图2)。

与对照组相比,*P<0.05;与DAI 1 d组相比,#P<0.05图2 AKT通路对DAI大鼠皮层凋亡的影响Figure 2 Effect of AKT pathway on apoptosis in cortex of DAI rats
2.3 AKT通路抑制剂加重大鼠DAI后皮层BBB的破坏
与对照组相比,DAI 1 d组、DAI 1 d+vehicle组、DAI 1 d+LY组的Occludin-1、Claudin-5、ZO-1的表达均减少,MMP-9的表达增加(均P<0.05)。与DAI 1 d组相比,DAI 1 d+vehicle组各蛋白的表达无明显差异(P>0.05);DAI 1 d+LY组的Occludin-1、Claudin-5、ZO-1的表达量更少,MMP-9的表达增加,差异有统计学意义(P<0.05,见图3)。
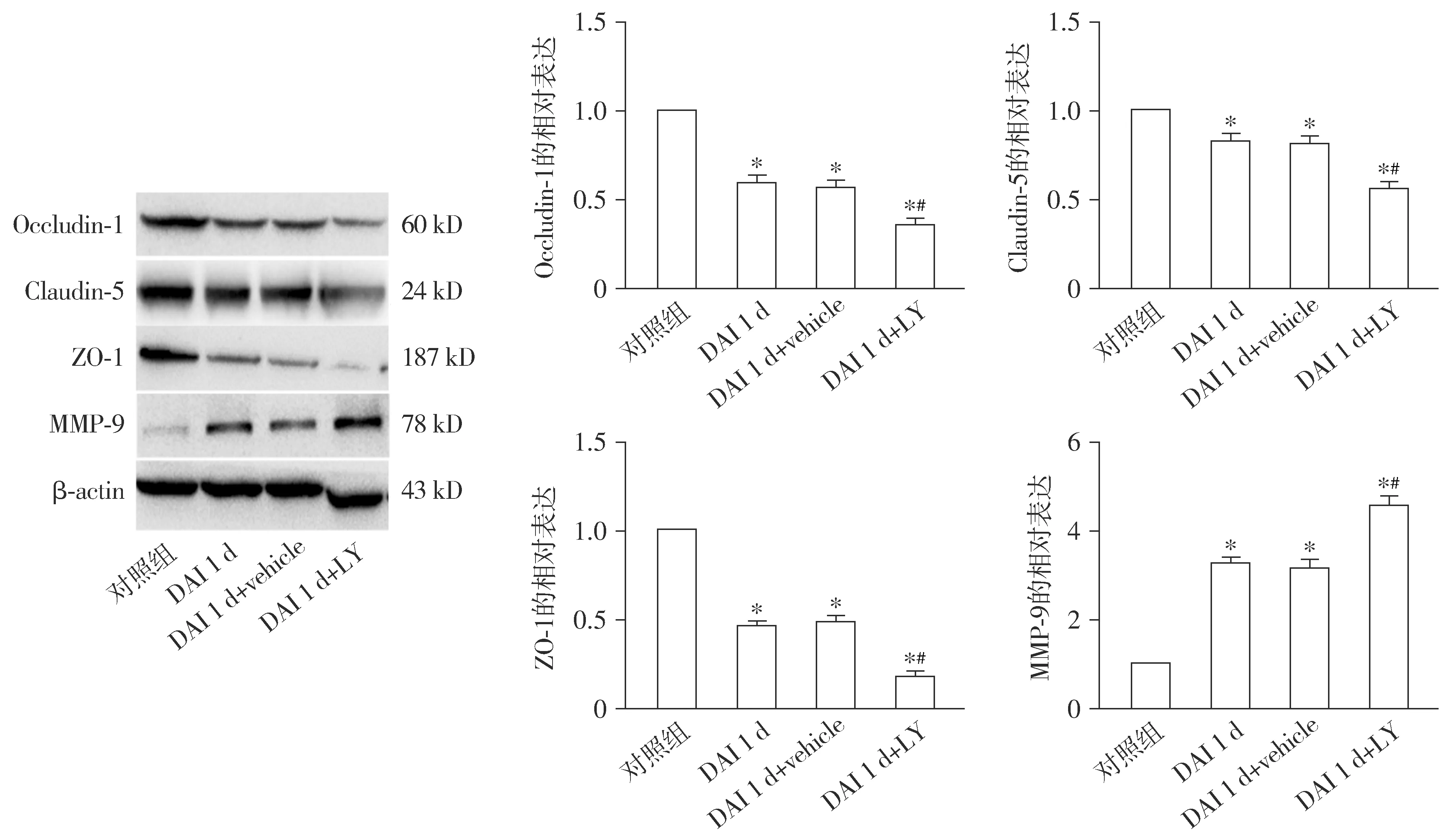
与对照组相比,*P<0.05;与DAI 1 d组相比,#P<0.05图3 抑制AKT通路加重大鼠DAI 1 d时皮层的BBB破坏Figure 3 Inhibition of AKT pathway increases BBB damage in cortex of DAI 1 d rats
2.4 AKT通路抑制剂加重大鼠皮层轴索损伤及胶质反应
与对照组相比,DAI 1 d组、DAI 1 d+vehicle组、DAI 1 d+LY组Tau46的表达均减少,β-APP、GFAP、Iba-1的表达均增加(P<0.05)。与DAI 1 d组相比,DAI 1 d+vehicle组各蛋白的表达均无明显差异(P>0.05);DAI 1 d+LY组的Tau46的表达量更少,β-APP、GFAP、Iba-1的表达增加,差异有统计学意义(P<0.05,见图4)。

与对照组相比,*P<0.05;与DAI 1 d组相比,#P<0.05图4 抑制AKT信号通路加重DAI 1 d时的轴索损伤并促进胶质细胞活化Figure 4 Inhibition of the AKT pathway increases axonal injury and glial cell activation in cortex of DAI 1 d rats
2.5 AKT通过下游GSK-3β发挥脑保护作用
与对照组相比,DAI 1 d组、DAI 1 d+vehicle组、DAI 1 d+LY组p-AKT及p-GSK-3β的水平均降低(P<0.05)。与DAI 1 d组相比,DAI 1 d+vehicle组P-AKT、P-GSK-3β的水平均无明显差异(P>0.05);DAI 1 d+LY组P-AKT及P-GSK-3β的水平更低,差异有统计学意义(P<0.05,见图5)。

与对照组相比,*P<0.05;与DAI 1 d组相比,#P<0.05图5 抑制AKT通路可抑制下游GSK-3β的磷酸化Figure 5 Inhibition of the AKT pathway inhibits phosphorylation of GSK-3 in cortex of DAI 1 d rats
3 讨论
DAI主要表现为轴索扭曲、肿胀、断裂及皮髓质交界区穿行的血管中断等[8]。本研究中DAI大鼠皮层可见细胞核固缩、轴突肿胀、扭曲、断裂等,且NF-H的表达也升高,提示本研究所采用模型可真实地模拟临床所见的DAI。此外,前期研究结果表明:本研究所采用的DAI模型,在伤后1-3 d时损伤最重[5,7],故本研究在伤后即刻给予AKT抑制剂,观察伤后1 d时的病理生理变化。
激活的AKT通过磷酸化一系列细胞内蛋白介导下游反应,调控细胞存活、生长、增殖等生理过程[9]。既往发现在大鼠皮层撞击脑外伤模型中,给予AKT抑制剂,细胞凋亡明显增加,AKT通路在脑外伤后发挥抗凋亡的作用[10,11]。本研究通过检测Casapse-3及C-Caspase-3观察DAI皮层的细胞凋亡情况,生理状态下,Caspase-3以酶原的形式存在于胞浆中,在凋亡的早期被激活,裂解为两个小分子的活性片段,这些活性片段导致细胞凋亡[12]。本研究发现DAI后1 d时,Caspase-3表达量增加,且其裂解产物C-Caspase-3的表达也增加,而给予AKT通路抑制剂后,Caspase-3、C-Caspase-3的表达量更多,提示AKT通路在DAI后发挥抗凋亡作用。
DAI后血脑屏障(blood brain barrier,BBB)通透性及超微结构均发生改变,BBB通透性增加是造成脑水肿的主要原因之一[13]。生理情况下MMP-9几乎不表达,DAI后MMP-9表达增多,MMP-9可降解ZO-1等蛋白,与脑微血管通透性增加密切相关[14]。本研究发现DAI 1 d后,Occludin-1、Claudin-5、ZO-1的表达均减少,而MMP-9的表达升高,提示DAI后BBB完整性受到破坏,而AKT通路抑制剂使Occludin-1、Claudin-5、ZO-1的表达更低,MMP-9的含量更高,提示抑制AKT通路可加重BBB损伤。
Tau蛋白是神经元的细胞骨架成分,DAI后Tau蛋白被分解成多肽,表达量减少[15]。DAI后也发生轴浆运输障碍,引起β-APP在损伤部位异常聚集、表达上调[16]。AKT通路在轴索损伤中作用目前尚未报道,本研究中DAI 1 d后,Tau的表达量减少,而β-APP的表达明显升高,而给予AKT通路抑制剂后,Tau的表达量更低,β-APP的表达量更多,提示抑制AKT通路可加重轴索损伤。
DAI后星型胶质细胞及小胶质细胞均能持续激活,释放炎性细胞因子等细胞毒性物质,诱发神经元死亡[17]。本研究中,DAI后GFAP及Iba-1的表达升高,提示皮层内胶质细胞活化。抑制AKT通路后,GFAP及Iba-1的表达更高,提示AKT通路被抑制后可加重DAI后的胶质细胞活化。既往研究发现,帕金森小鼠脑内AKT通路被抑制后,星型胶质细胞及小胶质细胞的增殖则受到抑制[18]。
GSK-3β是AKT下游的重要蛋白,GSK-3β在细胞内活性受双位点磷酸化调控,在Tyr216磷酸化激活,在Tyr216去磷酸化或在Ser9磷酸化而失活[19,20]。活化的AKT与GSK-3β结合后,诱导其向细胞膜转位,磷酸化Ser活性位点而使其失活,最终影响GSK下游底物[21,22]。本研究中,DAI 1 d后AKT Ser473及GSK-3β Ser9的磷酸化水平均降低,而抑制AKT后,GSK-3β的磷酸化水平更低,提示AKT通过调控下游GSK-3β的磷酸化水平发挥脑保护作用。GSK-3β在脑缺血缺氧损伤、脑退行性疾病等中枢神经系统疾病中发挥重要作用。在缺血刺激后,AKT首先通过Ser473磷酸化而激活,继而诱导包括GSK-3β在内的促凋亡因子失活,最终抑制神经细胞死亡,这是神经元抵抗凋亡的机制之一[23-25]。
综上,DAI后AKT通路被抑制,其可能通过调控下游GSK-3β的磷酸化水平破坏BBB,加重胶质反应,最终导致轴索损伤和细胞凋亡。
