芦丁对高脂高糖饮食造成的小鼠脑损伤的保护作用
2021-06-18周勇兵马新壮余丽丽汤雨婷
周勇兵,马新壮,余丽丽,汤雨婷,王 力*
(1蚌埠医学院公共卫生学院营养与食品卫生学教研室,蚌埠 233030;2慢性疾病免疫学基础与临床安徽省重点实验室;*通讯作者,E-mail:wangli@bbmc.edu.cn)
当代社会,由饮食诱导肥胖引起的各种健康问题备受关注。单纯性肥胖(obesity)是由多因素引起的体内脂肪积累过多而影响人类健康的慢性流行性疾病。它是一种涉及遗传、代谢、激素和行为成分的慢性疾病[1]。肥胖的发生会引起多种代谢并发症,导致人体内各脏器不同程度氧化损伤,除了内源性防御外,减少氧化还原的均衡饮食在预防由氧化损伤所导致疾病的发展过程中发挥着重要作用[2]。肥胖导致的脏器氧化损伤日益积累会导致细胞功能损害。为了淬灭自由基或减少氧化产物,研究者不断寻找天然高效的化学成分等天然抗氧化物质。希望这类天然抗氧化物质能在控制肥胖以及抵抗因肥胖而产生的危害上发挥重要作用。黄酮类物质是一类多酚类化合物,其具有平喘、抗氧化、抗炎等多重生物学活性[3],芦丁(rutin)作为黄酮类物质典型代表,广泛存在于桑葚、葡萄、茶叶、蔬菜等植物中,具有多种生理药理活性[4],可预防和治疗由高脂饮食引起肥胖所导致的多种代谢性疾病,Choi等[5]研究发现芦丁具有抑制脂肪前体细胞形成的作用,Hamit等[6]研究发现芦丁对大鼠大脑组织中因大肠菌素诱导产生的氧化损伤具有神经保护作用。因此,本研究通过建立芦丁干预高糖或高脂饮食诱导ICR雄性小鼠营养肥胖模型,来探索芦丁在小鼠脑脂质氧化损伤中所起的抗氧化作用。
1 材料和方法
1.1 主要试剂和仪器
芦丁(纯度≥98%,C27H30O16,百灵威),4%多聚甲醛(塞维尔生物科技公司),甘油三酯(TG)、总胆固醇(TC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)检测试剂盒(南京建成生物工程研究所),其他化学试剂均为分析纯。KDC-160HR高速冷冻离心机(科大创新公司),DY89-Ι型电动玻璃匀浆机(宁波新芝有限公司),Synergy2型酶标仪(Biotek,美国)。
1.2 实验动物
SPF级ICR雄性小鼠40只,购自南京市江宁区青龙山动物繁殖场,动物合格证号为SCXK(沪)2013-0006,体质量22-24 g。各组小鼠在12 h/12 h昼夜交替循环时间,20-25 ℃室温和50%-60%湿度的标准条件下喂养。实验处理及过程经蚌埠医学院实验动物伦理委员会审批(伦动科批字[2018]第006号),符合动物伦理要求。
1.3 指标检测及方法
1.3.1 分组和构建模型 颗粒状啮齿动物饲料适应性喂养1周后,随机均等分为:正常组,喂养普通饲料(小麦19%,玉米38%,麸皮14%,豆粕12%,鱼粉8%,鸡蛋3%,其他灰分6%);高脂组,喂养高脂饲料(78.8%普通饲料,猪油10%,蛋黄粉10%,胆固醇1%以及胆盐0.2%);高糖组,喂养普通饲料+60%的高葡萄糖溶液;芦丁+高脂组,喂养高脂饲料+芦丁饱和水溶液;芦丁+高糖组,喂养普通饲料+混合溶液(60%的高葡萄糖溶液+芦丁饱和水溶液)。小鼠可自由饮水和摄食。芦丁+高脂组和芦丁+高糖组所用芦丁水溶液为1 g芦丁溶于1 L ddH2O,每天均超声半小时后使用。每日观察、每周称重、记录。
1.3.2 组织采集及处理 适宜实验环境饲养120 d后,禁食一晚。摘眼球取血,血液样本分离血清进行分析。处死小鼠后快速解剖,用4%多聚甲醛固定部分分离出大脑组织和海马组织,作Nissl染色和HE染色,其余脑组织先用液氮冷冻,然后在-80 ℃冰箱中保存,后续用于相关氧化应激指标和生化指标检测。
1.3.3 脑组织病理学检查 大脑皮层区和海马区分离组织,经4%多聚甲醛溶液固定,石蜡包埋,分别连续切取4-6 μm厚切片,进行尼氏(Nissl)染色(甲苯胺蓝 ∶无水乙醇=1 ∶1,与新鲜的0.1%NaCl溶液混合)和苏木精-伊红(HE)染色,室温下染色30 min,冲洗切片,二甲苯透明,封片,光学显微镜观察、拍照。
1.3.4 小鼠血清中TG、TC含量测定 眼眶采集血样,室温静置30 min后,分离血清,用试剂盒测定血清中TG、TC的含量。
1.3.5 脑组织中MDA含量及抗氧化酶SOD、GSH-Px活性水平测定 用生理盐水(0.9%NaCl溶液)洗涤脑组织,剪碎后混匀,制成10%脑组织匀浆,离心10 min后收集上清。测定脑组织匀浆上清中SOD、GSH-Px活性水平及MDA含量。
1.4 统计学处理

2 结果
2.1 体质量变化
与正常组相比,高脂组小鼠体质量呈增长趋势,第4周开始增长趋势较快,第9周开始差异有统计学意义(P<0.05);与高脂组相比,芦丁+高脂组一开始就表现出体质量增长较缓,第9周开始差异有统计学意义(P<0.05,见表1)。与正常组相比,高糖组小鼠体质量也呈增长趋势,第9周开始差异有统计学意义(P<0.05);与高糖组相比,芦丁+高糖组表现出体质量增长较缓趋势,但无明显减轻,第12周开始差异有统计学意义(P<0.05,见表2)。
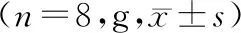
表1 芦丁干预高脂饮食喂养小鼠的体质量比较
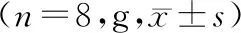
表2 芦丁干预高糖饮食喂养小鼠的体质量比较
2.2 各组小鼠大脑皮层和海马区组织变化
HE染色可见,正常组大脑皮层及海马区结构完整,形态正常,神经细胞排列规则,清晰;高脂组和高糖组可见部分神经细胞排列紊乱,轻度水肿,边缘有细胞凋亡现象;而经芦丁干预后,芦丁+高脂组和芦丁+高糖组水肿减轻,病理损伤明显改善(见图1)。尼氏染色结果显示,正常组大脑皮层细胞排列紧密,细胞核淡染,胞质中可见大量深染的粗颗粒虎斑状Nissl小体;高脂组和高糖组小鼠大脑皮层结构变薄,神经细胞数量明显减少,部分细胞核固缩,虎斑结构明显减少;而经芦丁干预后,芦丁+高脂组和芦丁+高糖组细胞排列较高脂组和高糖组规整,虎斑结构数量增加(见图2)。
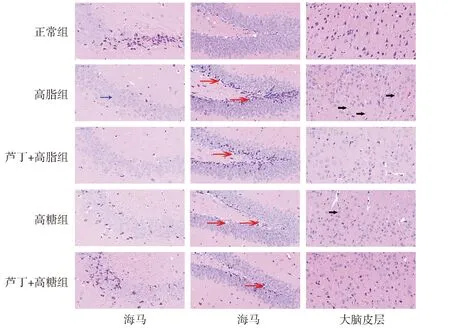
蓝色箭头:细胞排列紊乱;红色箭头:轻度水肿、空泡;黑色箭头:细胞凋亡、细胞核固缩。图1 各组小鼠脑组织形态学比较 (×40)Figure 1 Morphological changes of mouse brain tissues in each group (×40)

黑色箭头:虎斑结构;红色箭头:轻度水肿、空泡图2 芦丁对各组小鼠大脑皮层及海马区神经元分布的影响Figure 2 Effect of rutin on the distribution of neurons in the cerebral cortex and hippocampus of mice in each group
2.3 小鼠大脑组织中总胆固醇(TG)、甘油三酯(TC)的含量变化
HFD组血清中TG、TC含量较正常组均显著增高(P<0.05),rutin+HFD组TG、TC含量与HFD组相比明显降低(P<0.05)。与正常组相比,HGD组TG、TC含量无明显变化;与HGD组相比,rutin+HGD组TG、TC含量明显降低(P<0.05,见表3,4)。
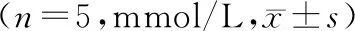
表3 芦丁干预对高脂饮食小鼠大脑TG、TC含量的影响
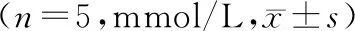
表4 芦丁干预对高糖饮食小鼠大脑TG、TC含量的影响
2.4 芦丁对小鼠脑MDA含量和SOD、GSH-Px活性变化的影响
小鼠脑氧化应激检测结果显示,HFD组和HGD组脑组织匀浆中MDA含量显著高于正常组(P<0.05);经芦丁干预后,rutin+HFD组MDA含量与HFD组相比恢复到正常水平(P<0.05),rutin+HGD组MDA含量有所下降,但差异无统计学意义(P>0.05)。与正常组相比,HGD组GSH-Px活性水平显著降低(P<0.05);而rutin+HGD组GSH-Px活性水平与HGD组相比升高(P<0.05,见表5,6)。
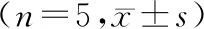
表5 芦丁干预对高脂饮食小鼠大脑MDA含量、GSH-Px和T-SOD活性的影响

表6 Rutin干预对高糖饮食小鼠大脑MDA含量、GSH-PX和T-SOD活性的影响
3 讨论
神经组织代谢旺盛,其相关抗氧化性能较弱,以及由于其所处的高耗氧状态,大脑相对于身体其他部分而言更容易受到氧化损伤[7]。本实验结果显示,高脂、高糖组小鼠体质量明显增加,TG和TC含量均有增加,大量的脂类和糖类摄入可能造成脂代谢紊乱,从而导致机体氧化应激进而促使血液中的TG运送到组织器官[8]。芦丁干预后,对脂代谢紊乱改善有积极作用。MDA、SOD和GSH-Px可一同反应体内氧化应激水平。MDA是用作检测和定量包括大脑在内的任何机体组织脂质过氧化反应程度的代谢产物之一[9,10],SOD能够比较直观地反应人体抗氧化能力和过氧化水平[11-13]。高脂组和高糖组脑组织匀浆MDA含量显著升高,SOD水平明显下降,经芦丁干预后,检测指标恢复到正常水平。GSH-Px主要通过催化H2O2及其他脂类氢过氧化物分解为GSH和水来减少氢过氧化物含量,保护脑细胞免受氧化损伤,维持细胞正常形态[14],因此在高脂组中GSH-Px水平增加。高糖组GSH-Px活性水平降低,则可能与小鼠的氧化应激适应性有关[15]。组织切片分析也发现,高脂组和高糖组尼氏体显著减少,神经细胞中蛋白质合成和包装的功能可能受到影响,其合成相关抗氧化酶类功能也相应减弱。
现有研究认为,在持续高脂高糖条件下,脑组织的线粒体功能障碍[16],其结果是过多的氧自由基在脑组织逐渐积累,由于细胞中的核酸、蛋白质等分子结构被破坏,进而引起神经细胞功能损伤甚至死亡[17],造成神经元病理改变[18],这与本研究的脑组织染色结果相同。Rubiolo等[19]研究发现,维持机体氧化还原动态平衡需要自由基参与,抗氧化酶与自由基相互作用,使自由基毒性减少,水溶性增加,从而促进自由基清除。当抗氧化酶类受到氧化应激损伤时,需要外源化学物质改善氧化水平,芦丁保护组的保护作用可能是芦丁通过将氢原子推向超氧阴离子自由基、过氧自由基和羟基来清除脑内的氧自由基,以减轻脑内氧化应激水平[20]。同时,通过对小鼠行为变化观察发现,高脂组和高糖组小鼠出现了行动迟缓,嗜睡现象,这可能是因脂质过氧化损伤,逐渐受损的大脑皮层功能区导致正常认知修复功能减退[21]。
本研究的不足之处在于本实验没有对小鼠摄食量进行精确的统计与记录,不能完全排除rutin影响摄食量从而对体质量及氧化产物等产生影响的可能性。这是我们实验设计之初没有考虑到的地方,也使整个实验存在一定的不严谨之处。我们会在后续实验中完善这方面的设计,使得实验更加严谨,结果更加可靠。
综上所述,芦丁在小鼠大脑氧化损伤中所起到的显著保护作用,很可能归因于其上调了抗氧化酶类表达,在一定程度上减轻了脑组织神经细胞氧化应激损伤,为芦丁在高脂高糖饮食诱导的小鼠脑内氧化应激损伤的保护作用提供实验基础。因此,芦丁对大脑氧化应激损伤的治疗潜能及具体机制,还需要更多的实验研究证据支持,尤其是临床研究。
