TRIM22在神经胶质瘤中致癌作用的机制研究
2021-06-18刘华锋
刘华锋,王 超*,张 伟,张 明,夏 毅
(1空军军医大学唐都医院神经外科,西安 710038;2陕西省康复医院病理科;*通讯作者,E-mail:hzchenjin1971@163.com)
神经胶质瘤是中枢神经系统肿瘤中的一种高异质性肿瘤,起源于脑内胶质细胞[1]。大多数神经胶质瘤,即弥漫性神经胶质瘤,在中枢神经系统实质中显示出广泛的浸润;约占所有恶性脑肿瘤中的80%[2]。弥漫性神经胶质瘤根据世界卫生组织(WHO)进一步分为Ⅱ级(低级)、Ⅲ级(间变性)或Ⅳ级(胶质母细胞瘤)的星形胶质细胞,少突胶质细胞或罕见的混合少突胶质细胞-星形胶质细胞[3]。目前治疗胶质瘤的方法多样,一般都是结合手术加放疗或化疗的综合治疗方案。然而胶质瘤的复发率高,虽然可通过磁共振成像进行检测,但它只能在宏观水平上显示肿瘤,所以仍需要探索一种新的治疗胶质瘤的方法。
含3个motif基序(tripartite motif,TRIM)家族有70多个成员;它们的共同结构特征是保守的RING指、B-box和卷曲螺旋结构域[4]。据文献报道,TRIM蛋白对细胞增殖、分化和凋亡、调节其他基因的转录以及参与蛋白质的泛素化有很大作用[5]。TRIM家族的TRIM31是TRIM家族的一员,是E3泛素蛋白连接酶,最初被鉴定为由生长抑制性类维生素A诱导的基因[6]。据文献报道,TRIM在肿瘤进展中起作用,例如促进结直肠癌、胆囊癌和肝细胞癌的生长,同时可以抑制非小细胞肺癌的癌变[6,7]。然而,目前对TRIM在神经胶质瘤发展中的分子机制研究较少,本研究旨在探讨TRIM22在胶质瘤中的表达模式及其功能。
1 材料和方法
1.1 材料和组织样本
本实验所用细胞系HEB、A172、U251和U87均购自美国ATCC菌株保存库;DMEM培养基、Trizol试剂盒、cDNA逆转录试剂盒、SYBR®Green PCR Master Mix试剂盒、BCA蛋白分析试剂盒、化学增光剂和细胞计数试剂盒-8购于Thermo fisher公司(美国);RIPA裂解缓冲液购于Invitgen公司(美国);一抗和二抗购于Sigma(美国)、Thermo fisher(美国)和Abcam公司(英国);TRIM22的shRNA序列由上海生工生物有限公司(中国)合成;嘌呤霉素购于Sigma公司(美国);Transwell板购于Corning公司(美国)。
本研究收集了2018年5月至2020年3月在唐都医院接受手术治疗的30例胶质瘤患者的胶质瘤组织以及胶质瘤旁正常组织,患者的平均年龄为44.35±2.67岁。本研究严格按照美国国立卫生研究院(NIH)出版物“实验标本组织提取使用指南”[8]进行,并经本院伦理委员会批准(No.2018-3-16-SW0181),所有患者均被告知并签署了知情同意书。
1.2 细胞培养和qRT-PCR分析
正常小胶质细胞系HEB和胶质瘤细胞系A172、U251、U87均在含10%胎牛血清和1%青霉素/链霉素的Dulbecco改良Eagle培养基(DMEM)中培养,其培养环境为37 ℃、5% CO2;根据细胞培养特性,每2-3 d更换1次培养基。


表1 qRT-PCR分析序所需引物序列
1.3 Western blotting分析TRIM22、E-cadherin、Vimentin、cyclin D1和cMyc蛋白表达水平
使用RIPA裂解缓冲液提取胶质瘤组织样本和细胞中的总蛋白;采用BCA蛋白分析试剂盒测定提取总蛋白的浓度。将蛋白质与2×上样缓冲液混合,于沸水浴10 min后制成上样样品;使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白(上样量大约为25 μg),然后转膜至PMDF膜上。随后,在室温下用5%脱脂牛奶封闭PMDF膜1 h。将膜与抗TRIM22(1 ∶2 000)、E-钙粘连蛋白(E-cadherin,1 ∶2 000)、波形蛋白(Vimentin,1 ∶2 000)、细胞周期蛋白D1(cyclin D1,1 ∶2 000)、cMyc(1 ∶2 000)或β-肌动蛋白(β-actin,1 ∶500)的一抗在4 ℃下孵育过夜,然后将膜先利用TBST洗膜3次,每次10 min;再将膜与各自的辣根过氧化物酶(HPR)偶联的二抗(1 ∶2 000)于室温孵育2 h。最后通过使用化学增光剂(ECL)及检测软件(Bio-Rad公司)分析条带强度。
1.4 sh-TRIM22转染及分组
通过将PCR扩增的全长TRIM22 cDNA克隆到pMSCV逆转录病毒载体中,构建TRIM22的过表达质粒。sh-TRIM22的序列:5′-UAAGCUGGCCUCUUGACUAUC-3′;对照shRNA的序列:5′-CCCCUUUUAAAAAAAGGGGCCCGG-3′。将pMSCV-TRIM22质粒和sh-TRIM22或对照shRNA共转染U87细胞;其转染方法采用Lipofectamine 2000进行细胞瞬时转染实验。根据以上实验需求,为验证敲除TRIM22基因后,对U87细胞的增殖、迁移和侵袭的影响,将实验分为3组:Con-shRNA组、shRNA-TRIM22组和shRNA-TRIM22+LiCl组。Con-shRNA组细胞共转染pMSCV-TRIM22质粒和对照shRNA,shRNA-TRIM22组细胞共转染pMSCV-TRIM22质粒和sh-TRIM22,shRNA-TRIM22+LiCl组细胞共转染10 μmol/L LiCl+pMSCV-TRIM22质粒和sh-TRIM22(作为激活剂组)。
1.5 细胞增殖实验
根据使用说明书,利用细胞计数试剂盒-8(CCK-8)法检测细胞增殖。将U87细胞接种于96孔板中,当细胞密度为1×104个/孔时,分别于0,12,24,36,48,72 h加入10 ml CCK-8溶液,37 ℃孵育1 h后,使用Thermo酶标仪在450 nm波长处测定吸光度。
1.6 细胞迁移和侵袭分析
使用孔径为8 mm的Transwell板进行Transwell试验,并检测细胞侵袭和迁移能力。将每毫升含1×105个U87细胞浓度的DMEM培养基(不含FBS,大约为100 μl)加入Transwell板上室,包被基质(用于侵袭实验)或不包被基质(用于迁移实验)。下室加入含10% FBS的DMEM培养基。在孵育24 h后,去除顶部(未迁移)细胞,用4%甲醇处理20 min,再用0.1%结晶紫染色15 min。最后在显微镜(Nikon)下随机选择5个区域,并进行细胞计数,计算平均细胞数量。
1.7 统计学分析
2 结果
2.1 TRIM22在胶质瘤患者组织样本和细胞系中高表达
与胶质瘤旁正常组织相比,胶质瘤患者组织样本中TRIM22的mRNA和蛋白表达水平均显著升高(P<0.01)。与正常小胶质细胞系HEB细胞相比,胶质瘤细胞系A172、U251和U87中TRIM22的mRNA和蛋白表达水平显著升高(均P<0.01,见图1),其中U87细胞系差异性最为显著,后续实验选择U87细胞系为研究对象。

与胶质瘤旁正常组织相比,*P<0.05;与正常小胶质细胞系HEB细胞相比,*P<0.05,**P<0.01图1 TRIM22在胶质瘤患者组织样本和细胞系的表达情况Figure 1 Expression of TRIM22 in glioma tissues and cell lines
2.2 沉默TRIM22抑制胶质瘤细胞增殖
qRT-PCR和Western blotting结果表明,与Con-shRNA组相比,shRNA-TRIM22组U87细胞中TRIM22的mRNA和蛋白表达水平均显著降低(P<0.01)。CCK-8比色法检测细胞增殖结果表明,与Con-shRNA组相比,shRNA-TRIM22组U87细胞的增殖显著降低(P<0.05,见图2)。

A.RT-PCR检测TRIM22在U87细胞中的表达 B.Western blotting检测TRIM22在U87细胞中的表达 C.CCK-8比色法测定U87细胞增殖情况1.Con-shRNA;2.shRNA-TRIM22;与Con-shRNA组相比,*P<0.05,**P<0.01图2 沉默TRIM22抑制U87细胞增殖Figure 2 Silencing of TRIM22 inhibits the proliferation of U87 cells
2.3 沉默TRIM22抑制胶质瘤细胞的迁移和侵袭
与Con-shRNA组相比,shRNA-TRIM22组U87细胞迁移和侵袭能力显著降低(P<0.01,见图3)。这表明,沉默TRIM22可显著抑制U87细胞的迁移和侵袭。
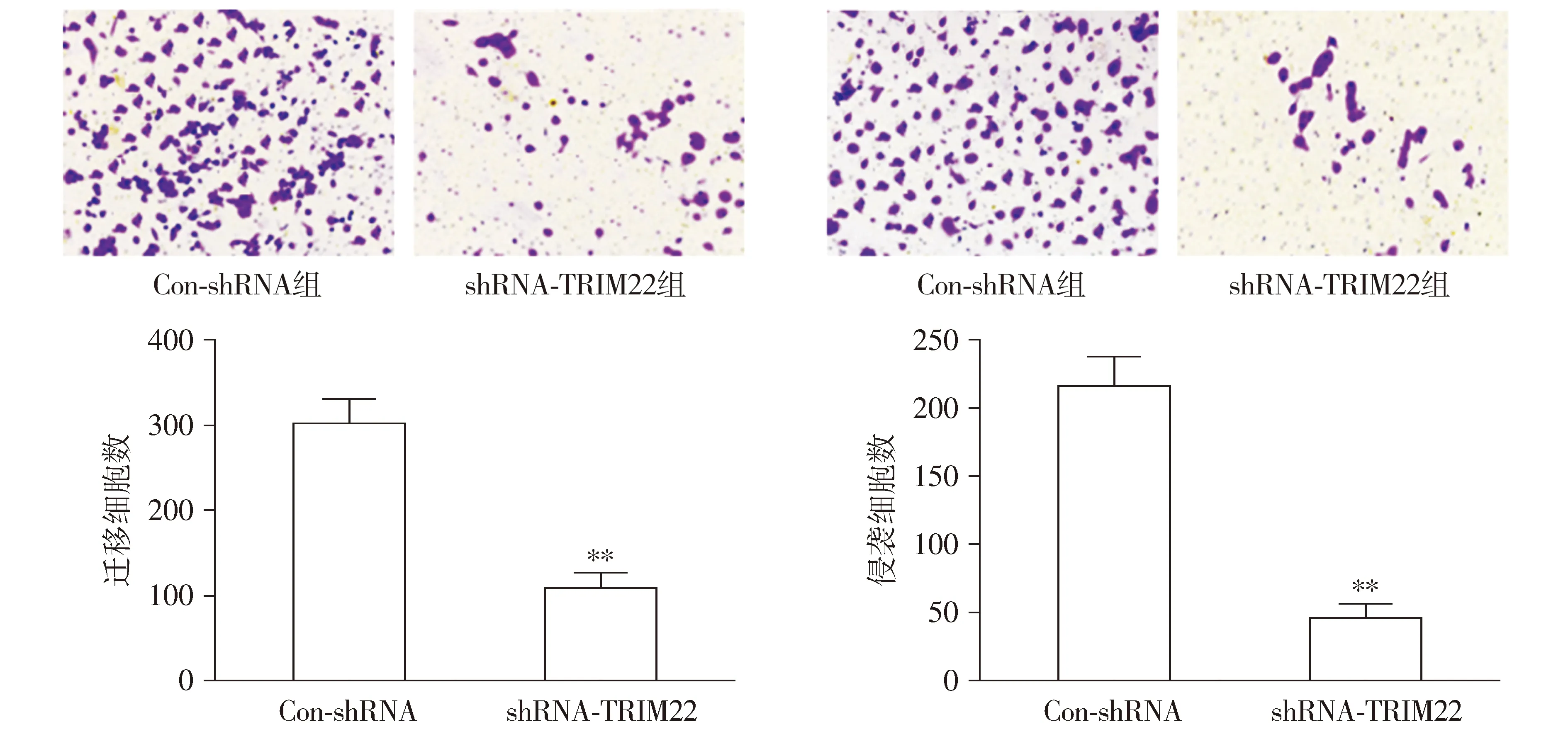
A.Transwell法检测U87细胞的迁移 (×100) B.Transwell法检测U87细胞的侵袭 (×100)与Con-shRNA组相比,**P<0.01图3 沉默TRIM22可抑制U87细胞的迁移和侵袭Figure 3 Silencing of TRIM22 inhibits migration and invasion of U87 cells
2.4 沉默TRIM22抑制胶质瘤细胞上皮-间充质转化(EMT)过程
与Con-shRNA组相比,shRNA-TRIM22组U87细胞的EMT过程标志蛋白E-cadherin的表达水平显著升高,Vimentin蛋白表达水平显著降低(P<0.01,见图4)。

与Con-shRNA组相比,**P<0.01图4 沉默TRIM22抑制了U87细胞中的EMT过程Figure 4 Silencing of TRIM22 inhibits EMT in U87 cells
2.5 沉默TRIM22抑制胶质瘤细胞Wnt/β-catenin通路的激活
Western blotting结果表明,与Con-shRNA组相比,shRNA-TRIM22组U87细胞中cyclinD1和c-Myc蛋白的表达水平显著降低(P<0.01);与shRNA-TRIM22组相比,shRNA-TRIM22+LiCl组U87细胞中cyclinD1和c-Myc蛋白的表达水平显著提高(P<0.01,见图5)。与Con-shRNA组相比,shRNA-TRIM22组U87细胞的增殖、迁移和侵袭受到显著抑制;与shRNA-TRIM22组相比,shRNA-TRIM22+LiCl组U87细胞的增殖、迁移和侵袭能力均显著升高(P<0.01,见图6)。
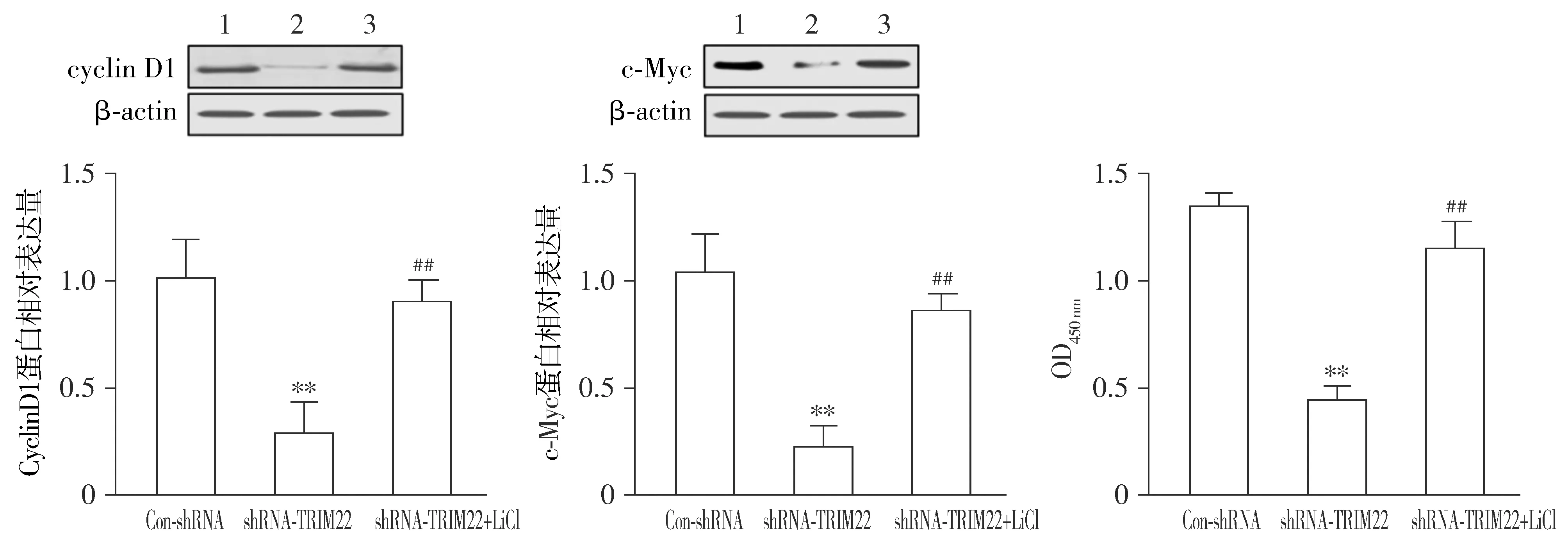
1.Con-shRNA;2.shRNA-TRIM22;3.shRNA-TRIM22+LiCl;与Con-shRNA组相比,**P<0.01;与shRNA-TRIM22组相比,##P<0.01图5 沉默TRIM22可抑制U87细胞Wnt/β-catenin通路的激活Figure 5 Silencing of TRIM22 inhibits the activation of Wnt/β-catenin pathway in U87 cells
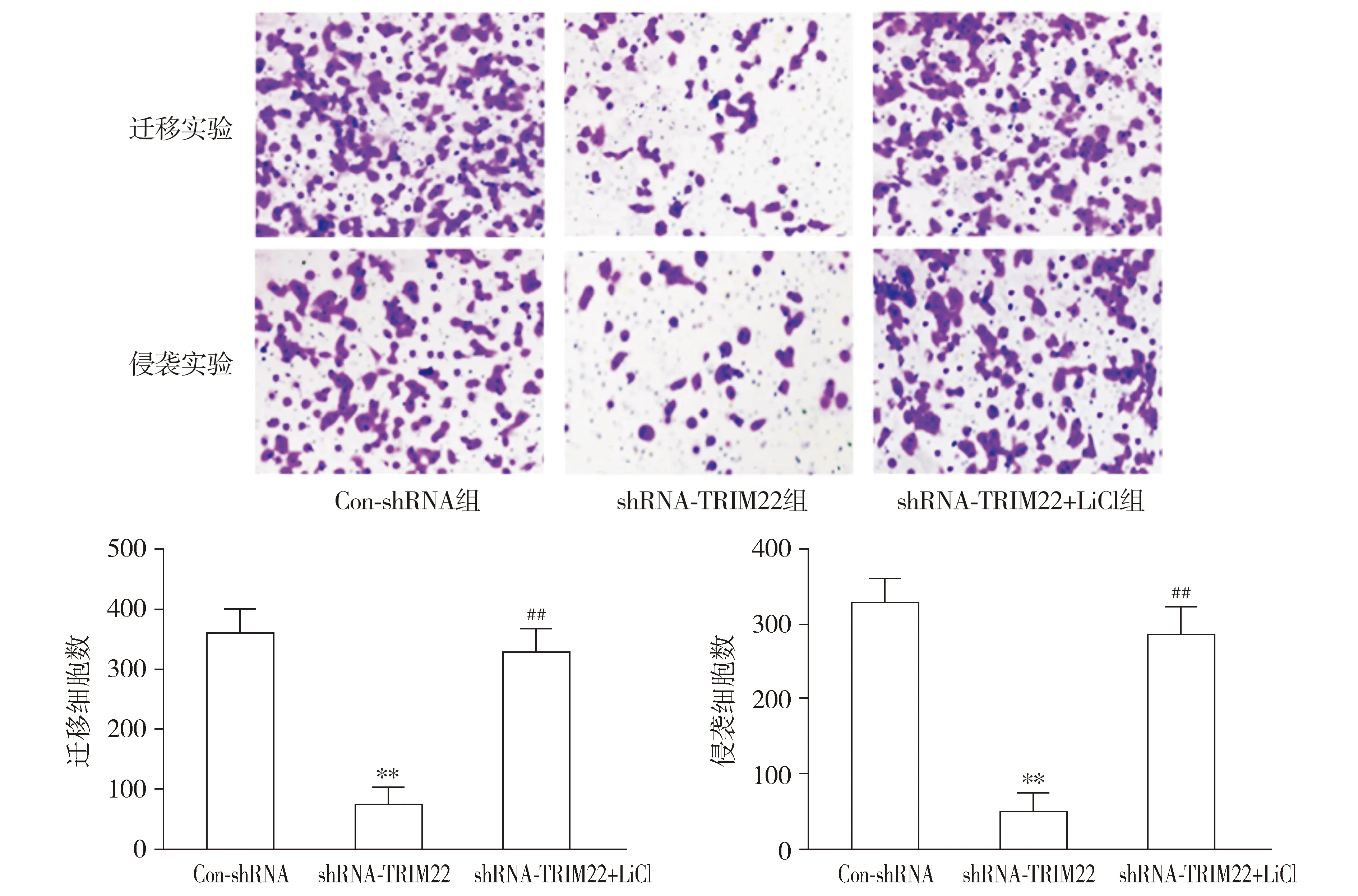
与Con-shRNA组相比,**P<0.01;与shRNA-TRIM22组相比,##P<0.01图6 沉默TRIM22对U87细胞迁移和侵袭的影响 (×100)Figure 6 The effect of silencing TRIM22 on the migration and invasion of U87 cells (×100)
3 讨论
尽管目前有多种形式的疗法,包括安全手术切除、放疗和替莫唑胺化学疗法,但对于多形胶质母细胞瘤(glioblastoma multiforme,GBM)的临床治疗仍然收效甚微[9]。GBM患者的预后仍然很差,迫切需要寻找新的治疗方法以取得更好的治疗效果。文献报道,TRIM家族是重要的癌变调节剂,它们参与了许多细胞的生物学行为,同时TRIM蛋白因具有E3泛素连接酶活性而受到广泛关注[10,11]。
TRIM24,又称转录中介因子1,在头颈部鳞状细胞癌和人宫颈癌中过表[12];TRIM27可促进结直肠癌和卵巢癌的发展[13]。TRIM蛋白参与维持细胞内部和外部环境所需的某些机制;但当它们的基因改变时,TRIM蛋白具有致癌潜力[10]。此外,一些TRIM蛋白通过调节p53在肿瘤的发生和发展中具有双重作用[7]。因此,对TRIM蛋白的机制和参与肿瘤发生的进一步研究可能为癌症治疗提供有效的靶标。在这项研究中,我们发现TRIM22作为癌基因在高级别神经胶质瘤中过表达。
TRIM22是一种干扰素诱导蛋白,TRIM22最初被鉴定为一种干扰素诱导基因,并且还发现是TP53的转录靶基因[14]。TRIM22在大多数非小细胞肺癌组织中上调,并且与淋巴结转移和TNM分期密切相关,TRIM22的过表达可能促进NSCLC的增殖和侵袭,提示了TRIM22作为癌基因的功能[15]。TRIM22抑制软琼脂中白血病U-937细胞的克隆生长,这表明TRIM22可能在白血病细胞增殖中发挥作用,并且TRIM22的水平升高与早幼粒细胞白血病细胞的诱导分化有关[16]。然而,仍有文献报道,沉默TRIM22基因后,它可以抑制细胞的增殖,诱导细胞周期阻滞并导致细胞凋亡[17]。这些结果提示TRIM22在癌症中可能具有双重作用。
TRIM22的这种双重作用可能归因于器官特异性的作用和不同的细胞环境[18]。本研究表明TRIM22在胶质瘤组织和细胞系中表达上调。TRIM22基因被敲除后抑制了U87细胞的增殖、迁移和侵袭。本研究的结果提示TRIM22在胶质瘤中可能是一个癌基因。因此,如果将TRIM22抑制剂作为胶质瘤治疗药物将具有重要意义。
在典型的Wnt信号通路途径中,可通过Wnt蛋白与表面受体的结合而激活,从而抑制β-catenin的磷酸化和降解并调控c-Myc和cyclin D1等靶基因的转录[19]。Wnt信号转导级联是整个动物界发育的主要调节因子,Wnt也是成年哺乳动物中大多数类型的组织干细胞的关键驱动因素;对细胞的增殖、凋亡和侵袭等方面均有影响[20]。因此,抑制Wnt/β-catenin通路的激活可能成为胶质瘤治疗的一种新的治疗办法。本研究的结果表明,沉默TRIM22抑制了Wnt/β-catenin通路相关蛋白的激活。此外,LiCl处理可减弱TRIM22对U87细胞的作用。
综上所述,本研究的结果表明,TRIM22在胶质瘤组织和细胞系中表达显著上调;体外研究表明,TRIM22基因敲除抑制了U87细胞的增殖、迁移和侵袭。此外,TRIM22还通过调节Wnt/β-catenin途径发挥作用;这提示TRIM22在胶质瘤中可能是一个潜在的致癌基因。
