急性冷应激对断奶仔猪全血中HSP70/TLR4/NF-κB通路的影响
2021-06-17袁建彬柳巨雄杨焕民
陈 妍,徐 彬,刘 鹏,袁建彬,连 帅,计 红,柳巨雄,杨焕民*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.吉林大学 动物医学学院,吉林 长春 130062)
断奶仔猪(30日龄)消化系统尚未发育完全,由依靠母乳生长转变为采食饲料生长,很容易损害消化器官,造成营养不良。其次仔猪从育仔舍转到常规舍,湿度、温度、光照、气体、噪音等环境因素发生改变[1]。这些外源性应激源都会对仔猪免疫系统和生理稳态造成破坏。冷应激是我国寒冷地区危害极大的一种应激性致病因素,冷应激会使动物机体对外源性和内源性致病因子的抵抗力下降,极易感染疾病,严重情况下会影响动物存活,导致畜牧业经济损失。
热休克蛋白70(HSP70)在正常情况下稳定表达于动物细胞中,在温度冲击或其他应激刺激下,大量合成,可保护机体免受细胞内蛋白变性或死亡[2]。近年有研究表明,HSP70不仅具有分子伴侣[3]和应激保护的功能,细胞表面和细胞外过度表达的HSP70有可能成为“危险信号”启动先天性免疫反应[4]。Toll样受体(TLRs)是近年来在免疫活性细胞上发现的表达丰富的病原模式识别受体[5],Toll样受体4(TLR4)是TLRs家族重要一员,可接受外源性或内源性配体的刺激,从而激活下游信号分子,同时释放一系列炎性因子而引起炎症反应。HSP70已被证明可作为TLR4内源性激活剂[6]。髓样分化因子88(MyD88)在TLR4介导的通路中发挥衔接子的作用[7],诱导一系列细胞内信号转导,启动活化核转录因子-κB(NF-κB)信号通路。NF-κB是一种控制一系列炎性因子基因表达的转录调节因子,TLR4信号中NF-κB最常激活的形式是由RelA(p65)和p50组成的异二聚体,RelA-p50异二聚体作为一种潜在的及不活跃的形式,通过与未受刺激细胞中的IkB蛋白相互作用而保存在细胞质中。无活性的p65被上游信号分子激活后,快速磷酸化并进入细胞核,负责TLR4介导的炎性因子的诱导,如肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)等[8]。鉴于HSP70/TLR4/NF-κB通路在抗细菌或病毒免疫和炎性过程中的重要作用,我们推测其可能参与了冷应激条件下断奶仔猪的免疫调节过程。本试验采用qRT-PCR方法检测冷应激不同时间后断奶仔猪全血中HSP70/TLR4/NF-κB通路关键分子的表达变化,探讨是否可以把HSP70/TLR4/NF-κB通路关键分子作为断奶仔猪遭受冷应激程度的评价指标,进而为系统揭示冷应激发生时断奶仔猪的炎症反应的发生机制及防控技术的开发奠定理论基础。
1 材料与方法
1.1 实验动物选取体况相近健康断奶仔猪(30日龄)16头,在人工气候室适应性喂养7 d后,随机分为4组:常温对照组、冷应激2,6,12 h组,每组4头。冷应激温度选取为(4±2)℃,正常饲养温度选取为(24±2)℃,相对湿度均为40%~50%。预饲后1 d,22:00将冷应激12 h组仔猪放入人工冷应激气候室,进行冷应激。2 d,6:00 将冷应激6 h组仔猪放入冷应激人工气候室,进行冷应激;12:00将冷应激2 h组仔猪放入冷应激人工气候室,进行冷应激。分别在第2天8:00、10:00、12:00、14:00采集常温对照组、冷应激12,6,2 h组断奶仔猪的全血样品,-80℃保存。
1.2 引物设计和合成应用NCBI网站(http://www.ncbi.nlm.nih.gov/)对猪HSP70、MyD88、TLR4、p65、IL-6、白介素-10(IL-10)的mRNA序列进行查询,由生工生物工程(上海)股份有限公司进行引物设计和合成,引物序列见表1。

表1 引物信息
1.3 全血中总RNA提取从-80℃超低温冰箱中取出0.5 mL全血溶化后,加入1.5 mL红细胞裂解液,轻轻吹打混匀,裂解1~2 min;4℃、12 000 r/min离心5 min,吸取上层水相转移到新的RNAfree EP管中,加入0.2 mL氯仿,吹打混匀后,室温静置15 min;4℃、12 000 r/min离心15 min,将上层水相吸取转移到新的RNAfree EP管中,在冰上进行所有操作。向EP管中加入0.5 mL异丙醇,充分混匀,放置10 min后,4℃、12 000 r/min离心10 min;弃上层水相,加入1 mL 75%乙醇,充分吹打沉淀,4℃、7 500 r/min离心5 min;弃上层水相,使EP管内液体除尽,加入20 μL DEPC处理水吹吸沉淀。取1 μL RNA样品,直接滴加在核酸蛋白测定仪上测定其浓度和D值。
1.4 cDNA的合成以全血中提取的总RNA作为模板,反转录过程应用Roche反转录试剂盒进行,试验步骤:首先按照表2的试剂顺序加入试剂,65℃加热200 μL EP管10 min使模板-引物混合物变性,确保RNA二级结构变性,然后立即将EP管置于冰上冷却。再按照表3的试剂顺序加入试剂,25℃ 10 min,之后55℃ 30 min,再加热至85℃维持5 min 使逆转录酶失活,将EP管立即置于冰上冷却以停止反应。

表2 模板-引物结合反应体系
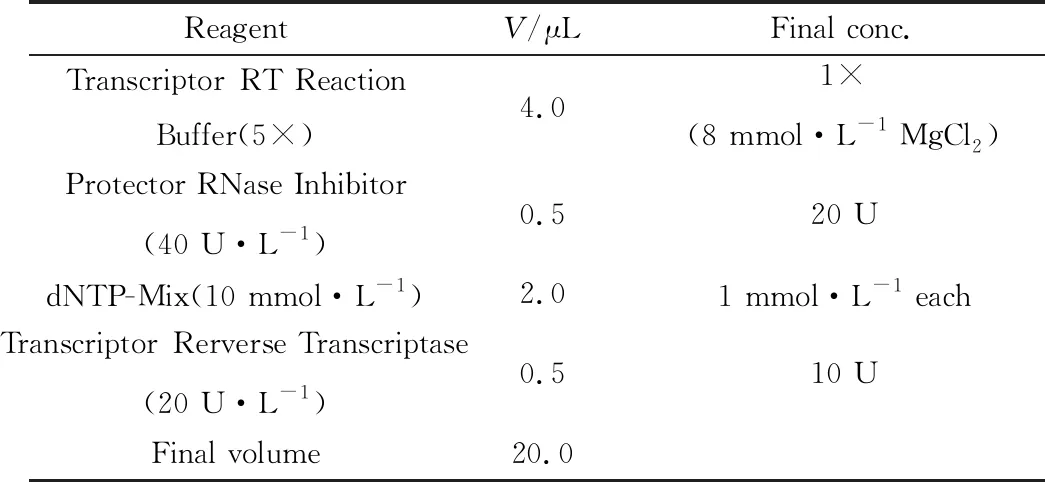
表3 反转录反应体系
1.5 qRT-PCR采用qRT-PCR技术检测断奶仔猪全血HSP70/TLR4/NF-κB通路关键分子水平的表达。应用Bio-Rad CFX96型荧光定量PCR仪进行检测,具体按照用户操作手册在冰上避光进行。反应试剂:SYBR Premix Ex Taq Ⅱ 12.5 μL、RT reaction solution(cDNA) 2.0 μL、PCR Reverse Primer 1.0 μL、PCR Forward Primer 1.0 μL、dH2O 8.5 μL。循环参数:95℃ 35 s,60℃ 30 s,共39个循环。然后继续在65~95℃的温度区间内进行建立熔解曲线的反应,以0.5℃为循环梯度,每个循环5 s,共60个循环。将cDNA作为未知样本,以GAPDH作为内参,每管设置3个重复,反应结束后得出每个样本的Cq值,计算出相应的2-ΔΔCq值,用校正后的值判定相对表达量的差异。

2 结果
2.1 断奶仔猪全血中HSP70水平变化采用qRT-PCR方法检测断奶仔猪全血中HSP70水平,如图1所示,与常温对照组相比,急性冷应激后各时间点断奶仔猪全血中HSP70水平均升高,整体呈现先升高后降低的趋势,其中冷应激2,6 h组极显著高于常温对照组(P<0.01),冷应激6 h组达到峰值,冷应激12 h组与常温对照组相比无显著性变化。
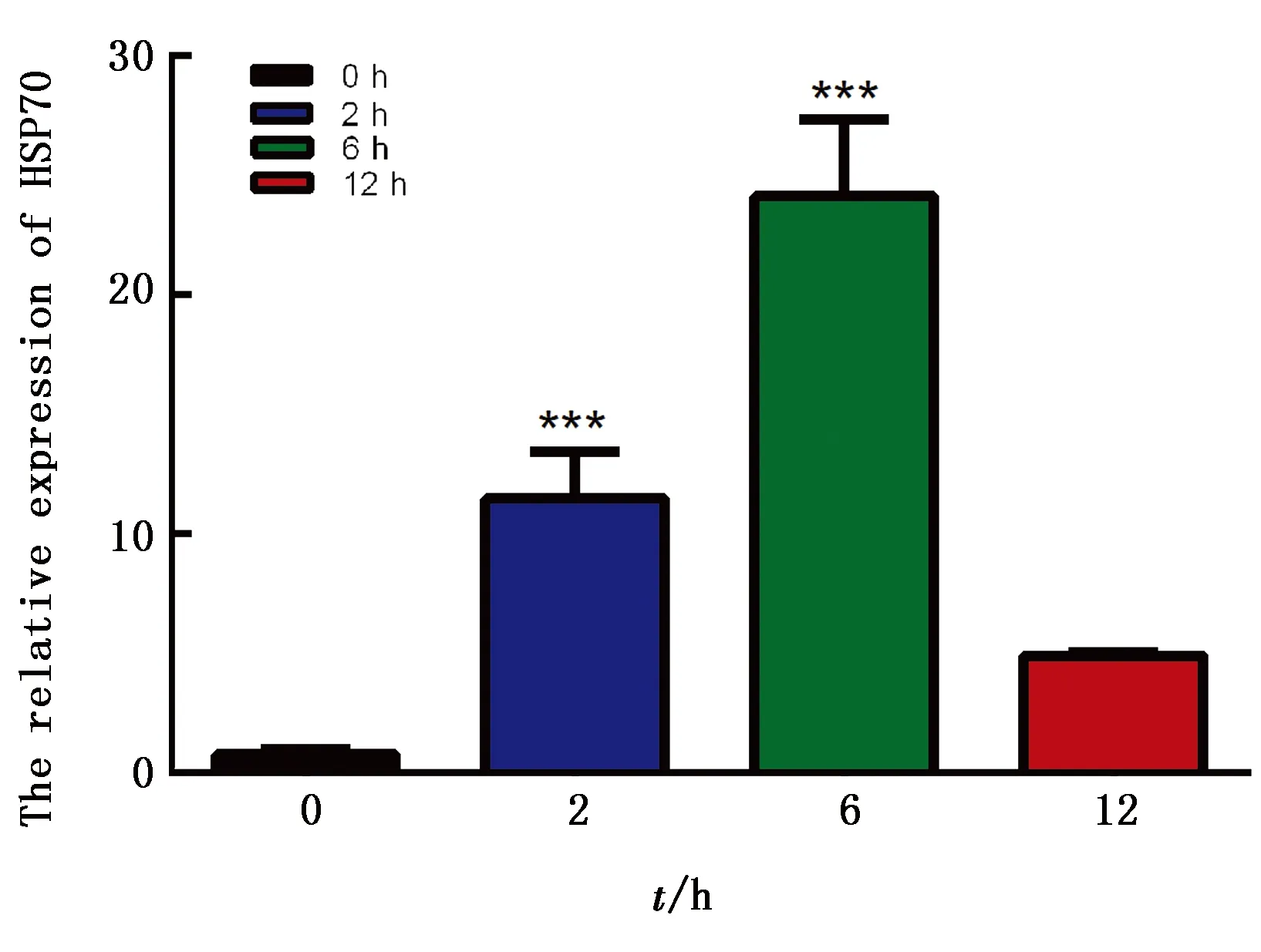
*表示与常温对照组相比差异显著(P<0.05),***表示与常温对照组相比差异极显著(P<0.01)。下同
2.2 断奶仔猪全血中TLR4水平变化采用qRT-PCR方法检测断奶仔猪全血中TLR4水平,结果如图2所示,与常温对照组相比,急性冷应激后各时间点仔猪全血中TLR4水平均升高,整体呈现先升高后降低的趋势,冷应激2 h组显著高于常温对照组(P<0.05),冷应激6 h组极显著高于常温对照组(P<0.01),冷应激6 h组达到峰值,冷应激12 h组与常温对照组相比无显著性变化。
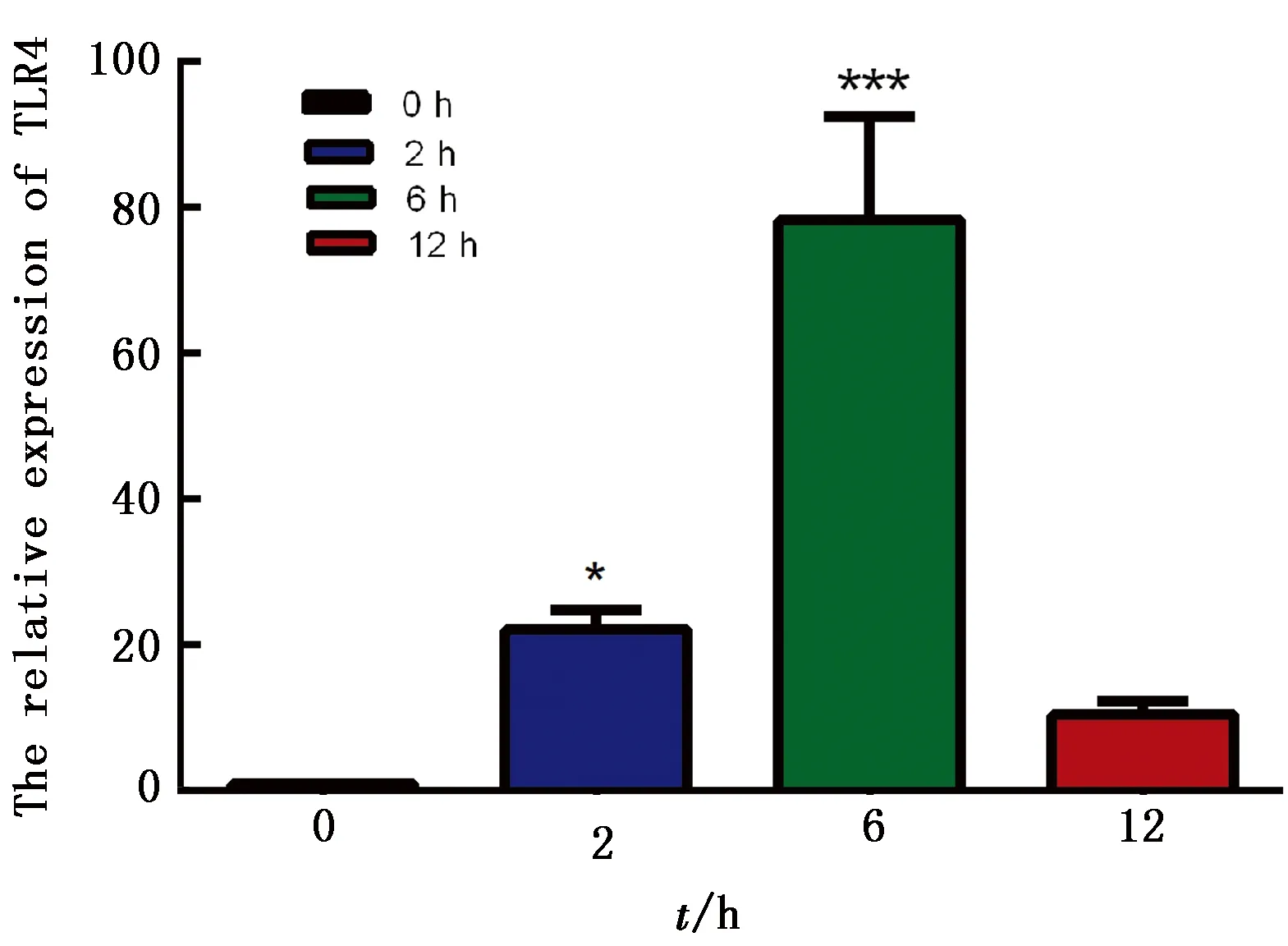
图2 急性冷应激后断奶仔猪全血中TLR4水平变化
2.3 断奶仔猪全血中MyD88和p65水平变化采用qRT-PCR方法检测TLR4信号通路下游关键信号分子MyD88和p65在仔猪全血中的水平变化,结果如图3所示,与常温对照组相比,急性冷应激后各时间点仔猪全血中MyD88和p65的水平均呈现先降低后升高的趋势,MyD88和p65的水平在冷应激2,6 h组极显著低于常温对照组(P<0.01),而冷应激12 h组极显著高于常温对照组(P<0.01)。

图3 急性冷应激后断奶仔猪全血中MyD88和p65水平变化
2.4 断奶仔猪全血中炎性因子水平变化采用qRT-PCR方法检测断奶仔猪全血中促炎因子TNF-α和IL-6和抗炎因子IL-10水平变化,结果如图4所示,与常温对照组相比,急性冷应激后促炎因子TNF-α和IL-6的水平均呈现先升高后降低的趋势,且都在冷应激后6 h呈现暴发式增长,其中IL-6在冷应激2 h组显著高于对照组(P<0.05),TNF-α在冷应激2,12 h组以及IL-6在冷应激12 h组与常温对照组相比无明显变化。抗炎因子IL-10的水平呈现先降低后升高的趋势,在冷应激6 h组极显著降低(P<0.01),在冷应激12 h组略升高,但仍显著低于常温对照组(P<0.01)。

A.TNF-α水平变化;B.IL-6水平变化;C.IL-10水平变化
3 讨论
冷应激是寒冷地区最普遍存在的应激源,先天性免疫的激活和炎症因子的级联效应是应对冷应激的重要机制之一[9-11]。冷应激的主要特点之一就是高度诱导合成热休克蛋白(HSPs)。HSPs是指在机体遭受冷应激及其他一些环境应激,如湿热环境、电磁辐射、有毒气体、噪音等有害刺激后,快速合成,并在不利环境下积极发挥对机体和细胞起保护作用的一类具有高度保守性的蛋白质[12]。HSP70是约为70 kDa的热休克蛋白,是HSPs家族中标志性成员[13]。BHARATI等[14]研究表明,HSP70可能参与了塔卡帕克牛的热应激适应性反应,其典型的双相表达模式有助于保护动物免受热应激,可作为塔帕卡牛慢性热应激的重要生物标记。本试验中,在冷应激2,6 h时,HSP70的水平显著升高,说明机体对冷应激的响应增强,有利于机体自身及时启动保护程序来抵抗冷应激。随着应激时间的增加,HSP70水平开始下降,在冷应激12 h时,HSP70水平与常温对照组相比无明显变化。推测随着冷应激时间增加,HSP70已无法抵抗冷应激来保护机体。
先天性免疫是宿主抵抗感染和恶性转化的最初防线,对适应性免疫的建立具有深远的影响。TLRs是机体内检测多种微生物成分并激发先天性免疫反应的主要传感器[15]。近年来研究表明,HSP70承担着分子伴侣和保护机体免受应激损害的功能,当HSP70高度表达时,可作为TLR4的内源性配体[16]。ZHANG等[17]发现高氧后野生型小鼠肺和肺内皮细胞(MLEC)内所分泌的HSP70水平明显升高,随后证实HSP70和TLR4在肺组织和MLEC中免疫共沉淀,HSP70的细胞保护功能取决于TLR4。本试验检测了不同冷应激时间下TLR4的水平,发现TLR4与HSP70有相同的变化趋势,即在冷应激6 h组显著升高,在冷应激12 h组显著降低,进一步证明TLR4被HSP70所激活。
TLR4识别病原体相关分子模式(PAMPs)后,通过其Toll/IL-1受体(TIR)结构域的亲和力相互作用招募一组具有TIR结构域的衔接蛋白MyD88,这种信号级联反应引起NF-κB的激活,导致随后激活炎症因子的基因被激活,例如TNF-α、IL-1β、IL-6、IL-8、IL-12和趋化因子等[18]。一项研究表明,颅脑损伤后,姜黄素可通过激活小胶质细胞/巨噬细胞中TLR4/MyD88/NF-κB信号通路的机制来减少小胶质细胞/巨噬细胞的急性激活和神经元凋亡,从而改善患者的预后[19]。本试验中,在冷应激6 h时,MyD88和NF-κB p65水平显著降低,促炎因子TNF-α、IL-6极显著升高,抗炎因子IL-10极显著降低,这一结果表明,在冷应激条件下,TLR4响应HSP70的过度表达被迅速激活,随后下游的信号传递分子MyD88迅速增加进行信号转导,最终导致核转录因子NF-κB被激活,促炎因子的产生和释放以及抗炎因子的抑制。而随着冷应激时间的增加,在冷应激12 h时,MyD88和NF-κB p65水平显著升高,促炎细胞因子TNF-α、IL-6显著降低,抗炎因子IL-10显著升高,表明此时仔猪机体免疫系统已遭到破坏不足以抵抗冷应激。
综上所述,急性冷应激会导致断奶仔猪全血中HSP70/TLR4/NF-κB通路被激活,引起免疫反应,而随着冷应激时间的增加,免疫功能会下降。可以考虑把HSP70/TLR4/NF-κB通路关键分子作为评价断奶仔猪遭受冷应激程度的客观指标,将有助于解决寒冷地区幼畜抗感染能力差、易患病等现实问题。
