黑枸杞花青素对LPS诱导的Raw264.7细胞炎症的影响
2021-06-17薛才华王梦杰刘嘉华张龙飞张家玮拉忠花柴沙陀
薛才华,武 强,王梦杰,刘嘉华,张龙飞,张家玮,拉忠花,吴 华*,柴沙陀
(1.青海大学 农牧学院,青海 西宁 810016;2.青海大学 畜牧兽医科学院, 青海 西宁 810000)
炎症是指机体受到外界刺激后,通过利用系统本身的活体组织对外界致炎因子产生的一种防御作用。巨噬细胞作为免疫系统的重要组成成分,它参与机体的两种免疫:特异性免疫与非特异性免疫,在炎症反应及疾病的发生发展过程中发挥着重要作用[1]。在体外试验中,常以脂多糖(LPS)诱导小鼠Raw264.7巨噬细胞作为炎症细胞模型。LPS是革兰阴性菌外膜的主要成分[2]。常用其建立炎症模型,它具有很强的致炎活性,当LPS在机体内进行大量繁殖或正常死亡后会诱导多种炎性因子的分泌,引起机体炎症,使机体在生理上表现出一系列临床症状[3]。因此,LPS是细菌感染导致炎症反应过程中最主要的促炎因子[4]。花青素是植物界中分布最广泛的天然色素家族 ,它是一种具有生物活性的化合物,存在于植物的叶、茎、花和果实中,具有多种药理作用[5]。 研究发现,花青素具有抗氧化、抗炎、抑菌、抗衰老等作用[6-8]。但是黑枸杞花青素在小鼠Raw264.7巨噬细胞炎症反应中的作用及其机制尚未明确。本研究以LPS诱导小鼠巨噬细胞Raw264.7作为体外炎症细胞模型,观察黑枸杞花青素对炎症状态下细胞内炎症因子含量及其mRNA水平的影响,并研究其对炎症通路TLR4/NF-κB信号通路相关因子mRNA水平的影响及其对TLR4、NF-κBp65蛋白的调控,来探讨其对巨噬细胞炎症的保护作用,为黑枸杞花青素的开发应用提供理论依据。
1 材料与方法
1.1 试验材料细胞株:小鼠巨噬细胞Raw264.7,购自中国科学院上海细胞库;黑枸杞花青素:购自青海金麦杞生物科技有限公司(花青素61%,灰分0.6%,蛋白质6%,糖1.32%,氨基酸3.56%)。
1.2 试验试剂LPS和胰蛋白酶购自索莱宝生物科技有限公司;胎牛血清购自杭州四季青生物技术有限公司;DMEM培养基和双抗购自GIBCO公司;CCK-8试剂盒购自江苏省海门碧云天生物技术研究所;ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司;SYBR Green Ⅱ荧光定量PCR试剂盒和反转录试剂盒购自天根生化科技有限公司;抗体 TLR4和NF-κBp65购自北京博奥龙免疫技术有限公司;Ant-GAPDH购自安诺伦生物科技有限公司。
1.3 试验仪器超净工作台(江苏通净净化设备有限公司);CO2恒温培养箱(MU-5810E,美国NUAIRE公司);水平离心机(V18R,英国Dynamica公司);酶标仪(Power Wave XS2 Bio TeKR,Gene Company Ltd.USA);电泳仪和荧光定量PCR仪(Bio-Rad 公司);化学发光成像仪(北京赛智科技有限公司)。
1.4 试剂配制
1.4.1花青素溶液的配制 准确称取0.01 g花青素溶于10 mL DMEM培养基中,配成1 g/L的花青素母液,-20℃保存,使用前稀释成相应浓度。
1.4.2LPS溶液配制 将1 mg LPS粉末溶解于10 mL的PBS溶液中,配制成100 mg/L的LPS母液,分装后保存于-80℃冰箱,使用前稀释成相应浓度。
1.5 细胞培养及分组小鼠巨噬细胞Raw264.7复苏后,在37℃、5%CO2条件下,用含10%胎牛血清和1%抗生素的DMEM培养基培养。待细胞长到80%左右,胰蛋白酶消化传代,取处于对数生长期的细胞用于试验。细胞分为对照组、花青素组、LPS组、花青素+LPS组。其中花青素组和花青素+LPS组中花青素浓度使用课题组前期筛选出的25 mg/L,LPS组和花青素+LPS组LPS质量浓度采用课题组前期筛选的1 mg/L。
1.6 ELISA法检测小鼠Raw264.7细胞炎性相关因子的含量细胞计数后,以每孔1×106个接种于96孔板中,按上述分组进行试验,每组设6个复孔。收集各组细胞上清液,采用酶联免疫吸附(ELISA)法检测细胞上清液IL-6、IL-10、TNF-α和INF-γ的含量,将试剂盒提前20 min从冰箱内取出,平衡至室温。按照试剂盒说明进行操作,用酶标仪测定相关因子吸光度值。
1.7 RT-PCR法检测小鼠Raw264.7细胞相关因子mRNA表达按上述分组进行试验,使用TRNzol裂解液提取细胞的总RNA,根据反转录试剂盒的操作步骤,将RNA反转录成cDNA,使用实时荧光定量试剂盒进行RT-PCR检测。如表1所示,使用上海生工设计合成的引物。

表1 引物序列
1.8 免疫印迹法检测TLR4/NF-κB通路关键节点蛋白表达按照上述分组进行试验,处理完各组细胞后,弃去上清,收集各组细胞,加入适量的蛋白裂解液(含1%PMSF),冰上反复吹打,4℃,12 000 r/min离心15 min,取上清,通过 BCA 法进行蛋白定量。制备8%分离胶,5%浓缩胶SDS-PAGE 电泳,上样量为 2 g/L。半干转移至PVDF 膜上,5% BSA 室温封闭1.5 h。TLR4,NF-κBp65一抗,4℃孵育过夜,TBST 洗膜3遍,二抗室温孵育1.5 h,再次 TBST 洗膜3遍,ECL化学发光显影拍照,凝胶成像仪检测。

2 结果
2.1 黑枸杞花青素对小鼠Raw264.7细胞炎性相关因子含量的影响ELISA法检测黑枸杞花青素对LPS作用后小鼠巨噬细胞Raw264.7培养上清液中IL-6、IL-10、TNF-α和IFN-γ含量的变化。结果如图1所示,与对照组相比,花青素处理组IL-6、IL-10的含量显著升高(P<0.05),TNF-α的含量升高,INF-γ的含量降低,差异均不显著(P>0.05),LPS处理组极显著升高IL-6、TNF-α的含量(P<0.01),IL-10和INF-γ的含量显著升高(P<0.05),花青素+LPS处理组TNF-α、INF-γ的含量升高但差异不显著(P>0.05),IL-10的含量极显著提高(P<0.01),IL-6的含量显著提高(P<0.05);与LPS处理组相比,花青素处理组IL-6、IL-10、TNF-α含量显著减少(P<0.05),INF-γ的含量极显著降低(P<0.01),花青素+LPS处理组IL-6、TNF-α和INF-γ的含量均显著降低(P<0.05),IL-10的含量显著升高(P<0.05)。
2.2 黑枸杞花青素对小鼠Raw264.7细胞炎性相关因子mRNA表达的影响结果如图2所示,与对照组相比,花青素处理组IL-6、TNF-α mRNA表达降低,IL-10、INF-γ mRNA表达提高,但差异均不显著(P>0.05),LPS处理组IL-6,TNF-α mRNA表达极显著升高(P<0.01),IL-10、INF-γ mRNA表达显著提高(P<0.05),花青素+LPS处理组显著增加IL-6、TNF-α mRNA表达(P<0.05),IL-10 mRNA表达极显著升高(P<0.01),INF-γ mRNA表达提高,但差异不显著(P>0.05);与LPS组相比,花青素处理组极显著抑制了IL-6、TNF-α mRNA表达(P<0.01),显著降低IL-10、INF-γ mRNA表达(P<0.05),花青素+LPS组IL-6、INF-γ和TNF-α mRNA表达均显著降低(P<0.05),IL-10 mRNA表达均显著升高(P<0.05)。
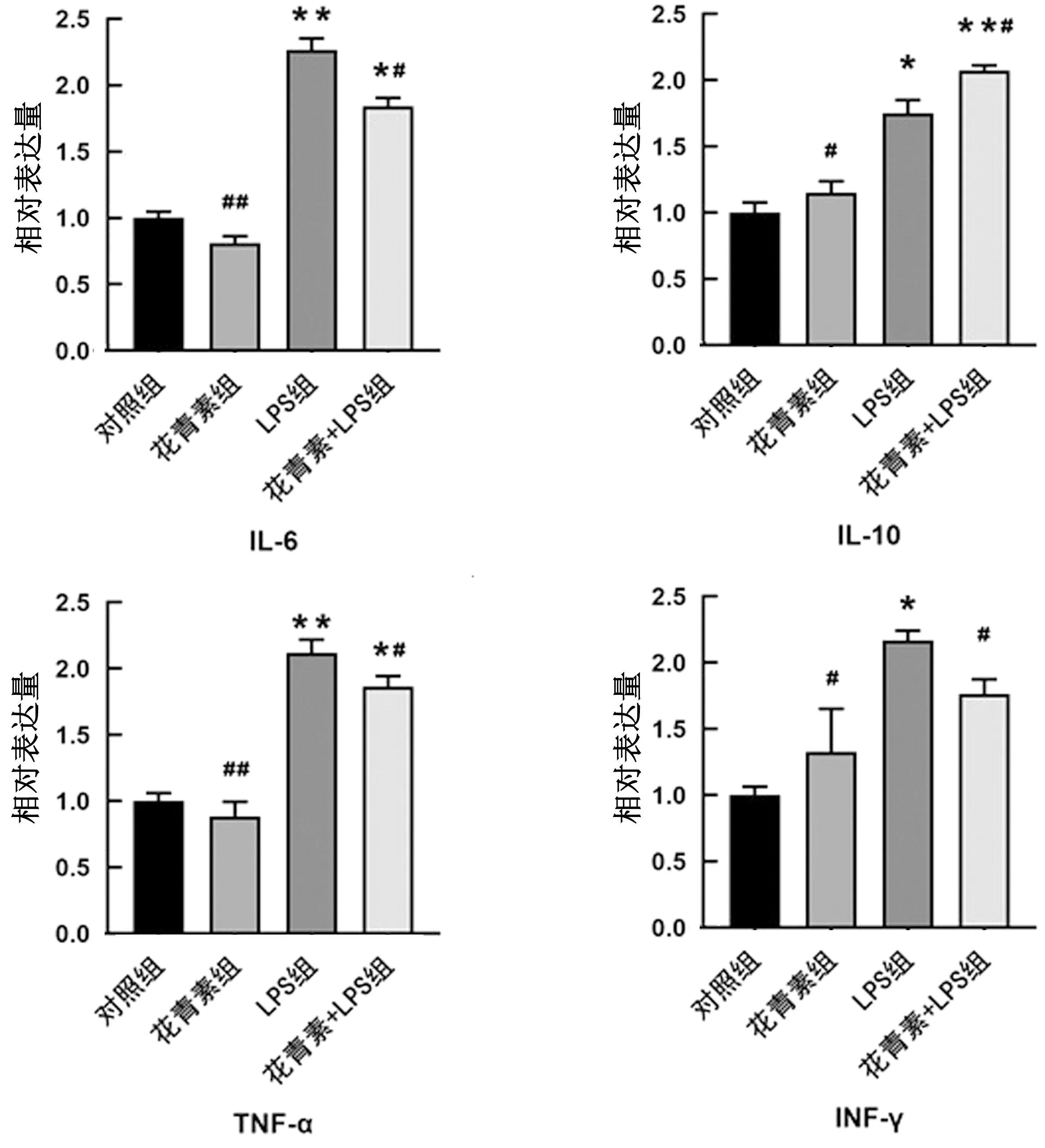
图2 黑枸杞花青素对小鼠Raw264.7细胞炎性相关因子mRNA表达的影响
2.3 黑枸杞花青素对小鼠Raw264.7细胞中TLR4/NF-κB通路关键因子mRNA表达的影响如图3所示,与对照组相比,花青素处理组降低了TLR4、NF-κB、MyD88和TRAF6的mRNA表达水平,但差异均不显著(P>0.05),LPS处理极显著提高TLR4、NF-κB和MyD88的mRNA表达水平(P<0.01),显著提高了TRAF6的mRNA表达水平(P<0.05),花青素+LPS处理TLR4、NF-κB、MyD88和TRAF6的mRNA表达水平显著提高(P<0.05);与LPS组相比,花青素处理组极显著降低了NF-κB mRNA表达水平(P<0.01),显著降低了TLR4、MyD88和TRAF6 mRNA表达水平(P<0.05),花青素+LPS处理组TLR4、NF-κB、MyD88和TRAF6的mRNA表达水平均显著降低(P<0.05)。

图3 黑枸杞花青素对小鼠Raw264.7细胞中TLR4/NF-кB通路关键因子mRNA表达的影响
2.4 黑枸杞花青素对小鼠Raw264.7细胞中TLR4/NF-кB通路相关蛋白表达的影响结果如图4所示,与对照组相比,花青素处理组极显著降低TLR4和NF-κBp65 蛋白表达水平(P<0.01),LPS处理极显著提高TLR4和NF-κBp65 蛋白水平表达(P<0.01),花青素+LPS处理TLR4和NF-κBp65 蛋白水平表达极显著提高(P<0.01);与LPS组相比,花青素处理组极显著降低了TLR4和NF-κBp65蛋白水平表达(P<0.01),花青素+LPS处理组TLR4,NF-κBp65 蛋白水平表达极显著降低(P<0.01)。

图4 黑枸杞花青素对LPS诱导小鼠Raw264.7 细胞中TLR4/NF-кB通路相关蛋白表达的影响

与空白组对比,*P<0.05,**P<0.01 ;与LPS处理组对比,#P<0.05,##P<0.01。下同
图1 黑枸杞花青素对小鼠Raw264.7细胞炎性相关因子含量的影响
3 讨论
巨噬细胞是参与机体免疫应答反应的重要成分,在多种疾病中有效发挥其吞噬作用,是机体抵御细菌感染和癌症的第1道防线,因此,它们在启动适应性免疫应答中扮演着重要的角色并参与自身免疫性疾病、感染和炎症性疾病的发病机制[9]。LPS 为革兰阴性细菌细胞壁的主要成分,能够刺激巨噬细胞产生过量的炎症介质(如NO和TNF-α)以及炎性细胞因子(如IL-1β和 IL-6),这些物质通过与其他炎症介质的协同作用促进过敏性哮喘等炎症性疾病的发生与发展[10-12]。TNF-α、 IL-1β、 IL-6 为炎症反应中的主要炎症因子,是反应炎症水平的重要指标[13]。花青素属于酚类中的类黄酮物质,是一类植物中广泛存在的水溶性天然色素,研究证明,花青素具有抗炎、抗氧化、清除自由基等作用[14-15]。本试验通过LPS诱导小鼠巨噬细胞Raw264.7损伤,来探讨黑枸杞花青素对LPS诱导的损伤的作用机制。结果表明,与对照组相比,LPS处理组IL-6、TNF-α的含量与mRNA表达均极显著升高(P<0.01),IL-10和INF-γ的含量和mRNA表达均显著升高(P<0.05),与LPS组比较,花青素+LPS处理组IL-6、IL-10、TNF-α和INF-γ的含量和mRNA表达显著降低(P<0.05)。表明黑枸杞花青素对LPS诱导的炎症具有抑制作用。
Toll样受体 4(TLR4)是机体中参与免疫调节的重要蛋白分子[16-17]。NF-κB 是炎症反应过程中重要的基因转录调控因子,其家族成员主要包括 p65 和 p50[13]。正常生理情况下, NF-κB(p50/p65)以异二聚体形式存在于细胞质中;在炎症(如LPS) 刺激条件下, NF-κB 信号通路被激活后 NF-κB-p65 由细胞质移位至细胞核,进而促进 TNF-α、 IL-6、 IL-1β、 iNOS 等炎性因子的释放[18-19]。被 NF-κB 诱导表达的炎症因子进一步反馈活化 NF-κB,诱导 NF-κB 的持续性活化, 从而加重炎症损伤[20]。因此,抑制 TLR4 /NF-κB 信号通路蛋白的活化可能是炎症治疗的作用靶点[21-22]。本研究中,通过RT-PCR及蛋白免疫印迹试验分别检测了TLR4/NF-κB、MyD88和TRAF6的mRNA表达水平及TLR4和NF-κBp65蛋白水平。结果显示,与空白组对比,LPS处理极显著上调TLR4、NF-κB和MyD88的mRNA表达水平及TLR4和NF-κBp65 蛋白水平(P<0.01),显著提高了TRAF6的mRNA表达水平(P<0.05),与LPS组对比,花青素+LPS处理TLR4、NF-κB、MyD88和TRAF6的mRNA表达水平显著降低(P<0.05)并且显著下调TLR4,NF-κBp65 蛋白水平(P<0.01)。表明黑枸杞花青素对小鼠Raw264.7细胞中的TLR4 /NF-κB 信号通路具有抑制其活化的调控作用。
综上所述,黑枸杞花青素对LPS诱导的小鼠Raw264.7细胞炎症具有保护作用,其作用机制可能是通过抑制 TLR4/NF-κB 信号通路的活化,进而抑制促炎细胞因子IL-6、TNF-α和INF-γ的表达,从而发挥抗炎作用。
