预冷处理结合低温贮藏对西兰花贮藏品质的影响
2021-06-17谢晓宇谢意通
谢晓宇,张 飞,石 洁,谢意通,姜 丽
(南京农业大学食品科技学院,江苏南京 210095)
西兰花(Brassica oleraceavar.italica)又名青花菜、绿菜花等,是十字花科芸薹属甘蓝种的一个变种,原产于地中海沿岸意大利一带[1]。改革开放后引种到国内种植生产,因富含维生素C、酚类物质以及硫代葡萄糖苷,具有抗癌的功效,被人们赋予“蔬菜皇冠”的美称,深受消费者青睐,在我国种植面积逐步扩大,成为我国主要的栽培种植蔬菜之一[2]。
室温下,西兰花采后代谢旺盛、易衰老,利于微生物生长繁殖,在低温下可有效减缓果蔬的呼吸代谢,抑制微生物的生长繁殖,提高果蔬的贮藏期。王顺玉等[3]研究了不同预冷方式对西兰花货架期品质的影响,结果发现冰预冷和冷水预冷处理可以有效抑制西兰花黄化,保持西兰花的色泽和良好的感官品质。赵维琦等[4]研究西兰花在真空预冷条件下与常压冷藏的区别,发现真空预冷处理的西兰花感官品质更佳,能保持较高的可溶性蛋白质、总糖、维生素C等营养成分。王娟等[5]研究预冷方式对黄花菜贮藏品质的影响,发现真空预冷可以有效降低黄花菜呼吸强度、延缓感官品质的劣变较高的抗氧化酶活力。蒋占军等[6]对采收后的西兰花进行低温冷藏4 ℃处理,发现低温可抑制花蕾中的叶绿素a、叶绿素b、维生素C含量和实际光化学效率的降低。Sabine等[7]发现低温可显著降低鲜切生菜的呼吸强度,保持其商品价值。高雪等[8]对鲜切西兰花在冰温和4 ℃下贮藏进行比较,发现冰温贮藏的鲜切西兰花在贮藏结束时外观更佳,营养物质损失少,更好地保持了其商品性。预冷和低温处理已有广泛的研究,而二者结合用于西兰花的相关报道还较少。本文通过感官评定和测定生理生化指标,探讨预冷+低温处理对西兰花采后品质的影响,为延长西兰花货架期提供理论依据。
1 材料与方法
1.1 材料与仪器
供试用西兰花 品种“苏青6号” 采于江苏省响水县,采收时选取大小均匀、成熟度一致、花球紧实的西兰花;碎冰 江苏省响水县西兰花基地;无水乙醇 分析纯,禹城市浩炜化工有限公司;丙酮分析纯,宁波市镇海雷神化工有限公司;十二水合磷酸氢二钠 分析纯,艾万拓威达优尔国际贸易(上海)有限公司;二水合磷酸二氢钠 分析纯,斯百全化学(上海)有限公司;过氧化氢 分析纯,南京化学试剂有限公司;萝卜硫素 分析纯,南京百慕达生物科技有限公司;三氯乙酸 分析纯,濮阳市金鼎化工有限公司。
红外二氧化碳分析仪 北京力科惠泽科技有限公司;彩色色差仪CR-400 常州首丰仪器科技有限公司;Alpha-1860A 紫外-可见分光光度计 上海谱元有限公司;KQ-300DB 数控超声波清洗器 昆山市超声仪器有限公司;DHG-9030A 电热恒温鼓风干燥箱 上海益恒实验仪器有限公司;SQP 电子天平赛多利斯科学仪器有限公司;HH-6 数显恒温水浴锅 常州国华电器有限公司;TGL16M 台式高速冷冻离心机 长沙维尔康湘鹰离心机有限公司。
1.2 实验方法
1.2.1 样品处理与贮藏 采收的西兰花,处理组花球经表面覆冰(约4 cm厚)预冷处理后,3 h运回实验室,贮藏在冰箱,温度控制在(0±1) ℃。对照组常温运回实验室,(20±1) ℃贮藏。
对照组分别在第0、1和3 d取样。预冷+低温组分别在第0、1、3、10、17、24、31 d取样。每个时间点随机取10 个西兰花试验样品。取得的测定材料以鲜样测定颜色和呼吸指标,并从花球上取下花蕾样品,样品迅速用液氮冷冻,再放置于-80 °C冰箱内保存,用于后期生理生化分析,处理组与对照组均设3个平行。
1.2.2 感官评定 参照徐斐燕等[9]方法略加修改进行感官评定。根据西兰花的颜色、硬度、气味和花球紧实度等以9分制法评分。9分:新鲜、颜色深绿、品质完好、表面无斑点、花球紧实、硬度好;7分:比较新鲜、颜色较好、花球紧实、无异味、有较好的硬度;5分:颜色较绿、硬度下降、花球松软,无异味、具有商品性;3分:新鲜程度低、黄化面积在30%以下、硬度较差、出现异味、失去商品价值;1分:大面积黄化、花球出现掉落、有异味、有斑点。
1.2.3 呼吸强度的测定 参照张心怡等[10]的测定方法,采用便携式红外二氧化碳分析仪测定。单位为mg/(h·kg·FW)。
1.2.4 色差的测定 参照孟一等[11]的方法,采用彩色色差仪CR-400测定。以标志白板进行色差计调零,之后在对每颗西兰花上均匀选择五个点进行测定。
1.2.5 叶绿素含量的测定 参照安荣等[12]方法,以丙酮-乙醇混合液提取法测定,叶绿素含量以mg/g表示。
1.2.6 叶绿素酶活性的测定 参照Luo等[13]的方法略加修改,取1 g冷冻样品,用预冷的丙酮研磨后,用丙酮多次洗脱除去叶绿素。取沉淀加入3 mL 50 mmol/L pH7.0磷酸缓冲液(含50 mmol/L KCl,Triton-X100),30 ℃抽提30 min,高速冷冻离心机离心后,取上清液,即为粗酶液用于后续测定。
底物溶液的制备:取5 g菠菜叶片在液氮中研磨,研磨后倒入50 mL离心管中,加入10 mL预冷的丙酮,提取12 h,提取液在12000 × g、4 ℃条件下离心10 min,取上清液在645、663 nm下测定吸光度,由公式C(μg/mL)=12.7A663-2.69A645算出叶绿素a的浓度,用丙酮稀释叶绿素a到20 μg/mL。
在试管中加入0.3 mL 20 μg/mL叶绿素a丙酮溶液、0.2 mL Triton-X100和0.5 mL pH7.5磷酸缓冲液,振荡均匀后加入0.5 mL粗酶液。黑暗条件下40 ℃水浴80 min,最后加入4 mL预冷的丙酮与正己烷终止反应,高速冷冻离心机离心5 min,取丙酮层测定667 nm处吸光值。酶活性以每小时鲜重样品水解的叶绿素a计算,单位为ΔOD667/(h·g·FW)。
1.2.7 维生素C含量的测定 采用钼蓝比色法测定[14]。称取2 g西兰花样品于研钵中,加入草酸-EDTA溶液研磨后,12000 × g离心15 min。取2 mL上清液,加入3 mL 6%钼酸铵、1 mL偏磷酸-醋酸溶液、9 mL草酸-EDTA溶液、3 mL6%硫酸,充分振荡摇匀后,80 ℃水浴10 min,定容至25 mL,839 nm测定吸光值。维生素C含量(mg/g)=c·v0/(w·v)。
1.2.8 总硫代葡萄糖苷含量的测定 采用苯酚硫酸法进行测定[15]。称两份0.5 g样品,一份加2 mL 40%酸化甲醇,此为对照;另一份加2 mL水。研磨后静置20 min,再加入8 mL 40%酸化甲醇终止反应。摇匀后,高速冷冻离心机12000 × g离心15 min,取上清液。然后依次加入5 mL蒸馏水、5 mL乙酸锌溶液和5 mL 10.6%的亚铁氰化钾溶液,定容至50 mL。静置30 min后过滤,吸取1 mL滤液,加入1 mL蒸馈水、2 mL 6%苯酚和5 mL浓硫酸,摇匀后沸水浴15 min,取出冷却后,测定490 nm吸光度。
1.2.9 异硫氰酸酯含量的测定 参照丁艳[16]的方法,采用异硫氰酸酯硫脲比色法进行测定,异硫氰酸酯含量以mg/100 gFW表示。
1.2.10 总酚含量的测定 参照王志同等[17]的方法,采用福林酚法测定,总酚含量以mg/g表示。
1.2.11 DPPH自由基清除力的测定 DPPH(1,1-二苯基苦基苯肼,1,1 -diphenyl-2-picrylhydrazyl)自由基清除力的测定参照吴都峰[18]的方法略加修改,称取0.5 g西兰花样品,加入5 mL 50%乙醇研磨,12000×g离心15 min,取上清液。取4只试管,分别标为A0、A1、A2和A3,A0管加入蒸馏水、95%乙醇各2.5 mL为调零管,A1加入上清液、DPPH溶液各2.5 mL,A2加入上清液、95%乙醇各2.5 mL,A3加入蒸馏水、DPPH溶液各2.5 mL,测定517 nm吸光值,结果以清除百分率表示。根据公式:DPPH自由基清除力(%)=[(A3-(A1-A2) ]/ A1×100计算。
1.2.12 过氧化物酶活性的测定 采用愈创木酚法[19]。称2 g西兰花于研钵中,加入5 mL磷酸缓冲液(100 mmol/L pH 6.0)研磨,12000×g离心15 min,取上清液即为粗酶液。对照管加入3 mL反应混合液(100 mmol/L磷酸缓冲液,280 μL愈创木酚,190 μL 30% H2O2)和0.1 mL缓冲液;测定管加入3 mL反应混合液和0.1 mL酶液,测470 nm吸光值变化,以每克样品每分钟吸光值变化0.001为1个酶活力单位,单位为U/(g·FW·min)。
1.2.13 过氧化氢酶活性的测定 参照杨节[20]的测定方法略加修改测定。称0.5 g西兰花样品,加入6 mL预冷的 pH7.8磷酸缓冲液研磨,12000×g离心15 min,取上清液,即为粗酶液。测定管内含1.9 mL蒸馏水,1 mL 0.2% H2O2,0.1 mL酶液。在240 nm处测定吸光度变化。以每克样品每分钟吸光值变化0.001为1个酶活力单位,单位为U/(g·FW·min)。
1.2.14 抗坏血酸过氧化物酶活性的测定 参照孙云[21]的测定方法略加修改。称取样品2 g,加入磷酸缓冲液(pH7.8,50 mmol/L)6 mL,研磨匀浆后12000×g离心15 min,上清液作酶粗提液供测定。3 mL反应混合液中含PBS缓冲液(pH7.8,50 mmol/L)1.1 mL,抗坏血酸(30 mmol/L)1.5 mL,酶液0.1 mL,H2O2(1 mmol/L)0.3 mL。测定290 nm处吸光值变化。以每克样品每分钟吸光值变化0.01为1个酶活力单位,单位为U/(g·FW·min)。
1.2.15 丙二醛含量的测定 采用硫代巴比妥酸法测定[22]。取2 g西兰花样品,加5 mL 5%三氯乙酸溶液冰浴研磨,12000×g离心15 min。取上清液2 mL,加入2 mL 硫代巴比妥酸溶液,摇匀后沸水浴30 min,冷却后在450、532和600 nm处测定吸光值。根据公式c (μmol/L)=6.45×(OD532-OD600)-0.56×OD450计算MDA浓度。
1.3 数据处理
采用Excel 2016软件进行数据统计,用邓肯多重比较方法进行差异显著性分析。SPSS Statistics 21进行相关性分析、主成分分析。每次实验重复3次,取其平均值。
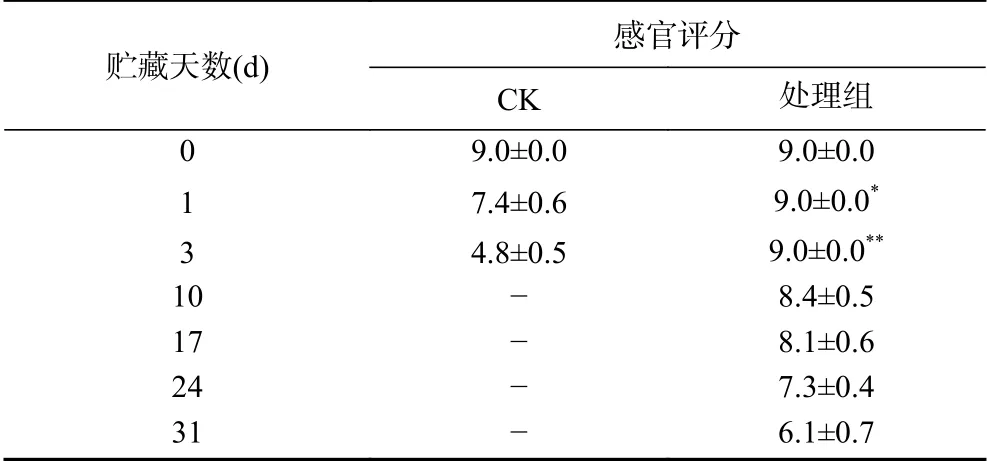
表1 预冷处理结合低温贮对藏西兰花感官品质的影响Table 1 Effect of pre-cooling treatment combined with low temperature storage on sensory quality of broccoli
2 结果与分析
2.1 西兰花贮藏期间感官品质的变化
在贮藏期间各处理组西兰花的感官品质逐渐下降(表1),由于温度的差异,对照组在第3 d失去商品价值,而处理组在第31 d时出现部分黄化。第1 d时,对照组西兰花感官品质显著(P<0.05)降低,其感官评分为7.4,而处理组西兰花感官品质基本不变,保持了极高的新鲜程度,直到贮藏结束仍然保持着较好的商品价值,与刘瑶等[23]的研究结果相一致。
2.2 西兰花贮藏期间呼吸强度变化
呼吸强度是植物新陈代谢强弱的重要指标。西兰花在不同的环境,其呼吸强度会有不同。采后西兰花贮藏期间呼吸强度的变化如图1所示,贮藏第1 d时,对照组呼吸强度约为处理组的1.5倍,整个贮藏期间,对照组呼吸强度都高于处理组。表明预冷处理结合低温贮藏可以显著(P<0.05)抑制呼吸强度的上升,使西兰花的营养物质消耗减慢,延长其贮藏期[24]。
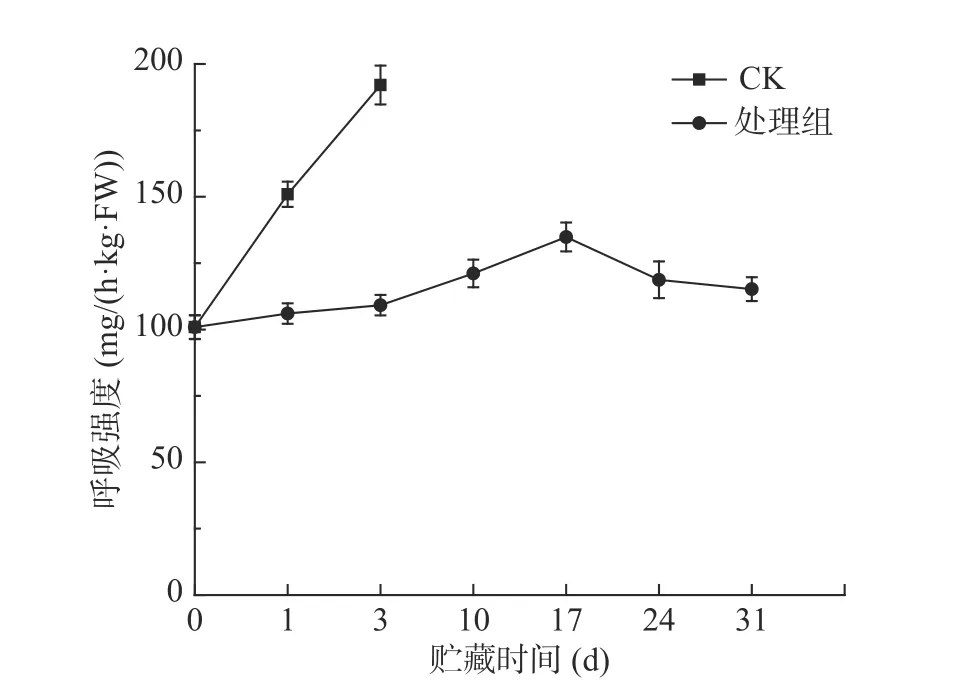
图1 预冷处理结合低温贮藏对西兰花呼吸强度的影响Fig.1 Effect of pre-cooling treatment combined with low temperature storage on respiration rate of broccoli
2.3 西兰花贮藏期间色差a*、b*值变化
a*值表示红绿程度,b*代表黄蓝程度。在两种条件下,a*值与b*值总体上呈上升趋势(图2),处理组西兰花在整个贮藏期内a*、b*值低于对照组。贮藏第1 d,处理组a*值为-9.67,b*值为7.43,对照组a*值为-7.64,b*值为11.35;在贮藏结束时,处理组a*值为-8.37,b*值为9.01,对照组a*值为-7.36,b*值为15.35,预冷处理结合低温贮藏保绿效果显著(P<0.05)。
2.4 西兰花贮藏期间叶绿素含量及叶绿素酶活性变化
叶绿素是植物绿色的来源。在正常生长的果蔬中,叶绿素分解作用小于合成作用,颜色不会发生变化,当果蔬进入成熟期后或采收后,合成作用逐渐停止,叶绿素在酶的作用下逐渐降解,叶绿素酶是叶绿素降解途径的关键组成酶之一,可以催化叶绿素及其衍生物侧链酯键水解,生成脱植基叶绿素和植醇[25]。
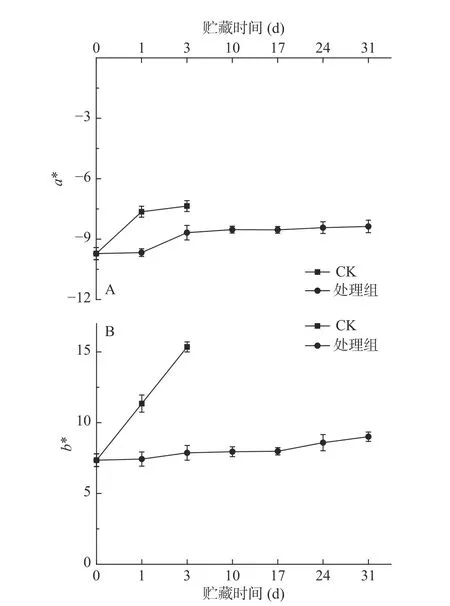
图2 预冷处理结合低温贮藏对西兰花颜色的影响Fig.2 Effect of pre-cooling treatment combined with low temperature storage on color of broccoli
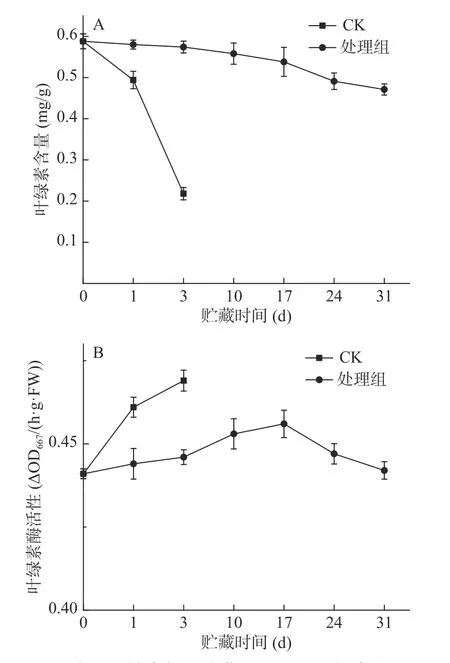
图3 预冷处理结合低温贮藏对西兰花叶绿素含量(A)及叶绿素酶活性(B)的影响Fig.3 Effect of pre-cooling treatment combined with low temperature storage on chlorophyll content(A) and chlorophyllase activity(B) of broccoli
在贮藏期间,各组西兰花的叶绿素含量逐渐下降(图3A),贮藏第1 d,对照组叶绿素损失率为15.98%,处理组仅为1.36%,整个贮藏期处理组都低于对照组,可见采后预冷处理结合低温贮藏可以显著(P<0.05)抑制叶绿素降解。对照组和处理组叶绿素酶活性在贮藏期间变化幅度不大(图3B)。第1 d时,处理组叶绿素酶活性升高了0.67%,对照组叶绿素酶活性升高了4.34%,处理组显著(P<0.05)低于对照组;整个贮藏期,对照组叶绿素酶活性持续增加,处理组叶绿素酶活性先上升后下降,预冷处理结合低温贮藏西兰花维持着较低的叶绿素酶活性。
对叶绿素含量和叶绿素酶活性进行Pearson相关性分析,相关系数为-0.747,叶绿素含量与叶绿素酶活性呈极显著负相关(P<0.01)。综上可知,叶绿素酶活性增加会促进叶绿素的降解,预冷处理结合低温贮藏较好地抑制了这一过程,因而保持了较高的叶绿素含量[26]。
2.5 西兰花贮藏期间维生素C含量的变化
维生素C(Vitamin C,VC)具有调节物质代谢、清除自由基、阻断化学致癌物等作用,存在于新鲜水果蔬菜中,是果蔬新鲜程度重要评判标准[27]。贮藏期间,西兰花维生素C含量均呈下降趋势(图4),处理组下降较为缓慢。贮藏第1 d,对照组维生素C含量为1.42 mg/g,处理组维生素C含量为1.46 mg/g;在贮藏期结束时,对照组西兰花维生素C的损失率为14.16%,而处理组西兰花维生素C的损失率为7.92%,仅为对照组的一半,证明预冷处理结合低温贮藏能显著(P<0.05)抑制西兰花VC的降解。江英等[28]等研究近冰点温度对草莓贮藏保鲜效果也发现近冰温贮藏可以有效抑制VC的减少,与本实验的结果一致。
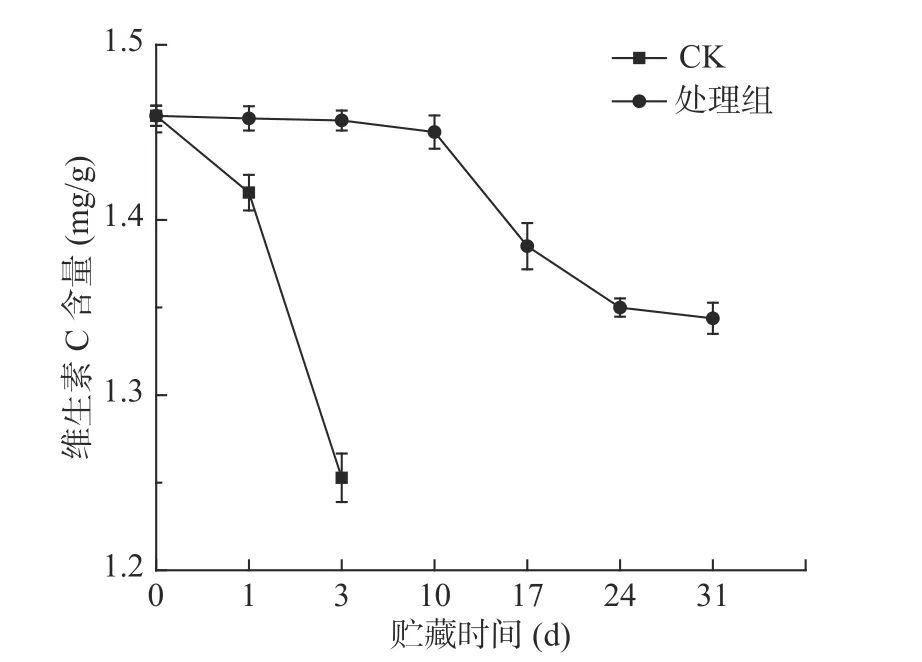
图4 预冷处理结合低温贮藏对西兰花维生素C含量的影响Fig.4 Effect of pre-cooling treatment combined with low temperature storage on the content of VC in broccoli
2.6 西兰花贮藏期间总硫代葡萄糖苷、异硫氰酸酯含量的变化
硫代葡萄糖苷(Glucosinolates,GLS),是十字花科蔬菜中的一种重要的次生代谢产物,容易在内源芥子酶的作用下,水解生成异硫氰酸盐和腈类等物质,增强植物的防御能力,并有大量研究证实,至少二十多种硫代葡萄糖苷降解产物具有抗肿瘤的作用[29]。在整个贮藏过程中,西兰花的总硫代葡萄糖苷呈下降趋势(图5A),与对照组相比,处理组西兰花下降速度缓慢。贮藏第1 d时,处理组总硫代葡萄糖苷含量约为对照组的1.2倍;在整个贮藏期间处理组都显著(P<0.05)高于对照组,原因可能是低温能保持膜结构完整性,抑制了内源芥子酶对硫代葡萄糖苷的催化作用。
西兰花的异硫氰酸酯(Isothiocyanates,ITCs)含量在贮藏期间持续下降(图5B),其原因可能是异硫氰酸酯与OH-离子发生化学反应,造成了异硫氰酸酯的分解[30]。与对照组相比,处理组保持了较高的异硫氰酸酯含量,在贮藏第1 d后呈显著差异(P<0.05),异硫氰酸酯含量在第31 d达241.41 mg/100 g·FW。结果表明,预冷处理结合低温贮藏可以有效延缓西兰花在货架期间异硫氰酸酯降解。

图5 预冷处理结合低温贮藏对西兰花总硫代葡萄糖苷(A)、异硫氰酸酯含量(B)的影响Fig.5 Effect of pre-cooling treatment combined with low temperature storage on total glucosinolate content(A) and isothiocyanates content(B) in broccoli
2.7 西兰花贮藏期间总酚含量、DPPH自由基清除力的变化
酚类物质是一种植物次生代谢产物,它们与果蔬的品质、风味、褐变、抗逆性等密切相关,还与果蔬的贮藏、加工性能,营养价值和医疗保健作用等具有很大关联[31]。两种条件下总酚含量呈上升趋势(图6A),处理组的西兰花总酚含量在贮藏初期持续上升,从第10 d开始,上升速度减慢,趋势平缓。贮藏第1 d,处理组西兰花总酚含量为1.01 mg/g,对照组总酚含量为0.84 mg/g,处理组总酚含量显著(P<0.05)高于对照组。在贮藏结束时,处理组总酚含量达到1.44 mg/g,而对照组为1.19 mg/g,预冷处理结合低温贮藏显著(P<0.05)提高了西兰花总酚含量。
DPPH自由基清除力可以反映果蔬的抗氧化活性,是评价物质清除DPPH自由基的重要指标[32]。在贮藏期间,两处理组西兰花DPPH自由基清除能力均呈下降趋势(图6B),处理组明显下降缓慢,保持了较高的DPPH自由基清除能力。贮藏第1 d时处理组的DPPH自由基清除力为92.95%,对照组为88.54%,处理组显著高于对照组(P<0.05);在第3 d时,处理组的DPPH自由基清除力为91.65%,而对照组为84.77%,说明预冷处理结合低温贮藏可延缓西兰花DPPH自由基清除能力的下降。与对照组相比,预冷处理结合低温贮藏西兰花保持较高的DPPH自由基清除力可能与其较高的总酚含量有关,较高抗氧化能力减少了膜脂过氧化产物丙二醛的积累,从而保持西兰花组织细胞的完整性,延缓西兰花衰老[33-34]。
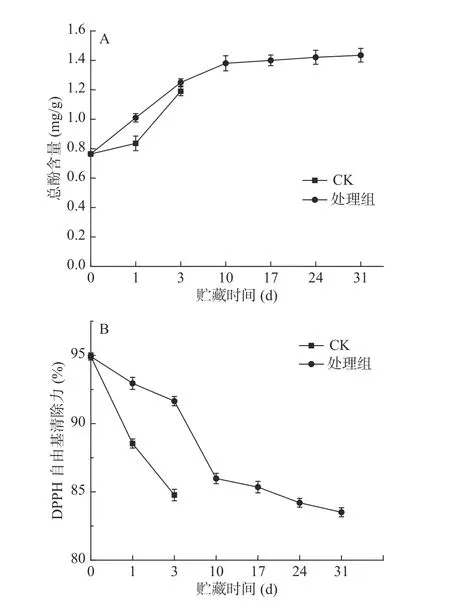
图6 预冷处理结合低温贮藏对西兰花总酚含量(A)、DPPH自由基清除力(B)的影响Fig.6 Effect of pre-cooling treatment combined with low temperature storage on total phenols content(A) and DPPH radical scavenging activity(B) in broccoli

图7 预冷处理结合低温贮藏对西兰花POD(A)、CAT(B)和APX(C)活性的影响Fig.7 Effect of pre-cooling treatment combined with low temperature storage on POD(A),CAT(B) and APX(C)activity of broccoli
2.8 西兰花贮藏期间抗氧化物酶活性变化
过氧化物酶(Peroxidase,POD)的活力与果蔬产品,特别是那些非酸性蔬菜在保存期间形成的不良风味、酶促褐变以及果蔬的木质化有关[35]。在贮藏期间,对照组和处理组西兰花的POD随着贮藏时间的延长都不断上升(图7A)。对照组始终高于处理组。表明预冷处理结合低温贮藏可以显著(P<0.05)抑制西兰花POD的上升。研究证明,POD参与叶绿素的代谢过程,催化酚类物质与H2O2的反应,其产物可催化叶绿素水解[36]。预冷处理结合低温贮藏抑制POD活性,减缓了叶绿素的降解,保持了较好的品质。
过氧化氢酶(catalase,CAT)普遍存在于果蔬组织中,能清除果蔬代谢产生的H2O2,防止H2O2的积累造成果蔬细胞的损伤[37]。在贮藏期间对照组和处理组西兰花的CAT活性都呈下降趋势(图7B),处理组的CAT活性下降趋势平缓,高于对照组。预冷处理结合低温贮藏可以显著(P<0.05)保持西兰花CAT活性,从而保持西兰花细胞的完整性。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)是以抗坏血酸为电子供体的专一性很强的过氧化物酶,其组成的AsA-GSH循环可以清除植物组织内的H2O2,与果蔬的衰老和抗逆性息息相关[38]。贮藏期间两组西兰花APX活性都呈下降趋势(图7C),处理组西兰花APX活性下降缓慢,第1 d时下降了0.79%,对照组下降了11.68%;贮藏结束时,处理组下降了16.83%,显著(P<0.05)低于对照组的29.37%,预冷处理结合低温贮藏可以抑制西兰花APX活性下降。
处理组维持了更高的CAT、APX活性,减少了西兰花组织内H2O2的积累,从而延缓叶绿素降解,使西兰花保持较好的品质[39]。
2.9 西兰花贮藏期间丙二醛含量的变化
贮藏期间西兰花丙二醛(Malonaldehyde,MDA)含量呈上升趋势(图8),对照组西兰花MDA含量显著(P<0.05)高于处理组。第1 d时,处理组丙二醛含量仅为对照组的二分之一,在整个贮藏期间,处理组均显著(P<0.05)低于对照组。结果表明预冷处理结合低温贮藏能有效抑制脂膜过氧化,减小西兰花组织细胞膜受到损伤,延缓西兰花衰老。陈禹兴等[40]对小麦进行低温处理,发现可以显著抑制MDA的积累,与本实验结果一致。
2.10 相关性分析
对西兰花各指标进行Pearson相关性分析,结果见表2。西兰花的外观颜色是评价其商品价值最直观的指标。叶绿素是一种可以使植物呈现绿色的色素[41]。相关性分析发现,西兰花的颜色a*值、b*值与叶绿素含量呈极显著(P<0.01)负相关;a*值、b*值与叶绿素酶呈极显著(P<0.01)正相关;叶绿素与POD活性呈显著(P<0.05)负相关,与CAT、APX呈显著(P<0.05)正相关。西兰花中的维生素C不仅可以提供营养,还具有抗氧化作用,维生素C与APX呈显著(P<0.05)正相关。西兰花除了营养物质丰富,还具有抗肿瘤的功效,这一功效与GLS、ITCs息息相关[42]。从表2、表3可以看出,GLS、ITCs与MDA呈显著(P<0.05)负相关,与呼吸强度显著(P<0.05)负相关。从分析结果看,西兰花各指标之间均存在一定的联系,一些生理指标虽未达到显著相关,仍可为西兰花品质分析提供科学依据[43]。
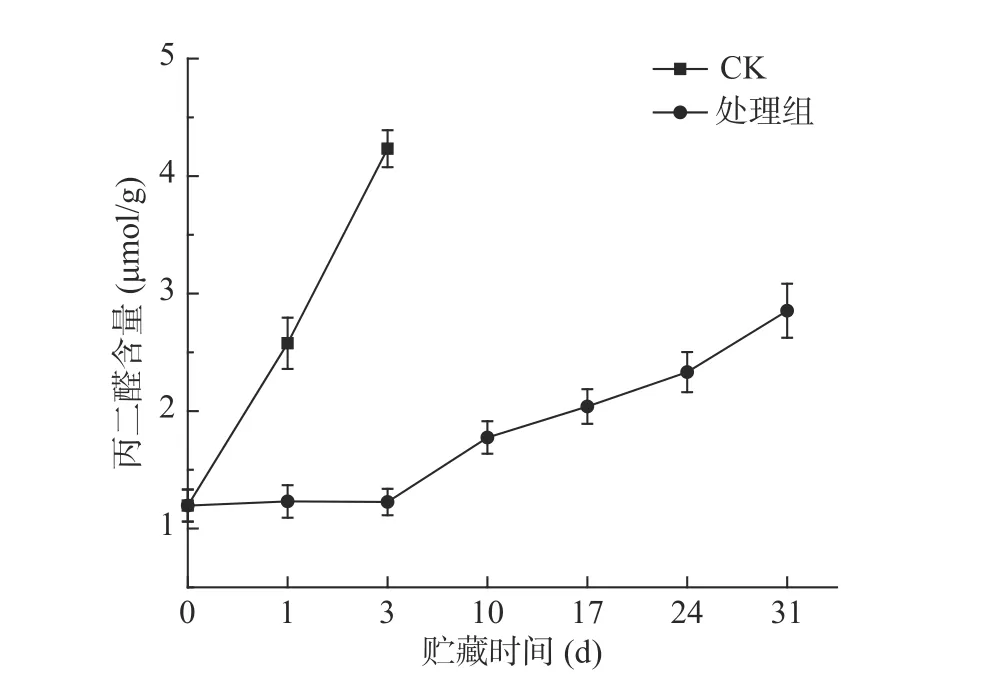
图8 预冷处理结合低温贮藏对西兰花丙二醛含量的影响Fig.8 Effect of pre-cooling treatment combined with low temperature storage on malondialdehyde content in broccoli

表2 西兰花测定指标的Pearson相关性分析Table 2 Pearson correlation analysis of broccoli indicators
2.11 主成分分析
对14种西兰花理化指标进行主成分分析,得到西兰花品质特性主成分的特征值及累计贡献率见表3。提取三个主成分,累计方差贡献率为88.084%,能够代替大部分原始数据。第1主成分贡献率为56.999%,第2主成分贡献率为17.861%,第3主成分贡献率为13.224%。由表4可知,第1主成分中叶绿素载荷0.977占比最高、CAT载荷0.944位于其次,叶绿素和CAT可作为第1主分量中的代表性评价指标,分别为品质指标和抗氧化指标。第2主成分中贡献最大的是GLS,载荷0.878,其次为叶绿素酶,载荷0.779,是第2主分量的代表性评价指标,GLS与叶绿素酶分为西兰花的营养指标和品质指标。第3主成分中贡献最大的是呼吸强度,载荷0.775,其次为丙二醛含量,载荷0.539,呼吸强度与丙二醛含量为第3主分的代表性评价指标,可以代表西兰花的衰老程度。因此,叶绿素含量、CAT活性、总硫代葡萄糖苷含量、叶绿素酶活性、呼吸强度和丙二醛含量可作为评价西兰花品质特性的指标,其中,叶绿素含量载荷0.977占比最高,对于西兰花的品质尤为重要。
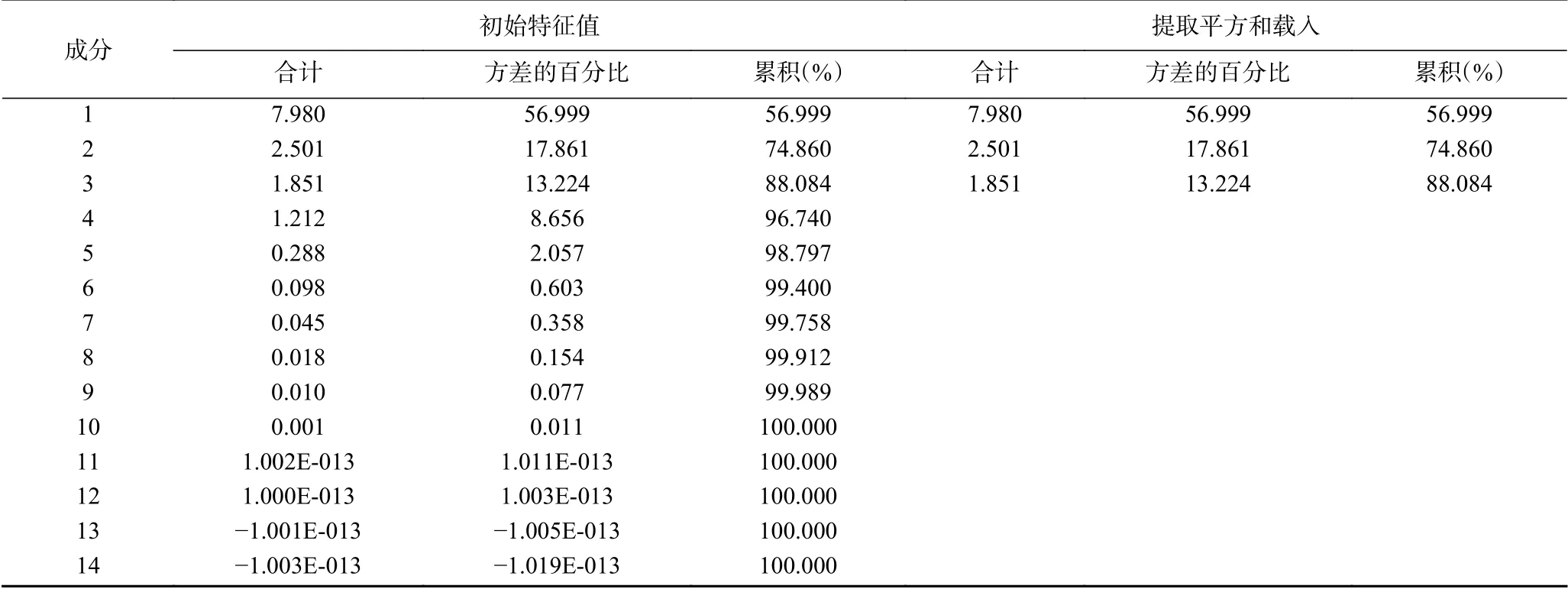
表3 主成分特征值及方差贡献率Table 3 Principal component eigenvalue and variance contribution rate

表4 成分矩阵Table 4 Composition matrix
3 结论
本文研究了预冷处理结合低温贮藏对西兰花采后品质的影响。结果表明,预冷处理结合低温贮藏西兰花,可以延缓黄化,可以保持较低的呼吸强度,延缓VC、叶绿素、硫代葡萄糖苷和异硫氰酸酯含量的下降,提高总酚含量和DPPH自由基清除能力,同时保持APX、CAT、叶绿素酶活性,抑制POD活性,降低MDA的累积,可有效延长西兰花贮藏期至31 d。相关性分析结果得知,西兰花的颜色与其叶绿素代谢密切相关,叶绿素含量与叶绿素酶呈极显著(P<0.01)负相关,与POD活性呈显著(P<0.05)负相关;硫代葡萄糖苷、异硫氰酸酯含量与MDA含量呈显著(P<0.05)负相关,西兰花各指标均有一定的联系,可以为西兰花营养价值利用与分析,提供科学依据。主成分分析结果表明,叶绿素含量、CAT活性、总硫代葡萄糖苷含量、叶绿素酶活性、呼吸强度和丙二醛含量可作为评价西兰花品质特性的关键指标。
